Az anyai zsírtartalmú étrend az ILC3-ok mikrobiotától függő terjeszkedését eredményezi az egerek utódainál
Sarah Thomas Babu
1 újszülött-perinatális orvoslás osztály, Gyermekgyógyászati Osztály és
Xinying Niu
1 újszülött-perinatális orvoslás osztály, Gyermekgyógyászati Osztály és
Megan Raetz
2 Immunológiai Tanszék, Texasi Egyetem Southwestern, Dallas, Texas, USA.
Rashmin C. Savani
1 újszülött-perinatális orvoslás osztály, Gyermekgyógyászati Osztály és
Lora V. Hooper
2 Immunológiai Tanszék, Texasi Egyetem Southwestern, Dallas, Texas, USA.
Julie Mirpuri
1 újszülött-perinatális orvoslás osztály, Gyermekgyógyászati Osztály és
Társított adatok
Absztrakt
Az anyai elhízás és a magas zsírtartalmú étrend (HFD) a perinatális periódus alatt rövid és hosszú távú káros eredményeket dokumentált az utódok számára. Az anya HFD-jének újszülött utódokra gyakorolt hatásának mechanizmusai azonban nem tisztázottak. Noha az anya HFD terhesség alatti expozíciójának az utódokra gyakorolt hatása egyre inkább felértékelődik, nem tudjuk, hogy az anyai HFD megváltoztatja-e a mikrobiotát, vagy befolyásolja-e az újszülöttek hajlamát a gyulladásos állapotokra, sem az érintett mechanizmusokat. Ebben a tanulmányban megmutatjuk, hogy a HFD-nek kitett anyák utódai egyedülálló mikrobiotát fejlesztenek ki, amelyet a Firmicutes terjeszkedése és az IL-17-termelő 3-as típusú veleszületett limfoid sejtek (ILC3) növekedése jellemez. Az ILC3-ok terjeszkedését csak HFD mikrobiotával végzett neokolonizációval összegeztük. Ezenkívül a HFD utódok fogékonyak voltak egy újszülöttkori gyulladásmodellre, amely reverzibilis volt az IL-17 blokáddal. Ezek az adatok együttesen azt sugallják, hogy az ILC3 korábban ismeretlen és egyedülálló szerepet játszott a HFD-nek kitett anyák utódai korai gyulladásos érzékenységének elősegítésében.
Bevezetés
Az átlagos, több mint 35% zsírtartalmú amerikai étrend hozzájárult az elhízás járványához az Egyesült Államokban és más fejlett országokban. A perinatális periódus alatt az anyák elhízása dokumentálta az utódok rövid és hosszú távú káros következményeit (1–3). Az Egyesült Államokban a fogamzóképes korú nők több mint 50% -a túlsúlyos vagy elhízott és magas zsírtartalmú étrendnek van kitéve (4). A HFD fogyasztása felnőtteknél a bél mikrobiomjának megváltozását és a colitis iránti érzékenységet eredményezi (5, 6). Míg az anya HFD terhesség alatti expozíciójának az utódokra gyakorolt hatása egyre inkább felértékelődik (7, 8), nem tudjuk, hogy az anyai HFD megváltoztatja-e a mikrobiotát, vagy befolyásolja-e az újszülöttek hajlamát a gyulladásos állapotokra, sem az érintett mechanizmusokat. A potenciális mechanizmusok magukban foglalják a bél mikrobiota megváltozását és a differenciális gazda-kommenzális immunválaszokat. Megpróbáltuk megérteni ezt a kapcsolatot azzal, hogy megvizsgáltuk, hogyan befolyásolja az anyai HFD az újszülött utódok mikrobiotájának fejlődését, és jellemzi ennek a változásnak a következményeit.
A megnövekedett bélbetegség számos betegséggel jár, nevezetesen a gyulladásos bélbetegséggel, az elhízással és a metabolikus szindrómával (9–12). Érdekes módon a Firmicutes család, a szegmentált fonalas baktériumok (SFB) tagjai kimutatták, hogy elősegítik a bélben a Th17-sejtek differenciálódását és terjeszkedését, és hozzájárulnak a fekélyes vastagbélgyulladásban megfigyelt gyulladáshoz felnőttekben (13–15). A szilárd expanzió megelőzi a nekrotizáló enterocolitis (NEC) (16) kialakulását, amely koraszülötteknél a bél pusztító gyulladásos betegsége jelentős morbiditást és mortalitást hordoz magában. Megjegyzendő, hogy az egerek csak 2 hetes életkor előtt hajlamosak a NEC-re, ami kevesebb, mint 30 hetes emberi terhességnek felel meg (17, 18). Így feltételeztük, hogy az anyai HFD-nek való kitettség megváltoztatja az utód mikroflóráját és potenciálisan veszélyezteti az utódokat a NEC-re.
Az IL-17 egy citokin, amely jelentős szerepet játszik a bél gyulladásos és fertőző betegségeiben. A 3. típusú veleszületett limfoid sejtek (ILC3) a Th17 sejtek veleszületett párja, és hasonló módon képesek termelni mind az IL-17-et, mind az IL-22-t. Elsősorban a bélrendszerben és a nyálkahártya szövetében találhatók. Döntő szerepet játszanak az immun homeosztázisban, a gazdaszervezet védekezésében és a betegség patogenezisében (19, 20). Az ILC3-k kölcsönhatásba lépnek a bél mikrobiotájával, és már a terhesség harmadik trimeszterében is jelen vannak egerekben. Az ILC3-k az emberi magzatok bélében is megtalálhatók (21, 22). A jelenlegi adatok arra utalnak, hogy a kommenzális baktériumok képesek lehetnek az ILC3 funkcionális válaszainak szabályozására TLR jelzéssel (23, 24).
Laboratóriumunk korábban kimutatta, hogy a 3 hetes kor előtti újszülött egerek egyedi mikrobiotával rendelkeznek, amelyet a proteobaktériumok terjeszkedése jellemez (25). Ezeknek az egereknek a gyulladásos citokinek kiindulási expressziója is növekszik, és fogékonyak egy újszülöttkori gyulladásmodellre (lipopoliszacharid és vérlemezke-aktiváló faktor [LPS/PAF] expozíció). A következő kísérletekben a tenyészegereket HFD-nek tettük ki, és megvizsgáltuk a bél mikrobiotáját és az utódok gyulladásra való hajlamát. Átfolyási citometriás technikákat és neokolonizációs kísérleteket is alkalmaztunk a mikrobiota és a lamina propria (LP) immunsejt populációk közötti kapcsolat meghatározására.
Eredmények
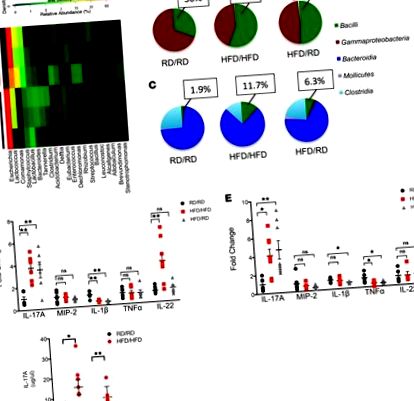
Az anya HFD-nek való kitettsége megváltoztatja a bél mikrobiotáját és növeli az IL-17-et az utódok kiindulásakor.
Az ILC3 populációt kibővítették a HFD utódok LP-jében.
Ezt követően arra kerestük a választ, hogy az IL-17-termelő sejtek az ILC3-ok specifikus növekedésének következményei voltak-e, és nem a Th17 sejtekben. Olyan Rag1 -/- egereket használtunk, amelyek hiányosak az érett T és B sejtekben, de még mindig vannak ILC-k. A tenyész Rag1 -/- egereknek HFD vagy RD hatásának kitétele után a HFD utódoknak megnőtt az IL-17-termelő ILC3 (3., A és B ábra), valamint a vastagbél mikrobiotájukban a Firmicutes növekedése (ábra 3C). Az áramlási citometriás festés megerősítette, hogy ezek 3-as típusú ILC-k (Rorγt +, CD127 +, CD117 +, NKp46 +, CD4-). Ezek az adatok azt mutatják, hogy a HFD utódok egyedülálló mikrobiotát fejlesztenek ki, amely az ILC3 specifikus növekedésével jár.
A HFD-nek kitett anyák utódai fokozottan hajlamosak a bélkárosodásra, amelyet megfordít az IL-17 blokkolása.
Az a megfigyelés, hogy a HFD-nek kitett anyák újszülött utódai hajlamosabbak az IL-17 által közvetített bélgyulladásra, betekintést nyújthatnak a koraszülöttek NEC-fejlődését ösztönző környezeti tényezőkbe. Vizsgálatunk az ILC3 jelentős szerepét mutatja a HFD utódok gyulladásra való hajlamában; azonban nem zárhatjuk ki más IL-17-termelő sejtek, köztük a Th17-sejtek és az IL-17-termelő γδ T-sejtek szerepét. Az IL-17 blokkolással kapott szövettani pontszám vad típusú egerekben alacsonyabb, mint a Rag1 -/- egerekben, ami e többi sejttípus szerepére utal. Felnőtt egerekben kimutatták, hogy a γδ T-sejtekből származó IL-17A-nak IL-23-független védőhatása van a bél áteresztőképességének csökkentésével a belekben (43). Az újszülött egerekben szignifikánsan több γδ T-sejt van, de a felnőttekhez képest viszonylag hyporeszponzívak (44, 45). Azt, hogy az anyai HFD emberi terhesség esetén a koraszülötteknél fokozza-e a NEC kockázatát, még meg kell vizsgálni. Ha úgy találják, adatunk a koraszülött csecsemők NEC-re vonatkozó potenciális terápiás megközelítéseit javasolja, akár a mikrobiota, az ILC3-ok vagy az IL-17 termelésének modulációja révén.
A bél mikrokörnyezet kialakulása egyedülálló, és kimutatták, hogy az étrend, az antibiotikumoknak való kitettség és az antibiotikum-leadás módja befolyásolja (46, 47). Vizsgálatunk az anyai étrend szerepét javasolja az utódok mikrobiomjának kialakulásának megváltoztatásában, és jelentős közegészségügyi következményekkel jár. A fogékony, gyulladásra, sőt akár elhízásra vagy metabolikus szindrómára hajlamos fenotípus átadása felveti az újszülöttek korai beavatkozásának lehetőségét a jövő betegségének megelőzése érdekében. Az étrend terhesség alatti megváltoztatása szintén eredményezheti a bél gyulladásos reakcióira való hajlam csökkenését újszülötteknél. Jövőbeni vizsgálatokra van szükség az utódok felnőttkori és újszülöttek fenotípusos változásainak megállapításához szükséges mechanizmusok megértésére.
Összefoglalva, tanulmányunk kiemeli az anyai HFD szerepét az utódok mikrobiotájának megváltoztatásában, az IL-17-termelő ILC3-ok következményes mikrobiotától függő terjeszkedésével és a gyulladásra való hajlam fokozásával.
Mód
Egerek és HFD modell
qRT-PCR
Következő generációs szekvenálás
A vastagbél tartalmát extraháltuk és a genomi DNS-t izoláltuk a ZR Fecal DNS miniprep (Zymo Research) alkalmazásával. Az Ion Torrent alkalmazásával végzett bakteriális Tag-kódolású szekvenálást vonalkódolt 28F-519R primerekkel hajtottuk végre a 16S rRNS gén V1 – V3 régiójához a Kutató és Tesztelő Laboratóriumban. Mintánként háromezer olvasást kaptunk. A FASTA-formátumú szekvenciák minőségét elemeztük, és kizártuk az elemzésből azokat a szekvenciákat, amelyek gyenge minőségű címkékkel, alapozóval, végekkel rendelkeznek, vagy amelyek nem voltak legalább 250 bp hosszúak.
Amint a FASTA formátumú szekvenciák minőségellenőrzött ellenőrzéseket végeztek a leírás szerint, minden megmaradó szekvencia azonosságát először úgy rendezték, hogy a FASTA formátumú fájl a leghosszabbtól a legrövidebbig olvasható legyen. Ezeket a szekvenciákat az USEARCH segítségével 96,5% azonossággal (3,5% divergencia) OTU klaszterekbe csoportosítottuk. Minden egyes klaszterhez a mag szekvenciát egy FASTA formátumú szekvencia fájlba tettük. Ezt a fájlt ezután lekérdeztük az NCBI-ből származó, kiváló minőségű szekvenciák adatbázisával, a BLASTN + (KrakenBLAST, www.krakenblast.com) felhasználásával működő, elosztott.NET algoritmus alkalmazásával. .NET és C # elemzési folyamat segítségével összeállítottuk a kapott BLASTN + kimeneteket és elvégeztük az adatok csökkentésének elemzését.
A fenti BLASTn + -ból származtatott szekvencia-azonossági százalék alapján a szekvenciákat a következő taxonómiai szinteken osztályoztuk a következő kritériumok alapján. Azon szekvenciák (azonosság a jól jellemzett 16S szekvenciákkal), amelyek meghaladják a 97% -ot (10 CFU-t egyszer az élet 3 napján és 2 héten át feláldozunk. Az egereket ezt követően 2 hetes korban elemeztük. Két kísérletet hajtottunk végre összesen 4–8 egér minden csoportban.
A bélkárosodás újszülött LPS/PAF modellje.
A bélnyálkahártya sérülését 2 hetes egérkölykökben LPS (1 mg/kg) és PAF (50 μg/kg) intraperitoneális beadásával indukálták. Az egereket 2 órával az LPS és a PAF beadása után feláldoztuk, és a vékonybél metszeteket Carnoy fixálóban rögzítettük, paraffinba ágyazottuk, és hematoxilinnel és eozinnal (H&E) festettük. A szövettani készítményeket Leica DM2000 mikroszkóppal vizsgáltuk át. A képeket Optronics Microfire CCD színes kamera és PictureFrame 2.0 felvevő szoftver (Optronics) segítségével × 20 nagyítással készítettük. A szövettani változásokat kettős-vak módon elemeztük 17 pontos skála alkalmazásával az alábbiak szerint. A kripta integritása: 0, normális; 1. szabálytalan kripták; 2, enyhe kripta veszteség; 3, súlyos kriptavesztés; 4. teljes kriptavesztés intakt hámsejtréteggel; 5. ábra: a kripták és a felszíni hám teljes elvesztése (10 kriptát). A gyulladásos sejtek nyálkahártyába való behatolásához: 0, normális; 1, enyhe; 2, szerény; és 3, súlyos. A submucosa behatolásához: 0, normális; 1, enyhe; 2, szerény; és 3, súlyos. Az izom behatolásához: 0, normális; 1, enyhe; 2, szerény; és 3, súlyos. Ezeket a pontszámokat hozzáadva 0 és 15 közötti összesített pontszámot eredményeztek. Három kísérletet végeztek mindegyik csoportban 4–6 egérrel.
Az IL-17 in vivo blokkolása.
A C57BL/6 egereket intraperitoneális injekcióval kezeltük 30 μg tisztított anti-egér IL-17A-val (TC11-18H10.1, Biolegend) minden második napon, az élet 5 napjától kezdve. Az egereket ezután a bélkárosodás LPS/PAF modelljének tették ki 2 hét múlva, és a fentiek szerint vizsgálták. Két kísérletet végeztek mindegyik csoportban 4–6 egérrel.
Statisztika
Az adatokat 1-utas ANOVA-val elemeztük Tukey post hoc tesztjével, 2-utas ANOVA-val vagy párosítatlan 2-tailed Student-féle teszttel, a GraphPad Prism 6 alkalmazásával. Az adatokat átlag ± SEM-ként fejezzük ki, a szignifikanciát pedig P )
Köszönetnyilvánítás
Ezt a kutatást az NIH K08 (> DK100545), a probiotikus kutatásokért felelős fiatal kutatói támogatás és a Gyermekorvosi Központ Alapítvány támogatása támogatta a JM számára.
Verzióváltozások
1. verzió 2018.10.04
Lábjegyzetek
Összeférhetetlenség: A szerzők kijelentették, hogy nincs összeférhetetlenség.
- Az anyai zsírtartalmú étrend intraovarián keresztül rontja az utódok follikuláris fejlődését
- Anyai étrend terhesség és utódok magassága, ülési magassága és lábhossza Journal of
- Az új gyógyszer megakadályozza a májkárosodást, az elhízást és a glükóz intoleranciát a magas zsírtartalmú étrendben
- Az új gyógyszer megakadályozza a májkárosodást, az elhízást és a glükóz intoleranciát a magas zsírtartalmú étrendben
- PLOS genetika A magas zsírtartalmú étrend az őssejtaktivitás mikrobiotától függő növekedését indukálja a