Az anyai zsírtartalmú étrend az intraovarianis kisspeptin/GPR54 rendszeren keresztül rontja az utódok follikuláris fejlődését
Absztrakt
Háttér
A túlzott terhességi súlygyarapodás (GWG), amely az utódok egészségére gyakorolt kedvezőtlen hosszú távú hatásokkal társul, jelentős klinikai problémává vált. A felhalmozódó bizonyítékok azt mutatják, hogy a petefészek kisspeptin/GPR54 rendszer közvetlenül részt vesz egy sor fiziológiai tevékenységben. A magas zsírtartalmú étrend (HFD) modelljét a terhesség alatt alkalmaztuk az utódok petefészkének működésének és a kisspeptin/GPR54 rendszer vizsgálatának vizsgálatára.
Mód
A hím bevezetése és a párosítás megerősítése a hüvelyi spermium dugójának ellenőrzésével a nőstény patkányokat két csoportba soroltuk: kontroll étrend NCD csoport és magas zsírtartalmú étrend HFD csoport. Születés után az összes patkányt kontroll étrendre változtattuk, és az alom méretét alomenként 12 kölyökre állítottuk be. A petefészkeket a posztnatális napon (PND) 4 és a PND 30-on történő értékelés céljából összegyűjtöttük. A hüvelynyílás időzítését feljegyeztük, és az ösztrikus ciklikusságot nyomon követtük 2 egymást követő héten keresztül. A PNP 4-ből vett primer granulosa sejteket és petefészkeket gyűjtöttük a kisspeptin-10 (kp-10) közvetlen hatásának meghatározása céljából in vitro.
Eredmények
A terhesség alatt HFD-nek kitett újszülött patkányoknál kevesebb volt a szekunder tüsző a petefészekben. A follikulus-stimuláló hormon receptor (FSHR) és a kisspeptin expressziója nem változott. A pubertáskorban az antrális tüszők és a preovulációs tüszők száma megnövekedett, a HFD csoportban csökkent a III. Típusú tüszők száma. Míg az ovulációval kapcsolatos gének expressziója csökkent, a follikuláris növekedéssel kapcsolatos gének és a szteroidogenezis szintézissel kapcsolatos gének expressziós szintje megemelkedett. Jelentős növekedés a csók1 Az mRNS-t és a kisspeptin-fehérjét az in vitro változásai nélkül detektáltuk kiss1r mRNS és GPR54. Az anya magas zsírtartalmú étrendje a vemhesség alatt jelentős előrehaladott pubertást és szabálytalan ösztrikus ciklust eredményezett utód patkányokban. Ezenkívül a kp-10 beadása növelte az elsődleges granulosa sejtek életképességét és megnövelte a petesejtek méretét.
Következtetések
Az anyai terhesség alatti HFD-expozíció hosszú távon befolyásolta az utódok reproduktív funkcióját, és a megnövekedett petefészek-kisspeptin/GPR54 rendszer érintett lehet.
Bevezetés
A korai életkörülmények, beleértve a táplálkozási állapotot is, fontos szerepet játszanak a fiziológia és a patológia számos aspektusának kialakításában a szervezet fejlődésében, és ezek a változások egész életen át fennmaradnak [1]. Az anyai elhízástól (terhesség előtti elhízás) eltérő GWG klinikai problémává vált, mivel sok terhes nő azon a véleményen van, hogy a magzatnak több táplálékra van szüksége, és nagy mennyiségű magas zsírtartalmú ételt fogyaszt. Nyilvánvaló, hogy a GWG a terhesség alatt méhen belüli „obezogén” környezetet okoz, és az utódok egészségére gyakorolt káros, hosszú távú hatásokkal jár együtt egy fejlesztési programozás néven ismert folyamat révén [2]. Ezenkívül korábbi tanulmányok kimutatták, hogy az étrend okozta anyai elhízás vagy az elválasztás utáni HFD a pubertás korai megjelenését és az ösztrikus ciklus rendellenességeit okozhatja a női utódokban [3,4,5]. Korlátozott tanulmányok állnak rendelkezésre azonban az utódok HFD-expozíciójának programozásáról csak az anyai terhesség alatt, különösen a petefészek működéséről és a kapcsolódó mechanizmusokról.
Az elmúlt néhány évtizedben a feltörekvő tanulmányok kisspeptint (csók1) anteroventralis periventricularis magban és az arcuate nucleus neuronokban kifejezve a rágcsálókban és az emberekben a hipotalamusz-hipofízis-petefészek tengely kulcsirányú szabályozójaként működik. A kisspeptin nélkülözhetetlen szerepet játszik a szaporodásban, ideértve az agy nemi differenciálódását, a pubertás kezdetét, a gonadotropin szekrécióját, az ovulációt és a termékenység metabolikus szabályozását [6,7,8,9]. Számos tanulmány kimutatta azonban, hogy a kisspeptin és feltételezett G-fehérjéhez kapcsolt GPR54-receptoruk (kiss1r) különböző típusú szövetekben fejeződnek ki, beleértve a reprodukciós rendszert is, amelyek közvetlen vagy közvetett módon gyakorolják tevékenységüket [9]. A petefészek tekintetében a kisspeptin/GPR54 közvetlenül részt vesz egy sor fiziológiai tevékenységben (follikuláris fejlődés, petesejtek érése, ovuláció és szteroidogenezis) és kóros állapotban (korai petefészek-elégtelenség, policisztás petefészek-szindróma és endometriózis) [10, 11].
A rágcsálóknál a PND 4-nél a petesejteket teljesen körülveszi egyetlen lapított granulosa sejtréteg, amely őshagymákat képez. Az eredetileg létrejött őshagymák számát tüszőkészletnek hívják, jelezve az emlősök reproduktív potenciálját. A PND30 egy másik kritikus időpont patkányokban a petefészek kialakulásakor. Ebben az időszakban a hüvely még nem nyílt ki, és a tüszők ovuláció nélkül nőnek [12, 13].
Meg kell vizsgálni a HFD terhesség alatti következményeit az utódok petefészkének programozásában és azt, hogy a kisspeptin/GPR54 rendszer érintett-e. Az intrauterin fejlődés krónikus túlzott táplálkozásának kockázatának megértése érdekében az újszülöttkori és a prepubertális időszak két fontos időpontját választottuk annak megvizsgálására, hogy az anya HFD-je a patkányokon a teljes terhességi időszak alatt megváltoztathatja-e az utódok petefészkének működését.
Anyagok és metódusok
Állatok és kísérleti tervezés
Morfometria
Immunhisztokémiai elemzés
Valós idejű kvantitatív PCR
A pubertás kezdetének és az ösztrikus ciklikusság értékelése
A PND30-tól kezdve az utódokat naponta ellenőrizték a hüvelynyílás (a reproduktív érettség jele) szempontjából, és hüvelyi keneteket hajtottak végre naponta 08: 00-kor, miután a hüvelynyílás 14 egymást követő napon át történt, az ösztrikus ciklikusság meghatározása céljából. A rendszeres észter-ciklus színvonala megegyezett az előző tanulmányéval [17]. Röviden, a rendszeres ösztrikus ciklus legalább két egymást követő rendszeres észter-ciklusból áll, és az ösztrikus stádiumot fénymikroszkóp alatt a hüvelyi kenetekben a magozott hüvelyi hámsejtek, a megkornifikált hámsejtek és a leukociták relatív mennyisége alapján határoztuk meg.
A petefészek granulosa sejtjeinek elsődleges tenyészete
Az éretlen (21-25 napos) nőstény Sprague-Dawley patkányokat 40 NE Serum Gonadotrophinum Pro Injectione (PMSG) (solarbio, p9970) injekcióval injektáltuk az izmokba. 48 óra elteltével a patkányokat altattuk, a petefészkeket azonnal eltávolítottuk és steril kalcium- és magnéziummentes PBS-be helyeztük. PBS-sel végzett mosás után a petefészkeket apró darabokra vágtuk, majd 5 percig 37 ° C-on 0,1% -os kollagenázzal emésztettük. A tüszőkben lévő granulosa sejteket izoláltuk, és DMEM/F12-ben (Gibco) tartottuk antibiotikumokat és 10% szarvasmarha-magzati szérumot (FBS) 37 ° C-on és 5% CO2-tartalommal.
Immunfluoreszcencia elemzés
Amikor a sejttenyészet 90–95% -os összefolyásra nőtt, a 6 lyukú lemezeken lévő tárgylemezeket PBS-sel mostuk. 4% paraformaldehidet használva a sejtek rögzítésére és 0,5% Triton X-100 sejt permeabilizációként, a tárgylemezeket 5% BSA-val 30 percig 37 ° C-on blokkoltuk. Miután primer antitesttel egy éjszakán át 4 ° C-on inkubáltuk, a metszeteket specifikus fluoreszcens szekunder antitesttel kombináltuk 30 percig 37 ° C-on. Végül a sejtmagokat DIPA-val festettük és fluoreszcens mikroszkóppal tettük láthatóvá.
A sejtproliferáció értékelése sejtszámláló kit-8 (CCK-8) esszével
Az elsődleges granulosa sejteket (10 4 sejt/lyuk) beoltottuk 96 lyukú lemezekre 24 órán át, és különböző dózisú kisspeptin-10-vel kezeltük (kp-10, Phoenix Pharmaceuticals, Inc., Belmont, CA, USA). 24 órás inkubálás után kicseréltük a táptalajt, és hozzáadtunk 100 μL FBS-mentes táptalajt további 10 μl CCK-8-mal. Négy órával később a 450 nm-es abszorpciót egy mikrotányér-leolvasó figyelte meg.
Petefészek inkubációs vizsgálat
A petefészkeket a patkányoktól PND4-en vettük, és 4 napig kezeltük kp-10-gyel (100 nM) vagy in vitro inkubációs közeggel. Az összes petefészket 24 órán át 37 ° C-on inkubáltuk 95% oxigénnel és 5% CO2-val, amint azt korábban leírtuk [18, 19]. Az alkalmazott inkubációs táptalaj DMEM/F12, 0,1% albumax (Gibco), 0,1% BSA, 0,05 mg/ml L-aszkorbinsav (sigma), 1% inzulin-transzferrin-szelén (sigma) volt, kiegészítve 250 U/ml penicillin-sztreptomicin. 4 napos inkubálás után a petefészkeket 4% paraformaldehidben rögzítettük a tüszők morfometriai elemzéséhez.
Statisztika
Az eredményeket átlag ± SEM-ként fejeztük ki, és az elemzéseket a PRISM szoftver 7.00 verziójával (GraphPad) hajtottuk végre. A két csoport összehasonlítása kétmintás t-tesztet vagy nem parametrikus tesztet használt. A HFD hatását az észt ciklus szabályosságára Chi-négyzet teszt alkalmazásával teszteltük. P értékek
Eredmény
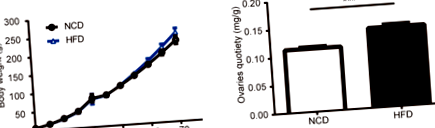
A HFD terhesség alatti hatása a testtömegre és a petefészek súlyára
Az 1a. Ábra a HFD-csoport és az NCD-csoport súlyát mutatja. A szülés után az alom méretét nem befolyásolta jelentősen az anyai étrend expozíciója. Amikor a patkányok PND70-re nőttek, a testtömeg még mindig nem érte el a statisztikai szignifikanciát a HFD patkányok és a kontroll patkányok között. Az 56 napos kortól kezdve a HFD csoportba tartozó patkányok nagyobb testtömeg-tendenciát mutattak, bár a két csoport között nem volt szignifikáns különbség (0,05 1. ábra
A HFD terhesség alatti hatása a korai follikuláris fejlődésben
A korai follikuláris fejlődést az újszülött petefészkek morfometrikus elemzésével értékeltük PND4-nél. A 2. ábra az NCD (A) és a HFD (B) petefészkeinek reprezentatív mikroszkópos felvételeit mutatja. Mindenféle tüsző megszámlálása után (2. ábra g) azt találtuk, hogy a kontrollcsoport petefészkeiben nagyobb volt a másodlagos tüszők aránya, mint a HFD patkányok petefészkeiben. És a HFD csoportban magasabb volt az őshagymák aránya, bár ez nem érte el a statisztikai szignifikanciát (o = 0,1431). Az elsődleges tüsző és az atrétikus tüsző azonban nem mutatott diverzifikációt a két csoport között. Feltételeztük, hogy az őstüszők és a másodlagos tüszők arányának változása a kisspeptin és az FSHR változásainak volt köszönhető. A kisspeptin főleg a petesejtekben expresszálódott (2. ábra c-d), az FSHR pedig a granulosa sejtekben található (2. ábra e-f). A bemutatott félkvantitatív statisztikák azonban nem mutattak szignifikáns különbséget a kisspeptin és az FSHR festési intenzitásában a HFD és az NCD csoport között (2. ábra h).
A HFD terhesség alatti hatásai a follikuláris fejlődésben a pubertáskorban a női utódokban
A follikuláris fejlődés elemzéséhez a prepubertális szakaszban a kontroll és a HFD patkányok petefészkeit vizsgáltuk a PND30-on morfometriával, és összefüggésbe hoztuk néhány mRNS expressziós szinttel. Nem számoltuk az őstüszők és az elsődleges tüszők számát, mivel ezeket a tüszőket nehéz volt kimutatni, és nem a petefészek fő része.
A 3. a-b. Ábrán a petefészkek (40X) általános képei láthatók, a 3. c-d. Ábra (100X) pedig a 3.a-b. Ábra nagyításának felel meg. Mindenféle tüsző megszámlálása után (3. ábra i) azt találtuk, hogy az atresia tüszők száma növekszik a HFD patkányokban (o = 0,0982), míg a másodlagos tüszők száma csökkent (o = 0,1252). Ezenkívül a HFD csoportban növekedett a preovulációs tüszők és az antrális tüszők száma 30 napos korban. A HFD csoportban azonban csökkentek a III-as típusú tüszők.
Számos különbség volt az NCD és a HFD csoportok között a petefészkek mRNS expressziójában. Először is, a kontroll patkányok petefészkében magasabb volt az ovulációval kapcsolatos gének mRNS expressziójának szintje, mint a HFD patkányok petefészkében (3. l ábra). Másodszor, a HFD patkányokban megnőtt a follikuláris növekedéssel kapcsolatos gének GDF9, AMH és BMP15, mivel a FSHR nem érintett (3. ábra k). Az anyai HFD diéta volt a fő oka a szteroidogenezis szintézissel kapcsolatos gének génexpressziójának növekedésének az utód petefészkeiben (3. ábra m).
A HFD terhesség alatti hatása a petefészek kisspeptin/GPR54 rendszerre a pubertáskorban a női utódokban
A petefészek génexpressziója csók1 és kiss1r a pubertáskorban elemeztük. Az eredmények egyértelműen megnövekedett expressziót mutattak csók1 Az mRNS a HFD patkányok petefészkeiben az NCD patkányokkal összehasonlítva, míg a kiss1r mRNS expresszió két csoport között (3. ábra n). A kisspeptin és a GPR54 immunhisztokémiai festését operáltuk a fehérje expressziójának és eloszlásának kimutatására a petefészekben. Megállapítottuk, hogy a kisspeptin erőteljesen expresszálódott petesejtekben és granulosa sejtekben, kevésbé festődött a theca sejtekben (3. ábra e-f). Az átlagos optikai sűrűség-elemzés azt mutatta, hogy a kisspeptin szintje a HFD-csoportban felfelé volt szabályozva a kontroll csoporthoz képest (3. j ábra). Ezenkívül a GPR54 eloszlás (3. ábra g-h) hasonló volt a kisspeptinhez, míg két csoport között nem volt szignifikáns különbség a festés intenzitásában (3. ábra j).
A HFD terhesség alatti hatása a hüvelyi nyitás életkorára és az ösztrikus ciklikusságra a női utódokban
A hüvelynyílás a pubertás kezdetének markere. A vemhesség alatt HFD-nek kitett patkányok előrehaladott pubertással rendelkeztek (4. ábra d). Véletlenül a HFD negatív hatással volt az ösztrikus ciklikusságra. A 4a-b. Ábra az egyes csoportok reprezentatív észter ciklusát mutatja. Körülbelül a kontroll patkányok 83,3% -a érte el a hüvelyi nyitás után 4-5 napig tartó normális kerékpáros aktivitást, szemben a terhesség alatt HFD-nek kitett anyák utódainak kevesebb mint 20% -ával (4. c ábra).
A kp-10 közvetlen hatása az elsődleges granulosa sejtekre és az újszülött petefészkére
Amint az 5. ábrán látható, az éretlen nőstény SD patkányokból izolált primer granulosa sejteket FSHR-rel immunfestékkel láttuk el, a gyártó csak granulosa sejtekben expresszálódott. Az 5. ábra azt is megmutatta, hogy az elsődleges tenyésztett sejtekben fluoreszcens festés figyelhető meg a kisspeptinnel, ami arra utal, hogy a kisspeptin expressziója patkány granulosa sejtekben történik. A kontroll csoporthoz képest 100 nM és 1000 nM kp-10 hasonló hatású volt, és mindkettő szignifikánsan növelte a granulosa sejtek életképességét 24 órás kezelés után, míg a 10 nM kp-10 hatástalan volt (6. ábra e).
Immunfluoreszcencia elemzés petefészek granulosa sejtekben. Az FSHR és a kisspeptin immunhisztokémiai festése patkányok tenyésztett petefészek granulosa sejtjeiben (50x). Pozitív festési jelek az FSHR és a kisspeptin specifikus ellenanyagával. A negatív kontrollt PBS-sel inkubáltuk. (n = 3)
A petefészkeket a patkányoktól PND4-en vettük, és 4 napig kezeltük kp-10-gyel (100 nM) vagy in vitro inkubációs közeggel. Mind a kontrollcsoport, mind a kp-10 kezelt csoport petefészkei nagyszámú primordialis tüszőt mutattak, és tartalmaztak néhány primer follikulust és antrális follikulus nélküli másodlagos follikulust is. Az elsődleges és a másodlagos tüszők túlnyomó többsége a petefészek szövetének közepén helyezkedett el, míg az őshagymák elsősorban a petefészek szövetének perifériáján oszlanak el (6. ábra a-d). A petesejtek méretének mérése után a kp-10 kezelt csoport nagyobb átmérőt ért el a kontroll petefészkek petesejtjeihez képest (6. f ábra).
Vita
Különböző típusú anyai táplálkozási állapotokat azonosítottak a felnőttkori betegségek programozására [2]. És rengeteg bizonyíték bizonyította, hogy az anya HFD-nek való kitettsége terhesség és szoptatás alatt káros hatással van az utódokra [20, 21]. Jelen tanulmányban az anya HFD-nek való terhesség alatti expozíciójának hatására koncentráltunk, hogy csak utánozzuk a túlzott terhességi súlygyarapodást és a női utódok reprodukciós potenciálját a PND4 és PND30 esetében. Megállapítottuk, hogy az újszülötteknél a korai follikuláris fejlődést és az utódok előtti follikuláris fejlődést az anyai HFD károsította a terhesség alatt. A pontos mechanizmus továbbra sem tisztázott, azonban úgy tűnik, hogy a kisspeptin/GPR54 rendszer érintett lehet.
A terhesség alatti HFD hatása a testsúlyra
A perinatális környezet, beleértve a laktációt, szintén nagyon fontos programozási ablak, amely kritikus szerepet játszik az utódok fejlődésében [1]. Noha az anyatejet főként a laktációs étrend befolyásolja, elkerülhetetlen, hogy a terhességi étrend is bizonyos hatással legyen az összetételre [40]. Ezért fontos megvizsgálni az anyatejben lévő tápanyagok és hormonok összetételét, amit a kísérlet megtervezésekor elhanyagoltunk. Bár a jelen tanulmányban vannak bizonyos korlátozások, úgy gondoljuk, hogy ezek nem változtatják meg főbb eredményeinket és spekulációinkat.
Következtetés
Összefoglalva, a jelen tanulmány kimutatta, hogy a terhesség alatt a HFD az újszülöttkori follikuláris fejlődéshez és a női utódok prepubertájához vezetett. Kimutattuk azt is, hogy a HFD csoportban a pubertás előrehaladott kezdete és az ösztrikus ciklus megszakadt. Az anya HFD-jének hosszú távú hatása az utódok petefészkének működésében, például a felnőtt és az öregedési periódusban, tovább kell derülnie. Bár feltételezzük, hogy a helyi petefészek kisspeptin részben megmagyarázhatja a fiziológiás folyamatok változását a petefészekben és kimutathatja a kp-10 közvetlen szerepét a follikuláris fejlődésben, a mechanizmust még nem sikerült megállapítani.
- Az anyai zsírtartalmú étrend az ILC3-ok mikrobiotától függő terjeszkedését eredményezi az egerek utódainál
- Anyai étrend terhesség és utódok magassága, ülési magassága és lábhossza Journal of
- Az anyai táplálkozás és utódok stresszoldása - következményei a
- Anyai étrend terhesség alatt az ekcéma és az utódok allergiás szenzibilizációja kapcsán
- Anyai étrend és a gyermekkori akut limfoblasztos leukémia kockázata