A makrofág által közvetített veleszületett/gyulladásos válaszok adrenerg szabályozása az elhízásban és a testmozgásban ebben a feltételben: A β2 adrenerg receptorok szerepe
Eduardo Ortega
1 élettani tanszék (immunfiziológiai kutatócsoport), Természettudományi Kar, Extremadurai Egyetem, Badajoz, Spanyolország;
Isabel Gálvez
1 élettani tanszék (immunfiziológiai kutatócsoport), Természettudományi Kar, Extremadurai Egyetem, Badajoz, Spanyolország;
Leticia Martín-Cordero
2 Ápolási Tanszék (immunfiziológiai kutatócsoport), Plasenci Egyetemi Központ, Extremadurai Egyetem, Plasencia, Spanyolország.
Absztrakt
Háttér:
A testmozgásnak a veleszületett/gyulladásos immunválaszokra gyakorolt hatását döntően a katekolaminok és az adrenoreceptorok közvetítik; és mind a stimulációs, mind a gyulladáscsökkentő válaszokban közvetítést tulajdonítottak nekik. Az elhízás és a metabolikus szindróma az alacsony fokú krónikus gyulladásos patológiák közé tartozik; különösen azért, mert a betegeknél a gyulladásos és a stresszválaszok diszregulációja van, ami magas szintű gyulladásos citokinekhez vezethet, amelyek inzulinrezisztenciát váltanak ki, hozzájárulva a 2-es típusú cukorbetegség kialakulásához vagy súlyosbodásához. A makrofágok döntő szerepet játszanak ebben az elhízás okozta gyulladásban. Bár a katekolaminok legtöbb gyulladáscsökkentő hatását a β adrenerg receptorok (különösen a β2) közvetítik, nem ismert, hogy megváltozott homeosztatikus állapotokban, például elhízásban és testgyakorlás során a makrofágok veleszületett/gyulladásos válaszai a β2 adrenerg stimulációra hasonlóak-e az egészséges organizmusok sejtjeiben lévő betegeknél.
Célkitűzés:
Jelen áttekintés célja annak hangsúlyozása, hogy az elhízás esetén a β2 adrenerg stimulációra különféle válaszok adódhatnak, és ebben az állapotban gyakorolhat.
Mód:
A szakirodalom átdolgozása azon hipotézis alapján, miszerint az elhízás befolyásolja a makrofág által közvetített veleszületett/gyulladásos válaszok β2 adrenerg szabályozását, valamint a testmozgás hatását ebben az összefüggésben.
Következtetés:
A β2 adrenoreceptorok által közvetített gyulladásos válaszok eltérnek az elhízott, megváltozott gyulladásos állapotú egyéneknél az alapállapotban az egészséges egyénekhez képest, és a testmozgás is megzavarhatja ezeket a válaszokat. Mindazonáltal egyértelműen több olyan tanulmány kidolgozása szükséges, amelyek hozzájárulnak az elhízás neuroimmun szabályozási folyamatának ismeretének bővítéséhez, különösen ebben az összefüggésben.
1. BEMUTATKOZÁS
1.1. A noradrenalin hatása a makrofág funkcióra, valamint az Α és Β adrenerg receptorok szerepe
Noha a katekolamin minden típusa eltérő módon befolyásolhatja az immunsejtek mindegyik típusát, úgy tűnik, hogy a noradrenalin (NA) képes a legnagyobb mértékben az immunrendszert modulálni [6, 7]. Besedovsky és Del Rey [4] azt sugallták, hogy az érintett sejtek szubpopulációja mellett az NA hatása függ az immunválaszt kiváltó ingertől és mindenekelőtt attól az aktivációs stádiumtól, amelyen a makrofágok és a limfociták ki vannak téve. neurotranszmitterek [5]. A szimpatikus neurotranszmitterek által közvetlenül vagy közvetve befolyásolt folyamatok főleg a fagocita folyamat és az antigén megjelenés, az adhéziós molekulák expressziója, a limfoid sejtek aktiválása, a citokinek és kemokinek termelődése, a Th1/Th2 egyensúly és a citotoxikus sejtek generálása [ 4, 6, 8-11]. Az NA szintén nagyon fontos szerepet játszhat a limfoid szervek és a vér közötti recirkulációban és leukocita-kereskedelemben [1, 4, 9, 11], a kemotaktikus kapacitás modulálásában és a fagociták felhalmozódásában a gyulladás helyén is [8, 12, 13].
Ezután arra lehetne következtetni, hogy nem érvényes az az elképzelés, hogy a katekolaminok mindig immunszuppresszívak. Ehelyett immunmodulátoroknak kell tekinteni őket, mivel stresszhelyzetekben nagyobb mértékű veleszületett immunválaszt tudnak támogatni azzal, hogy jeleket küldenek a fagocita sejtekbe annak érdekében, hogy megakadályozzák az esetleges fertőzéseket olyan esetekben, amikor a limfocita által közvetített adaptív válasz gyengülhet [5, 13, 22]. Mindenesetre a gátolt immunválaszok általában a β adrenoreceptorokkal, különösen a β2 receptorokkal társulnak, és alapvetően a gyulladásos aktivitással kapcsolatban, amint azt az alábbiakban tárgyaljuk.
1.2. Az α és β adrenerg receptorok szerepe a makrofág stimulációban: β2 receptorok
2. ELHÍZÁS, IMMUN RENDSZER ÉS GYÚJTÓ VÁLASZ
Az Egészségügyi Világszervezet legfrissebb becslései szerint az elhízásban szenvedők száma nagy ütemben növekszik: a 18 éves vagy annál idősebb felnőttek 39% -a volt túlsúlyos (1900 millió felnőtt), és a világ felnőtt lakosságának körülbelül 13% -a volt elhízott (650 millió) 2016-ban [46]. Ezért egyértelmű, hogy az elhízás világméretű járvány jár együtt járó betegségekkel és anyagcserezavarokkal, amelyek növelik az olyan patológiák előfordulását, mint az érelmeszesedés, a 2-es típusú diabetes mellitus (DM2) és a szív- és érrendszeri betegségek; de fertőző, gyulladásos, allergiás és autoimmun betegségekkel is társul. Számos klinikai és kísérleti bizonyíték azt jelzi, hogy az elhízás az immunrendszer megváltozásával és a gyulladásos reakcióval jár együtt [47-50]. Az elhízott egyének és a kísérleti elhízási modellek nagyobb érzékenységet mutatnak a fertőzésekre, megváltoztatják a lipopoliszacharid (LPS) válaszprofilját [51-54], valamint fenotípusos és leukocita aktivitási változások: változások a Toll-szerű receptorok (TLR) expressziójában, a pro- és gyulladáscsökkentő mediátorok termelésének intenzitásában, mikrobicid kapacitásában és e sejtek citotoxikus képességében [52, 55-59].
Az egyéb tényezőkkel (például genetikai és endokrin faktorokkal) összefüggő táplálékfelesleg és fizikai inaktivitás hiperpláziát és a zsírszövet hipertrófiáját indukálja. A hipertrófiás adipociták metabolikus stressznek vannak kitéve, ami sejtpusztulást, a zsírszövetben infiltrált leukociták aktiválódását és többnyire makrofágokat eredményezhet és gyulladást okozhat [60]. A gyulladt zsírszövet által felszabadított szabad zsírsavak (FFA), adipokinek (például leptin és rezisztin) és más gyulladásos mediátorok (például TNF-α, IL-6 és MCP-1) eljuthatnak a szisztémás keringésbe, a részvétel mellett a helyi gyulladásos válasz [47, 60, 61]. Így az FFA, a glükóz, az adipokinek, a citokinek, a kemokinek és más gyulladásos mediátorok keringő szintjeiben bekövetkező energia-egyensúlyhiány által kiváltott változások metabolikus diszfunkcióhoz vezetnek az adipocytákon kívül számos sejttípusban, például hepatocitákban, endotheliális sejtekben, leukocitákban és neuronokban [47, 61]. Összességében ezek a jelenségek hozzájárulnak az elhízással kapcsolatos alacsony fokú szisztémás gyulladás kialakulásához és a metabolikus szindróma progressziójához [47, 59, 61-63].
A monociták és a makrofágok szerepe az elhízásban kulcsfontosságú. Emberben a monociták különböző alcsoportokba sorolhatók a membrán glikoproteinek CD14 és CD16 expressziója szerint [64, 65]. A CD14 ++ A CD16– monociták klasszikus monociták, amelyek az egészséges egyének körében a legelterjedtebb keringő részhalmazok. A CD16 + monocita populációt CD14 ++ CD16 + köztes monocitákra és CD14 + CD16 ++ nem klasszikus monocitákra osztjuk [64, 65]. A CD16 + sejtek megnövekedett antigén prezentációs kapacitással, magas endothel affinitással és fokozott gyulladásgátló citokinek, például TNF-α termelésének képességével rendelkeznek a CD16– sejtekhez képest [66]. A CD16 + monocita populáció növekszik akut gyulladásos állapotokban, de krónikus gyulladásos állapotokban is, például elhízás esetén [67-69]. Egerekben a felületi markerek expressziója alapján a monocitákat két csoportra osztják: a gyulladásgátló profilt mutató Ly6C ++ CD43CCR2 + CD62L + CX3CR1low monocitákra, valamint a Ly6C-CD43 + CCR2-CD62L-CX3CR1hi monocitákra, amelyek egy gyulladáscsökkentő profil [70].
Néhány napos keringés után a monociták szövetekbe vándorolnak, ahol makrofágokká és dendritikus sejtekké differenciálódnak [71, 65]. Továbbá fertőzések és szövetkárosodás során ezek a sejtek gyulladásos gócokba kerülnek, amikor a rezidens makrofág populáció nem elegendő [65, 71]. Elhízás esetén az M1/gyulladáscsökkentő fenotípussal rendelkező makrofágok (CD11c és indukálható nitrogén-oxid-szintáz, iNOS expressziója) gyakoribbak, mint az M2/gyulladáscsökkentő fenotípusú makrofágok (CD206 és 1-es típusú argináz expressziója, ARG1) [60, 72, 73]. Az M1 makrofágok a magas mikrobicid aktivitással, a gyulladásgátló mediátorok termelésével és a sejtek immunitásával társulnak, míg az M2 makrofágok szöveti helyreállítással, átalakulási folyamatokkal és humorális immunitással társulnak [60, 72, 73]. Ezért, mivel a gyulladásgátló profilú monociták és makrofágok megnövekedett előfordulása összefügg többek között az inzulinrezisztencia, a DM2, valamint a vese- és szív- és érrendszeri betegségek kialakulásával; egyértelműnek tűnik, hogy a monociták és a makrofágok kulcsszerepet játszanak az elhízás és társbetegségei patofiziológiájában [47, 48].
3. ADRENERGIKAI RENDSZER ÉS BEMUTATHATÓ/GYÚJTÓ-MATORIUSSÁGI IMMUN VÁLASZOK AZ ELLENHANGZÁSBAN ÉS A FIZIKAI GYAKORLATBAN EZBEN AZ ÁLLAPOTBAN: A β2 ADRENERGIKAI VEVŐK SZEREPE
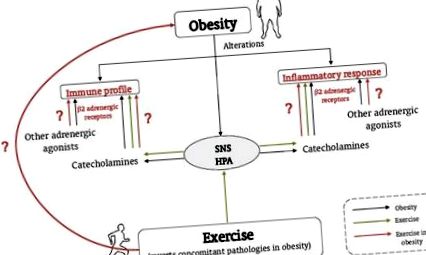
Az elhízás és a testmozgás szerepe ebben az állapotban, a katekolaminok és a β2 adrenerg receptorok veleszületett/gyulladásos válaszainak szabályozásában. Az elhízás a gyulladásos válasz, az immunprofil, az SNS és a HPA tengely változásával jár (fekete vonalak). A testmozgás helyreállítja az elhízás kísérő patológiáit, és aktiválja az SNS és a HPA tengelyt, ezáltal modulálva a gyulladásos választ és az immunprofilt az immunrendszer adrenerg szabályozásán keresztül (szaggatott vonalak). Tisztázni kell, hogyan szabályozzák a testmozgás immun/veleszületett válaszokra gyakorolt hatását a katekolaminok és a p2 adrenerg receptorok az elhízásban (szürke vonalak).
Következtetések és jövőbeli irányok
- Az elhízás és a testmozgás makrofág-közvetített veleszületett gyulladásos válaszainak adrenerg szabályozása
- 6 olyan testtípus, amely ellensúlyozza az elhízás kockázatát - DNS-tudomány
- A szívműködés az elhízott korú fiúknál végzett testmozgás során Az elhízás mértékének hatása - Schuster
- Az aerob testmozgás, nem pedig a diéta, javítja a diasztolés funkciót 2-es típusú cukorbetegség, elhízás esetén
- Kardiopulmonáris funkció és testmozgás kapacitása kóros elhízásban szenvedő betegeknél Revista Española de