Az elhízás okozta strukturális és neuronális plaszticitás a laterális orbitofrontális kéregben
Tárgyak
Absztrakt
Bevezetés
A világszerte elhízás az 1980-as évek óta megduplázódott (Finucane et al, 2011). Noha ennek számos oka van, az uralkodó hipotézis az, hogy az olcsó, könnyen hozzáférhető, nagyon ízletes ételek fokozottabb elérhetősége a túlevést okozza. A túlevés az elhízás legnagyobb meghatározója (Swinburn és mtsai, 2009), ugyanakkor nagyon keveset értünk azokból az idegi mechanizmusokból, amelyek mögött az egyének jóllakottságtól függetlenül továbbra is fogyasztanak ételt. Az éhezési állapottal rendelkező élelmiszerek motivációs értéke. Például az étel ösztönző értéke alacsonyabb a jóllakottság során, de fokozódik, ha éhes vagy különféle ízletes étkezési lehetőségeknek van kitéve (Berridge, 1991; Rolls et al, 1988; Stoeckel et al, 2007). Ezzel szemben az elhízott emberi alanyok nem érzékenyek az ételek motivációs értékének változásaira, és szokásszerűen étkeznek, még akkor is, ha az ételt jóllakottsággal értékelték le (Horstmann et al, 2015). Hasonlóképpen, a cafeteria-diétát folytató rágcsálók továbbra is fogyasztanak ételt, ha az ételek motivációs értékét a jóllakottság (Reichelt és mtsai, 2014) vagy az averzív jelek jelenléte leértékelte (Johnson és Kenny, 2010).
Az orbitofrontális kéreg (OFC) részt vesz a jutalom értékelésében és a döntéshozatalban. Az OFC idegsejtjei „online” értékalapú információkat tartanak a jövőbeni döntéshozatal irányításához, és így megbecsülik a konkrét eredmények valószínűségét a jövőbeli válaszok irányításához (Wilson et al, 2014). Tekintettel arra, hogy az OFC jelentős érzékszervi információkat kap, és tartalmaz olyan idegsejteket, amelyek reagálnak az ízre és a szaglásra (Rolls, 2012), az OFC valószínűleg integrálja az étel érzékszervi tulajdonságairól (íze, állaga, illata) szóló jeleket a várt eredményekkel. Az OFC elváltozások vagy inaktiválás károsodáshoz kapcsolódik akár a jóllakottság (Gremel és Costa, 2013; Rudebeck és mtsai, 2013), akár a LiCl (betegség) által kiváltott élelmiszer-leértékelés károsodásában (Schoenbaum és mtsai, 2003). Így az OFC regisztrálja az élelmiszerek aktuális értékét, és ezen információk alapján frissíti a műveleteket. Mivel az elhízott emberek és a cafeteria étrendet tápláló patkányok károsították az élelmiszer-jutalom leértékelését, az OFC diszfunkciója a túlevés lehetséges mozgatórugója lehet.
Az elhízás OFC működésére gyakorolt hatásainak vizsgálatához obesogén modellt használtunk, amelyet korábban (Johnson és Kenny, 2010) ismertettek. Három csoportnak differenciált hozzáférést (0, 1 vagy 24 óra) biztosítottak a „cafeteria stílusú” étrendhez, amely ízletes, energiasűrűségű ételeket tartalmaz, amelyek emberi fogyasztásra könnyen hozzáférhetőek, valamint az ad libitum hozzáférést a 40 napos chow-hoz. A korlátozott 1 órás hozzáférés fontos összehasonlítást nyújt, mivel el lehet különíteni az elhízás miatti hatásokat, mivel korábbi jelentések szerint a cafeteria diétához való korlátozott hozzáférés nem obesogén (Johnson és Kenny, 2010). Feltételeztük, hogy a diéta okozta elhízás a cafeteria étrendhez való hosszabb hozzáférés miatt megváltoztatja az OFC piramis idegsejtjeinek szerkezetét és működését.
Anyagok és metódusok
Tárgyak
Hím Long-Evans patkányokat (Charles River Laboratories, Quebec, Kanada) körülbelül a szülés utáni 60. napon kaptunk (285–325 g az összes kísérlet kezdetén). A patkányokat külön-külön, 12:12 fordított világos sötét ciklusban helyeztük el (a fény 8:00 órakor világított). Patkányokat engedélyeztek ad libitum hozzáférés standard chow-hoz (5P14 LabDiet, St Louis, MO) és vízhez a kísérlet ideje alatt. Valamennyi kísérleti eljárást a Calgary Egyetem Állatgondozási Bizottsága hagyta jóvá a Kanadai Állatgondozási Tanács iránymutatásai alapján.
Cafeteria Diet
Valamennyi patkányt külön-külön papírágyon (Alphapads, Lawrenceville, GA) helyeztük el, hogy megakadályozzuk az ételek laza ágyneművel való szennyeződését. A cafeteria diéta a Kirkland marhahús hotdogjaiból, a Froot Loopsból, a Timbit fánklyukakból, a Kraft mogyoróvajból és a Doritosból állt. Az etetés befejeztével az összes ételt lemértük, és a kiszáradáshoz igazítottuk. A különféle makrotápanyagok kalóriabevitelét a gyártó által megadott táplálkozási információk felhasználásával számoltuk ki (1. kiegészítő táblázat). A patkányokat napi 1 órán át (korlátozott hozzáférés), 23 órán át (kiterjesztett hozzáférés) vagy 0 órán át (csak chow) legalább 40 napig a cafeteria étrendnek tették ki. Az ételt naponta 2 órán át feltöltötték sötét ciklusukba. A korlátozott hozzáférésű patkányok 1 órás expozícióját sötét ciklusukban 2-3 óra között mutatták be. Mivel mindegyik ételtípusnak más volt a kalóriasűrűsége (1. kiegészítő táblázat), a teljes fogyasztást az összes ételtípus összesített kCal-ban mértük az összes elfogyasztott gramm helyett.
A táplálkozási magatartás cue által kiváltott elnyomása
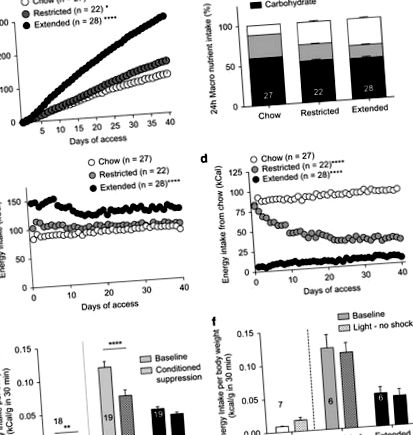
A takarmányozási eljárások zajcsökkentett operáns kamrákban zajlottak (Med Associates, Burlington, VT). Az ételeket kis fóliatartályokba helyezték. Minden ételt lemértek a takarmányozás előtt és után, amelyet a sötét ciklus alatt hajtottak végre. A patkányoknak napi 30 perc hozzáférést engedélyeztek a cafeteria étrendhez (vagy chow csak chow patkányokban) 5 napig, hogy stabil táplálékfelvételt érjenek el az alapszakaszban, majd visszatértek a házi ketrecekbe, amelyek csak chow-t tartalmaznak. A kiindulási értéket az utolsó 3 nap átlagolt kcal/munkamenetként rögzítettük. A patkányokat ezután egymást követő napokon négy kondicionáló kezelésnek vetették alá ugyanabban az operáns kamrában. A 30 perces kondicionáló munkamenetek alatt egy jelzőfény 10 percre aktiválódott, 10 percre kikapcsolt, majd 10 percre újra bekapcsol. A megbüntetett patkányok csak a jelzőfény bemutatása alatt kaptak lábsokkot (0,5 mA 1,0 másodpercig; 10 stimuláció
1 percenként). Ezekben az ülésekben nem volt étel a kamrákban. Az utolsó kondicionáló munkamenet másnapján a patkányokat kezdetben 5 percig fénypárral emlékeztető lábsokknak tették ki. A patkányokat eltávolítottuk a kamrából, majd visszahelyeztük, és lábütés nélkül 30 percen át kitettük a jelzőfénybe, miközben a fényt szakaszosan (10 percig, 10 percig, 10 percig) aktiváltuk a kávézó jelenlétében. diéta vagy chow csak a chow patkányoknak. Egy külön kísérletben a patkányokat azonos módon képezték ki, kivéve, hogy nem voltak kitéve lábütésnek. Chow csak az állatok kaptak chow-t a kiindulási és a tesztnapokon.
Szeletkészítés
A kondicionált szuppressziós tesztet követő napon a patkányokat izofluránnal lefejtettük, és az oldalsó OFC-t tartalmazó koronális metszeteket 300 μm-nél vágtuk egy vibratómán (Leica, Nussloch, Németország) oldatban (mM): 75 szacharóz, 87 NaCl 2,5 KCl, 1,25 NaH2PO4, 25 NaHC03, 7 MgCl2, 0,95 CaCl2 és 3 kinurénsav. A koronális metszeteket azonnal 250 ml aCSF-be helyeztük (mM-ben) 126 NaCl, 1,6 KCl, 1,1 NaH2PO4, 1,4 MgCl2, 26 NaHCO3, 11 glükóz, 2,4 CaCl2 tartalommal, és legalább 60 percig inkubáltuk 31,4-33 ° C-on. felvételhez. Valamennyi oldatot folyamatosan telítettük 95% O2/5% CO2-val.
Elektrofiziológia
Az AMPAR spontán EPSC-ket (sEPSC-ket) -70 mV nyomáson rögzített sejtekben rögzítettük pikrotoxinban (50 μM) és APV-ben (50 μM). A spontán IPSC-ket (sIPSC-ket) +10 mV feszültségen rögzített cellákban rögzítettük DNQX-ben (10 μM), Strychnine-ben (1 μM) és DPCPX-ben (1 μM), APV-ben (50 μM). A miniatűr EPSC-ket (mEPSC-ket) -70 mV-on rögzítettük, a miniatűr IPSC-ket (mIPSC-ket) +10 mV-on rögzítettük tetrodotoxin (500 nM) jelenlétében, hogy blokkolják az akciós potenciál által vezérelt spontán eseményeket. Az AMPAR mEPSC-ket amplitúdójuk (> 12 pA), bomlási idejük (12 pA), emelkedési idejük (TM kit (FD Neurotechnologies) alapján választottuk ki. Az impregnált blokkokat 200 μm-es soros koronális metszetekbe vágtuk vibratómával. A metszeteket kocsonyásított tárgylemezeket és a dendritek nyomon követésére és rekonstrukciójára alkalmas egységes irányban helyeztük el. A metszeteket levegőn szárítottuk (1 óra), a végső festőoldatban inkubáltuk, osztályozott alkoholokban dehidratáltuk és felhelyeztük. Golgi-impregnált idegsejtek, amelyeket egyenletesen impregnáltunk A szövettani feldolgozás által károsított mintákat alacsony teljesítmény mellett vettük mintából. A piramis idegsejteket egy piramisszerű szerű szóma és egyetlen kiemelkedő axon azonosította. Az idegsejteket egy Lucida kamerával követték nyomon 200X-os (21,17 μm/koncentrikus kör) elágazáshoz és 1000x-es (10 μM) = 1 cm) dendritikus tüskék esetén.
Sholl-analízist használtak a Golgi-val impregnált piramis idegsejtek morfológiájának jellemzésére. A bazilaris és az apikális dendritikus fák végpontjait azonosítottuk. A tüskéket az egymást követő 10 μm-es töredékek mentén szekunder dendriteken számoltuk meg, egy olyan in-field keret használatával, amely mindig 10 μm-rel kezdődött az elsődleges dendrit elágazása után. Az elemzés során csak a dendrit tengellyel folytonosságot mutató kiemelkedéseket vettük figyelembe. Az összes gerincsűrűség- és Sholl-elemzést elvakították az állatok kísérleti állapotától.
Statisztika
Az oszlopdiagramok az átlag ± s.p. Az N a patkányok számát vagy a neuronok/patkányok számát jelenti. A statisztikai szignifikanciát kétirányú ANOVA-val értékeltük Dunnett-féle többszörös összehasonlító teszttel, kontrollként chow-táplált patkányokkal, hacsak másképp nem jelezzük. A statisztikákat az ábrajegyzetek mutatják be.
Eredmények
A cafeteriai étrendnek való kitettség elhízást okozhat (Johnson és Kenny, 2010; Rolls et al, 1980). Ez valószínűleg annak köszönhető, hogy magas a zsírtartalma és a magas glikémiás terhelés párosul a hozzáférhető élelmiszerek sokféleségével (Rolls et al, 1983). Annak megerősítésére, hogy a cafeteria étrendhez való hozzáférés elhízást vált ki, napi 40 napos súlygyarapodást mértünk. A cafeteria étrendhez való kiterjedt hozzáféréssel rendelkező patkányok lényegesen nagyobb súlyt kaptak, mint azok a patkányok, akik korlátozottan vagy egyáltalán nem jutottak hozzá a cafeteria étrendhez (1a. Ábra). Az étrend expozíciójának végére a cafeteria étrendhez korlátozott vagy kiterjesztett hozzáféréssel rendelkező patkányok nem különböztek szignifikánsan zsír-, szénhidrát- vagy fehérjefogyasztásukat (1b. Ábra), ami arra utal, hogy a megfigyelt viselkedési vagy idegsejtbeli különbségek nem feltétlenül a változások következményei. tápanyagösszetételben.
Ezután megvizsgáltuk, hogy vannak-e elhízott patkányok csökkent baziláris gerinc morfológiájának és megnövekedett bazális komplexitásának laterális OFC piramis idegsejtjei. Annak megállapításához, hogy a piramidális idegsejtek gerjesztő bemenete megváltozik-e a cafeteria étrendhez való kiterjesztett hozzáférés révén, rögzítettünk sEPSC-ket (akciós potenciáltól függő és független) és mEPSC-ket (kvantális) az laterális OFC piramisos neuronokra. A cafeteria étrendhez való hozzáférés nem változtatta meg az sEPSC-k amplitúdóját vagy gyakoriságát, ami arra utal, hogy a glutamát felszabadulásában vagy annak posztszinaptikus hatásában nincs változás (kiegészítő 3A – C). Hasonlóképpen, a cafeteria étrendhez való hozzáférés nem változtatta meg a piramissejtek neuronjain az mEPSC-k amplitúdóját vagy gyakoriságát (Supplementary 3D – E). Annak értékelésére, hogy a glutamát felszabadulás valószínűségében változtak-e, a párosított pulzus arányt egy 50 ms-os inger intervallummal mértük, amely mérték megbízhatóan korrelál a felszabadulás valószínűségével (Thomson, 2000). Az étrendcsoportok között azonban nem volt szignifikáns különbség (kiegészítő 3F, G). Összességében sem a preszinaptikus glutamát felszabadulás, sem a piramisos idegsejteken lévő posztszinaptikus AMPAR-ok száma vagy funkciója nem változott azoknál a patkányoknál, akiknél hosszabb vagy korlátozott hozzáférés volt a cafeteria étrendhez, ami arra utal, hogy ezek a hatások nem a csökkent gerincsűrűség funkcionális következményei.
Ezután azt vizsgáltuk, hogy a II/III réteg laterális OFC piramis idegsejtjeinek belső tulajdonságai különböznek-e a cafeteria étrendhez korlátozott vagy kiterjesztett hozzáférésű patkányok és a chow-táplált patkányok között. Serkentő és gátló szinaptikus blokkolók jelenlétében nem voltak szignifikáns különbségek a jelenlegi lépésben kiváltott tüzelésben az etetőcsoportok között (4a. És b. Ábra). Továbbá, az OFC piramis idegsejtjeinek tüske-késleltetése a cafeteria étrendhez hosszabb hozzáféréssel (19 ± 2 ms) vagy korlátozott hozzáféréssel (19 ± 3 ms) rendelkező patkányoktól nem különbözött a chow-vel táplált patkányoktól (17 ± 3 ms; 4c. Ábra) . Ezek az adatok együttesen azt sugallják, hogy a cafeteria étrendhez való hozzáférés nem változtatja meg az OFC piramis idegsejtek belső ingerelhetőségét.
Ezután mértük a nyugalmi membránpotenciált szinaptikus blokkolók jelenlétében vagy hiányában. Szinaptikus blokkolók hiányában a nyugalmi membránpotenciál szignifikánsan jobban depolarizálódott azoknál a patkányok laterális OFC-neuronjainál, akiknek széles körű hozzáférése volt a cafeteria diétához, összehasonlítva a korlátozott hozzáférésű vagy a chow-táplált patkányokkal (4d. Ábra). Ez a hatás azonban hiányzott szinaptikus blokkolók jelenlétében (4e. Ábra). Összességében ezek az adatok azt sugallják, hogy a cafeteria étrendhez hosszabb hozzáféréssel rendelkező patkányok laterális OFC neuronjai depolarizáltabbak a szinaptikus bemenet megváltozása miatt, de nem a belső ingerlékenység megváltozása miatt.
A laterális OFC piramis idegsejtek csökkent gátló szinaptikus bemenetének alternatív mechanizmusa a GABAerg interneuronok csökkent expressziójának köszönhető. A parvalbumint (PV +) expresszáló kortikális gátló interneuronok olyan lokális hálózati tevékenységek szabályozói, hogy a PV + neuronok aktiválása szinkronizálhatja a piramis idegsejtek hálózatát gamma-rezgésekké (Buzsáki és Wang, 2012). A csökkent kortikális PV + interneuronok számos mentális betegségben érintettek, amelyek szabályozzák a prefrontális információ feldolgozását (Coyle, 2004; Del Pino és mtsai, 2013; Lewis és mtsai, 2012; Volman és mtsai, 2011). Ezért megvizsgáltuk, hogy a cafeteria étrendhez való hozzáférés megváltoztatta-e a PV + interneuronok számát az laterális OFC-ben. Azonban nem volt szignifikáns különbség a PV + idegsejtek számában az olyan patkányok laterális OFC-jében, akiknél a cafeteria étrend kiterjesztett, korlátozott vagy nem volt hozzáférhető (kiegészítő 4A, B). Összességében elmondható, hogy míg a cafeteria étrendhez való kiterjedt hozzáférés csökkentette a GABA felszabadulását a piramis idegsejteken, ez nem a PV + interneuronok számának változásának tudható be.
Vita
A magas zsírtartalmú és magas glikémiás terhelésű, ízletes ételek rendelkezésre állása által a hiperphágia az elhízás legnagyobb meghatározója (Gearhardt és mtsai, 2011; Kelly és mtsai, 2009; Popkin és Duffey, 2010). Az egyének gyakran túlznak az ismert averzív következményektől függetlenül. Az OFC diszfunkciója szerepet játszik a rosszul adaptív döntéshozatalban (Wilson és mtsai, 2014). Itt bemutatjuk, hogy az elhízott patkányok megváltoztatták a bazilaris gerinc sűrűségét és a dendrit elágazást, valamint csökkentették a GABA felszabadulásának valószínűségét a II/III réteg laterális OFC piramissejtjeire. Ezeknek az állatoknak a rugalmas viselkedése is károsodott, így nem gátolták az etetést averzív jelek jelenlétében. Ezek az eredmények a nem homeosztatikus táplálás mögött álló lehetséges mechanizmusra utalnak.
Az elhízott patkányok nem gátolják az élelmiszer-fogyasztást az elfordító jelek jelenlétében
A cafeteria étrendhez való kiterjesztett hozzáféréssel rendelkező patkányok csökkenték a GABA felszabadulásának valószínűségét a laterális OFC piramis alakú neuronjaira
A Cafeteria diétához való kiterjesztett hozzáféréssel rendelkező patkányok megváltoztatták a szerkezeti plaszticitást
Bár a korlátozott hozzáférésű patkányok nem mutattak változásokat az ingerlő vagy gátló szinaptikus transzmisszióban, a gerincsűrűség jelentősen megnőtt a ventralis OFC-ben. Úgy gondolják, hogy a ventrális OFC áthidalja a mediális és prefrontális kérgi hálózatokat (Price, 2007), elsődleges kéregen kívüli céljuk a dorsalis striatum (Hoover és Vertes, 2011). Míg a korlátozott hozzáférésű patkányok nem elhízott kontrollként szolgálnak az étrendnek való kitettséggel ezekben a vizsgálatokban, rendellenes táplálkozási viselkedést mutatnak, így napi energiaigényük nagy részét egy órán belül elfogyasztják. Így a jövőbeni vizsgálatok azt tesztelhetnék, hogy a ventrális OFC sztriatumra vetülése részt vesz-e a mértéktelen étkezéshez kapcsolódó szokásszerű válaszokban.
Összegzésként új hipotézist adunk arra vonatkozóan, hogy az elhízás hogyan befolyásolhatja a nem homeosztatikus étkezést. Kimutattuk, hogy az elhízott patkányoknak, amelyek nem gátolják az etetést averzív jelek jelenlétében, csökkent a GABA felszabadulásának valószínűsége az OFC piramis idegsejtjeire. Ez a hatás hozzájárulhat a laterális OFC neuronok fokozott ingerlékenységéhez a depolarizáltabb nyugalmi állapot miatt. Így az OFC II/III rétegének kimenetéből hiányozhat a megfelelő szinkronitás ahhoz, hogy információt továbbítson a célneuronjaikhoz. Mivel az OFC az érzékszervi információkat a jelenlegi jutalomértékkel integrálja a jövőbeli cselekvések irányításához, valószínű, hogy az OFC elhízás okozta diszfunkciója az egyéneket homeosztatikus igényektől függetlenül étkezésre késztetheti, hozzájárulva ezzel a túlevéshez.
FINANSZÍROZÁS ÉS KÖZZÉTÉTEL
Ezt a munkát a CIHR FDN: 148473, a Mind Columbia brit Columbia Fiatal Nyomozó Díja és az SLB Cumming School of Medicine Bridge alapja támogatta. A szerzők nem jelentenek összeférhetetlenséget.
- Az elhízás okozta gyulladás összefügg a szubcelluláris cinkkészletekben és a koraszülöttekben bekövetkezett változásokkal
- Az elhízás okozta lymphedema nem visszafordítható
- Metabolikus fiatalító program a Douglas Laboratories®-tól
- Professzionális zsírfúvó zsírmágnes vélemények a diétás tablettákról - HazMat Management
- Nem minden Varice Cirrhosis - AGA Perspectives