Az ellenállás során végzett feszültség alatt álló izomidő stimulálja a differenciális izomfehérje szubfrakcionális szintetikus reakciókat a férfiaknál
Nicholas A Burd
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Richard J Andrews
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Daniel WD West
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Jonathan P Little
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Andrew JR Cochran
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Amy J Hector
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Joshua GA Cashaback
2 Foglalkozási Biomechanikai Laboratórium, Kineziológiai Tanszék, Hamilton, Ontario, Kanada
Martin J Gibala
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
James R Potvin
2 Foglalkozási Biomechanikai Laboratórium, Kineziológiai Tanszék, Hamilton, Ontario, Kanada
Steven K Baker
3 Michael G. DeGroote Orvostudományi Kar, Neurológiai Tanszék, McMaster Egyetem, Hamilton, Ontario, Kanada
Stuart M Phillips
1 Testmozgás anyagcsere kutatócsoport, Hamilton, Ontario, Kanada
Társított adatok
Absztrakt
Nem technikai összefoglaló
Egyetlen ellenállási gyakorlat serkenti az új izomfehérjék szintézisét. Az ellenállási gyakorlat (vagyis a súlyzós edzés) krónikus teljesítménye az izmokat nagyobbá teszi; hipertrófia néven ismert folyamat. Nem ismert azonban, hogy az izomfeszültség alatt álló idő növelése az izomfehérje szintézisének nagyobb növekedéséhez vezet-e. Beszámoltunk arról, hogy a láb meghosszabbítása a legjobb erőfeszítés 30% -ánál (ami viszonylag könnyű terhelés), fáradtságig végrehajtott lassú emelési mozgással (6 s fel és 6 s lefelé) nagyobb mértékben növeli az izomfehérje szintézis sebességét mint ugyanaz a mozgás, amelyet gyorsan hajtottak végre (1 s felfelé és 1 s lefelé). Ezek az eredmények arra utalnak, hogy az izom testedzés közbeni feszültség alatt álló ideje fontos lehet az izomnövekedés optimalizálásában; ez a megértés lehetővé teszi számunkra, hogy jobban felírjuk a testmozgást azoknak, akik nagyobb izmokat akarnak felépíteni, és/vagy megakadályozzák az öregedéssel vagy betegséggel járó izomvesztést.
Absztrakt
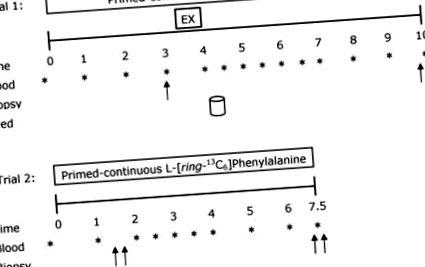
Kísérleti protokoll
A kettős nyilak azt jelzik, hogy kétoldalú biopsziákat kaptak a megfelelő időpontokban. Az alanyok az etetés időpontjában 20 g tejsavófehérje-izolátumot fogyasztottak.
A gyakorlat befejezése után a résztvevők visszatértek nyugalmi helyzetbe, vérmintát gyűjtöttek és jégre helyezték. Ezt követően a résztvevők 20 g tejsavófehérje-izolátumot tartalmazó italt fogyasztottak (Fonterra Alacen-895-I, Auckland, Új-Zéland). Ezt a fehérjemennyiséget úgy határozták meg, hogy maximálisan stimulálja az izomfehérje szintézis sebességét fiatal férfiaknál a rezisztencia gyakorlása után (Moore és mtsai. 2009a). Az izotóp egyensúly zavarainak minimalizálása érdekében az italokat 4% -ra dúsítottuk nyomjelzővel a tejsavófehérje 3,5% -os mért fenilalanin-tartalma szerint; ezt a megközelítést máshol részletesen elmagyarázzák (Burd et al. 2011b). Kétoldalú biopsziákat vettünk az egyoldalú ellenállási gyakorlat befejezése után 6 órával. Az 1. próba befejezése után a résztvevõk ételt kaptak a ~ 2500-3000 kJ értékû kávézóból, és utasítást kaptak egy további étkezés elfogyasztására, amely reprezentatív volt azoknak az étkezéseknek, amelyeket korábban a 3 napos étrendi naplóba vettek. Ezt az étkezést legkésőbb 22.00 óráig el kellett fogyasztani, hogy 10 órával gyorsabb legyen a testmozgást követő 24 órás fehérjeszintézis mérés megkezdése előtt (2. kísérlet). A résztvevőket arra utasították, hogy az estére tartózkodjanak a fizikai tevékenységektől.
Reggel a résztvevők visszatértek a laboratóriumba a 2. vizsgálatra, és átestek a korábban leírt infúziós vizsgálati eljárásokon. Az infúzió megkezdése után 1,5 órával kétoldalú biopsziát nyertünk, amelyet 20 g tejsavó-izolátumot tartalmazó nyomjelzővel dúsított fehérje ital fogyasztása követett. A 2. infúziós vizsgálatot kétoldalú biopsziák 6,5 órával befejezték. Az izombiopsziákat, külön-külön ~ 4 cm-es elválasztásokkal, Bergström tűvel végeztük, amelyet helyi érzéstelenítésben (2% xilokain) alkalmaztunk. Minden biopsziát a vastus lateralis-ból nyertünk. A biopsziás mintákat eltávolítottuk, és minden látható zsírtól és kötőszövettől megszabadítottuk, folyékony nitrogénben azonnal lefagyasztottuk, és további elemzésig -80 ° C-on tároltuk. Az 1. és 2. kísérlet során 0,5 vagy 1 óránként vett vérmintákat dolgoztunk fel, amelyeket a korábban leírtak szerint végeztünk (Moore és mtsai 2009a) (1. ábra).
Vérelemzések
A plazma [gyűrű-13C6] fenilalanin dúsításokat a korábban leírtak szerint határoztuk meg (Glover et al. 2008). A vér aminosav-koncentrációit HPLC-vel elemeztük a korábban leírtak szerint (Moore és mtsai 2005). A vércukor-koncentrációt vércukor-mérővel (OneTouch Ultra 2, Lifescan Inc., Milpitas, CA, USA) elemeztük a vérvétel után 2 percen belül. A plazma inzulint egy kereskedelemben kapható immunvizsgálati készlet alkalmazásával mértük (ALPCO Diagnostics, Salem, NH, USA).
Elektromiográfiai elemzések
A nyers elektromiografikus (EMG) jeleket 1024 Hz frekvencián vettük mintába, egyedi gyártású bioerősítő segítségével, és gyűjtő szoftverrel gyűjtöttük össze (LabVIEW v 8.2; National Instruments, Austin, TX, USA). Az összes nyers EMG jelet digitalizálták és külső merevlemezen tárolták, és elemezték a korábban leírtak szerint (Burd et al. 2010a).
Izomfehérje szintézis
A miofibrilláris, mitokondriális és szarkoplazmatikus dúsított frakciókból származó szabad aminosavakat kationcserélő kromatográfiával (Dowex 50WX8-200 gyanta; Sigma-Aldrich Ltd) tisztítottuk és átalakítottuk N-acetil-n-propil-észter-származékokká gázkromatográfiás égéses analízissel. izotóparányú tömegspektrometria (GC-C-IRMS: Hewlett Packard 6890; IRMS modell Delta Plus XP, Thermo Finnagan, Waltham, MA, USA). Az izom intracelluláris aminosavakat külön nedves izomrészből (~ 20 mg) extraháltuk jéghideg 0,6 m PCA-val. Az izmokat jégen, teflonnal bevont mozsárral homogenizáltuk, majd 12 000 g-vel 10 percig 4 ° C-on centrifugáltuk. Ezután a felülúszót összegyűjtöttük, és ezt az eljárást még kétszer megismételtük. Mindhárom felülúszót egyesítettük, intracelluláris aminosavként vettük fel, kationcserélő kromatográfiával tisztítottuk és heptafluor-butirát (HFB) származékokká alakítottuk át, mielőtt GC-MS-vel elemeztük volna (6890 GC és 5973 MS modellek; Hewlett-Packard, Palo Alto, CA, USA) a korábban leírtak szerint (Moore et al. 2009b).
Intramuszkuláris jelátvitel
Az Akt foszforilációjának mértékének meghatározására szolgáló módszerek Ser473-on, mTOR a Ser2448-on, p70S6K a Thr389-en, rps6 a Ser240/244-en, 4EBP1 a Thr37/46-on, eIF2Bɛ a Serr39-nél, p38 MAPK a Thr180/Try182-nél, Erk1/2 a Thr180-on/Try182, Erk1/2 a Thr180-on/Tyr204, p90RSK a Thr573-on, az rps6 a Ser235/236-on és az összes fehérje az előző munkánkban leírtak szerint történt (Burd et al. 2010a). Az összes adatot a foszforilezett és az összes fehérje közötti arányban fejezzük ki, és ennek megfelelően elemezzük.
Valós idejű kvantitatív polimeráz láncreakció
A teljes RNS-t nedves izom mintákból izoláltuk (~ 20 mg) az előző munkában leírtak szerint (Cochran et al. 2010). Az RNS-t átírtuk, és kvantitatív RT-PCR reakciókat hajtottunk végre a korábban leírtak szerint (Cochran és mtsai 2010). A PGC-1α expressziójának változását az ΔΔCt módszerrel számítottuk ki (Livak & Schmittgen, 2001), normalizálva a háztartási gén gliceraldehid-3-foszfát-dehidrogenázra (GAPDH), amely az idő során nem változott (P = 0,75). A GAPDH primerek a következők voltak: előre 5'-CCTCCTGCACCACCAACTGCTT-3 'és hátramenet 5'-GAGGGGCCATTCACAGTCTTCT-3'.
Számítások
Az izomfehérjék frakcionált szintetikus sebességét (FSR) a szokásos prekurzor – termék egyenlet segítségével számítottuk ki (Moore és mtsai 2009b; West és mtsai 2009; Burd és mtsai 2010a, b). A „nyomjelző-nem naiv” résztvevők felvétele lehetővé tette számunkra, hogy az infúzió előtti vérmintát, amelyet a dúsításban ekvivalensnek tekintettünk egy infúzió előtti biopsziával (publikálatlan), az infúzió előtti alapdúsításként (Ep1) használjuk. a nyugalmi izomfehérje szintézisének kiszámítása (Gyors). Ezt az egyetlen biopsziás megközelítést az izomfehérje FSR meghatározásához laboratóriumunkban validálták (Burd et al. 2011b). Ráadásul ezt a megközelítést mások is igazolták, de a dolgozók ehelyett alapszintű (azaz infúzió előtti és így nem dúsított) izombiopsziát alkalmaztak (Smith és mtsai 2010).
Statisztika
Asztal 1
A vér aminosavkoncentrációi, vércukorszintje és plazma inzulin koncentrációja éhomi állapotban és 20 g tejsavófehérje izolátum lenyelése után az 1. és 2. kísérlet során
Ital utánBöjtölve0 h0,5 h1,0 h1,5 h2,0 h3,0 óra| 1. próba: | |||||||
| Σ EAA (μmol l −1) | 554 ± 34 | 494 ± 44 | 1063 ± 66 * | 1071 ± 95 * | 689 ± 59 | 611 ± 42 | 503 ± 45 |
| Leucin (μmol l −1) | 89 ± 5 | 79 ± 7 | 233 ± 15 * | 249 ± 23 * | 145 ± 13 * | 119 ± 8 | 103 ± 10 |
| Inzulin (μU ml −1) | 4,4 ± 0,9 | 4,3 ± 0,7 | 18,9 ± 0,9 * | 20,9 ± 3,6 * | 6,6 ± 1,3 | 4,4 ± 1,3 | 4,03 ± 0,7 |
| Glükóz (mm) | 5,0 ± 0,2 | 5,4 ± 0,3 | 5,1 ± 0,1 | 5,3 ± 0,1 | 5,2 ± 0,3 | 5,4 ± 0,1 | 4,9 ± 0,2 |
| 2. próba: | |||||||
| Σ EAA (μmol l −1) | 608 ± 26 | 562 ± 45 | 870 ± 49 | 1197 ± 159 * | 970 ± 110 * | 821 ± 128 | 726 ± 199 |
| Leucin (μmol l −1) | 99 ± 4 | 90 ± 7 | 190 ± 11 * | 221 ± 24 * | 163 ± 16 * | 125 ± 19 | 102 ± 17 |
| Inzulin (μU ml −1) | 4,1 ± 0,6 | 4,2 ± 1,0 | 12,2 ± 2,2 * | 19,2 ± 1,3 * | 6,1 ± 0,6 | 3,4 ± 0,2 | 3,7 ± 0,5 |
| Glükóz (mm) | 5,3 ± 0,1 | - | 5,3 ± 0,2 | 5,1 ± 0,2 | 4,9 ± 0,2 | 4,9 ± 0,2 | 5,0 ± 0,2 |
Az értékek átlag ± S.E.M. (n = 8). 20 g tejsavófehérje-izolátumból álló ital. Az EAA az His, Ile, Leu, Lys, Met, Phe, Thr, Val összege (megjegyzés: sem Trp-t, sem Cys-t nem mértünk).
Az arányok pihent éhgyomorra és lassú (SLOW) vagy külső munka-mérkőzés kontroll (CTL) izomidővel járó ellenállás gyakorlása után vannak feszültség alatt. Az értékek átlag ± S.E.M. Az adatokat tetszőleges egységekben (AU) fejezzük ki. * Jelentősen különbözik a gyorsaktól, P 0,05) az Erk1/2, p38 MAPK, Akt, mTOR, rps6 foszforilációjában a Ser240/244 vagy 235/236, vagy az eIF2Bɛ (kiegészítő ábra).
PGC-1a mRNS
A PGC-1α mRNS-t a pihenés fölött ~ 3-szorosára növeltük a testgyakorlást követő 6 órában, a körülmények közötti különbség nélkül (az idő fő hatása, P = 0,001), és 24 órával visszatért a kiindulási értékre (5. ábra).
Annak ellenére, hogy a miofibrilláris fehérje szintézisének azonnali stimulációja a jelenlegi tanulmányban hiányzik, adataink alátámasztják, hogy az akut testmozgás egészen a kudarcig, valószínűleg a maximális rostaktiváció révén, késleltetett szenzibilizáló hatást eredményez a miofibrilláris fehérjeszintézis táplálkozása során a késői testmozgás során, és további betekintést nyújt a myofibrilláris fehérjeszintézis szabályozásába a testgyakorlás 24 órás helyreállítása alatt (Burd et al. 2011a). A fehérjetáplálkozás iránti megnövekedett érzékenység a testmozgás után 24 órával, amiről korábban beszámoltunk (Burd et al. 2011a) és a mostani tanulmány, talán nem túl meglepő. Mivel azonban, ha az izomfehérje-szintézis bazális böjtölési sebessége akár 48 órán át is megemelhető (Phillips és mtsai. 1997), akkor a miofibrilláris fehérjeszintézis táplálkozással indukált potenciatartalma meghaladja magát a táplált állapot válaszát (Moore és mtsai. 2009b) 24 óránál, és valószínűleg 48 óránál is nyilvánvalónak kell lennie. Hasonló eredményeket tapasztaltak olyan idős férfiaknál is, akik ugyan nem tudták a testmozgás nélkül a vegyes izomfehérje-szintézis táplálkozási állapotának jelentős növekedését elérni, de 40 perces séta után 18 órával szignifikáns stimulációt mutattak (Fujita és mtsai 2007b).
Kétségtelen, hogy az emberekben az izomfehérje-szintézis vizsgálatának módszerei csak az izomrostok kis populációjának mintavételét igénylik. Tehát feltételezzük, hogy ez a kis rostpopuláció az egész combizomra reprezentatív. Valójában az izomban lévő összes motoregység és a hozzájuk kapcsolódó I. vagy II. Típusú rostok nem egyszerre lőnek ki (Sale, 1987). Így szelektíven alkalmazzák a gyors és lassú rángatózó motoros egységeket ahhoz, hogy elegendő erőt hozzanak létre a terhelés leküzdéséhez. A jelenlegi tanulmányban egy olyan modellt alkalmaztunk, amely lehetővé tette számunkra, hogy teszteljük, hogyan befolyásolják a különböző toborzási szintek az izomban lévő specifikus fehérje készleteket. Feltételezzük, hogy a II. Típusú izomrostok végül aktiválódtak, amit az EMG eredmények is alátámasztanak, a SLOW állapotban, amely néhány kiváló válaszhoz vezetett (2–4. Ábra). Természetesen a válasz egyetlen szál szintjén történő tanulmányozása értékes betekintést engedne abba, hogy az alacsony intenzitású ellenállás során milyen hatással vannak az egyes rosttípusok. Ez a megközelítés azonban figyelembe veszi a szálak kis populációját is, és ennek a módszertannak a megvalósíthatóságát nehéz nagy léptékben alkalmazni (több időpont vizsgálata a gyakorlat után).
- A fehérje valóban teljes tanulmányi időt érez
- Néhány tinédzsernek, aki izomépítés céljából gyakorol, étkezési rendellenességei lehetnek Orvos; s Hetente
- Fehérje étrend a fogyáshoz izomtömeg csökkenése nélkül
- 40 év felett Több proteinre van szüksége az izomzat helyreállításához
- Új tanulmány - A tojássárgája olyan veszélyes, mint a dohányzás (testépítés, étkezés, fehérje) - testmozgás és