Az emberi zsírmáj betegség: régi kérdések és új felismerések
Jonathan C. Cohen
1 Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
Jay D. Horton
1 Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
2 Molekuláris genetikai tanszék, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
Helen H. Hobbs
1 Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
2 Molekuláris genetikai tanszék, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
3 Howard Hughes Orvosi Intézet, Texasi Egyetem Délnyugati Orvosi Központ, Dallas, TX 75390–9046, USA.
Absztrakt
A nem alkoholos zsírmájbetegség (NAFLD) egy növekvő egészségügyi probléma, amely a fejlett országokban a felnőttek egyharmadát és egyre több gyermeket érint. A betegség a triglicerid aberráns felhalmozódásával kezdődik a májban, amely egyes egyénekben gyulladásos választ vált ki, amely cirrhosissá és májrákká válhat. Noha a NAFLD szorosan összefügg az elhízással és az inzulinrezisztenciával, patogenezise továbbra is kevéssé ismert, és a terápiás lehetőségek korlátozottak. Itt a NAFLD legutóbbi mechanisztikus betekintését tárgyaljuk, elsősorban azokra összpontosítva, amelyek az emberi genetikai és anyagcsere-vizsgálatokból derültek ki.
Az eukarióta evolúciójának korai szakaszában a trigliceridek (TG) az energiaigény és a rendelkezésre állás ingadozásaival szembeni előnyös tároló tápanyagként jelentek meg. A TG mindenütt jelenlévő kiválasztása ehhez a szerephez két fizikai-kémiai tulajdonságnak tulajdonítható: A TG-k nagyobb kalóriasűrűséget (9 kcal/g) biztosítanak, mint a szénhidrátok (4,5 kcal/g) vagy a fehérjék (4 kcal/g), és a TG-k vízben nem oldódnak., így magas szintre halmozódhatnak, a sejtekre gyakorolt káros ozmotikus vagy kolloid hatások nélkül. Magasabb organizmusokban a TG adipocitákban van, más sejttípusokban csak szokatlan körülmények között halmozódik fel. Például a vándormadarak nagy mennyiségű TG-t tárolnak a májban energiaforrásként, hosszú szezonális repülések előkészítése céljából, ezt a hajlandóságot kihasználták a kulináris finomság fois gras előállítására. A vándormadarakhoz hasonlóan néhány ember, aki a felesleges kalóriákat fogyasztja, zsírot rak le a májba. Emberben azonban a zsírmáj rosszul adaptív és súlyos klinikai következményekkel járhat.
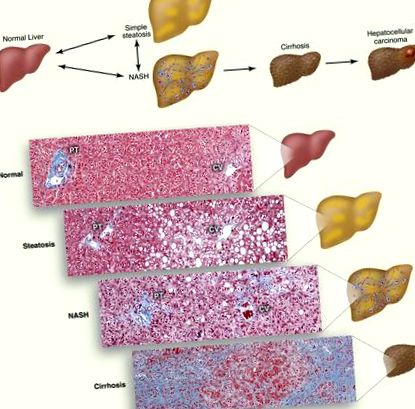
A nem alkoholos zsírmáj betegség betegségspektruma. (A) A NAFLD progressziójának vázlata. A hepatociták lipidcseppjein belüli TG felhalmozódása steatózist okoz. A gyulladással, sejthalállal és fibrózissal járó steatosis NASH néven szerepel, amely cirrhosissá válhat. A cirrhosisban szenvedő egyéneknél fokozott a hepatocellularis carcinoma kockázata. (B) Szövettani metszetek, amelyek a normális májat, a steatosist, a NASH-t és a cirrhosist mutatják be. A kollagén rostokat kékre festik Masson trikrom foltja. A portális triád (PT) látható, amely a máj artériából, a portális vénából és az epevezetékből, valamint a központi vénából (CV) áll.
Azokat a tényezőket, amelyek elősegítik a TG lerakódását a májban, valamint az embereknél a steatosisról a steatohepatitisre és a cirrhosisra való átmenetet, nem határozták meg egyértelműen. Az egérmodellek, amelyek összefoglalják az emberi betegség folytonosságának egyes jellemzőit, betekintést nyújtottak a kialakulásához hozzájáruló lehetséges kóros mechanizmusokba (4), de ezen utak relatív szerepét az emberekben nem határozták meg végérvényesen. Ebben az áttekintésben elsősorban az emberi genetikai vizsgálatok során felmerült új felismerésekre koncentrálunk. A NAFLD teljes spektrumához kapcsolódó szekvenciaváltozatok közelmúltbeli azonosítása valószínűleg új molekuláris nyomokat ad az egyre gyakoribb rendellenesség patogeneziséhez (5, 6).
A máj steatosisának patogenezise az embereknél
A máj steatosis a TG megszerzése és eltávolítása közötti egyensúlyhiányból adódik. A TG-ket úgy állítják össze, hogy három zsírsavat összekapcsolnak egy glicerin gerinccel észterkötések útján. Amint a 2. ábrán látható, a máj TG képződéséhez használt zsírsavak három forrásból származnak: (i) diéta, (ii) de novo szintézis és (iii) zsírszövet. A bélben felvett étrendi zsírokat TG-ben gazdag chilomicronokba csomagolják és a szisztémás keringésbe juttatják. Patkányokban,
A kilomikronokban levő TG 80% -át lipoprotein lipáz (LPL) hidrolizálja, szabad zsírsavakat (FFA) szabadít fel, felszabadítva a perifériás szöveteket. A maradék
20% -át a májba szállítják (7). E kísérletekből extrapolálva egy tipikus amerikai étrend (100 g zsír naponta) biztosítja a májat
20 g zsír minden nap, ami megfelel egy átlagos máj teljes TG-tartalmának felének.
A TG metabolizmusa a májban. Az FFA három fő forrása az étrend, az endogén szintézis és a perifériás szövetek. Az FFA-knak négy lehetséges sorsa van. Metabolizálódhatnak a mitokondriumokban β-oxidációval (β-OX), észterezve és TG-ként lipidcseppekben tárolva más lipidek képződésére használhatók (nem látható), vagy apoB-vel VLDL-be csomagolva a vérbe szekretálhatók. Azok a folyamatok, amelyek növelik az FFA és TG bevitelt, vagy csökkentik az FFA és TG kibocsátást, máj steatózist okoznak. A szénhidrátbevitel növeli a glükóz és az inzulin szintjét, amelyek két, a de novo lipogenezist elősegítő transzkripciós faktort aktiválnak a májban: ChREBP és SREBP-1c. Az inzulin az ATGL elnyomásával gátolja a zsírszövet lipolízisét. Chylo, chilomicron; TCA, trikarbonsav.
A szénhidrát-táplálás elősegíti az FFA de novo szintézisét acetil-koenzim A-ból (CoA) (2. ábra) az inzulin szintjének és a szubsztrát elérhetőségének növelésével. Az inzulin AKT2-t, LXR-t és mTOR-t tartalmazó jelátviteli kaszkádon keresztül stimulálja a transzkripciós faktor szterin szabályozó elem-kötő fehérjét – 1c (SREBP-1c) (8). Az SREBP-1c felfelé szabályozza a lipogenezist katalizáló enzimeket (9). A glükóz a lipogenezist is elősegíti azáltal, hogy aktiválja a transzkripciós faktor szénhidrátra reagáló elem-kötő fehérjét (ChREBP) (10). Az SREBP-1c-hez hasonlóan a ChREBP serkenti több gén expresszióját a zsírsav bioszintetikus útjában. Ezenkívül a ChREBP növeli a máj típusú piruvát kináz expresszióját, így több szubsztrátot biztosít az FFA és a TG szintéziséhez (10).
A koplalás során az inzulin plazmaszintje csökken, míg a glukagon és az adrenalin szintje megnő, serkenti a TG hidrolízist az adipocitákban (2. ábra). A TG hidrolízisének első lépését az adipocita TG hidroláz (ATGL) katalizálja (11). Az FFA-k felszabadulnak és a májba szállulnak, többnyire albuminhoz kötődve. A májban található FFA-knak három fő sorsuk van: A mitokondriumokban oxidálódva energiát és ketontesteket termelhetnek, újraészterezhetők TG-vé és lipidcseppekben tárolva, vagy apolipoproteinekhez kapcsolva és a nagyon kis sűrűségű lipoproteinek (VLDL) alkotóelemeként szekretálódhatnak. A májban lévő FFA-k foszfolipidekbe és más lipidekbe is beépülnek. Az FFA áramlása a keringésen keresztül kb
100 g/nap, 20% -ot a máj extrahál. Így a TG napi bevitele az étrendből (
20 g/nap) és zsírszövetből származó FFA (
20 g/nap) megközelíti a máj teljes TG-tartalmát.
Ritka, örökletes rendellenességekkel rendelkező embereken végzett vizsgálatok azt mutatják, hogy a máj TG-felhalmozódása a megnövekedett táplálékbevitel, a TG zsírszövetből a májba történő megoszlása vagy a fokozott de novo lipogenezis következtében máj steatózist eredményez (12). A veleszületett generalizált lipodystrophia változatlanul súlyos máj steatosishoz kapcsolódik (12). Az 1a típusú glikogéntároló betegség és a citrinhiány egyaránt fokozott de novo lipogenezishez vezet, és masszív máj steatózist okoznak még elhízás vagy inzulinrezisztencia hiányában is (13, 14). A citrinhiányt a mitokondriális aszpartát-glutamát transzporter mutációi okozzák. Ennek a transzporternek az inaktiválása felgyorsítja a malát-citrát cserét, ami a citoplazmatikus citrát növekedését eredményezi, amely acetil-CoA-vá alakul.
Azok a genetikai hibák, amelyek megakadályozzák a TG májból való eltávolítását, szintén steatosist okoznak. Az ATGL-ben vagy annak kofaktorában végzett mutációk, az összehasonlító génazonosítás – 58 (CGI-58) megakadályozzák az FFA mobilizálódását a lipidcseppekből (2. ábra). A mitokondriumokban az FFA oxidációjához szükséges enzimek hibái (a hidroxi-acil-CoA transzferázok) szintén máj steatózist okoznak (12). A máj TG-k fő export útja a vérbe történő szekréció, mint VLDL (2. ábra). A VLDL [apolipoprotein (apo) B] szerkezeti fehérjéjének vagy annak a fehérjének a mutációi, amelyek TG-t adnak az endoplazmatikus retikulumban (ER) a kialakuló lipoprotein részecskéhez (mikroszomális TG transzfer fehérje, MTTP), további okai a máj steatosisának. Az APOB mutációinak inaktiválására heterozigóta egyének kevesebb VLDL részecskét termelnek, és a máj TG-je háromszorosára nő az egészséges egyénekhez képest (15).
Mi a kapcsolat az elhízás, az inzulinrezisztencia és a máj steatosis között?
Az a megállapítás, hogy az energiaszubsztrátok zsírsavakká áramlását elősegítő genetikai betegségek, mint például az 1a típusú glikogéntároló betegség és a citrinhiány, még inzulinrezisztencia hiányában is steatosist okoznak, azt jelzi, hogy az FFA megnövekedett májba áramlása elegendő a steatosis kialakulásához ( 13, 14). Elhízott egyéneknél az étrendből, a zsírszövetből és a fokozott de novo lipogenezis révén a máj megnövekedett FFA-ellátása a máj steatosisának elősegítésére szolgál. A máj steatosishoz vezető három út relatív hozzájárulását emberben csak egy tanulmány határozta meg: Donnelly et al. (18) arról számolt be, hogy a májzsír 59% -a keringő FFA-ból származik, kisebb mértékben járul hozzá a de novo lipogenezis (26%) és az étrend (15%).
Fő megoldatlan kérdés, hogy a NAFLD az inzulinrezisztencia oka vagy következménye. A májban az inzulin gátolja a glükóztermelést és elősegíti a zsírsavszintézist. A máj inzulinrezisztenciájának kialakulásával az inzulin gátló hatása a glükóztermelésre csökken, míg az inzulin lipogenezisre gyakorolt stimuláló hatása megmarad (19). Az inzulinrezisztencia szoros összefüggésben van a steatosisral, és az inzulinrezisztenciát javító beavatkozások alacsonyabb inzulinszinthez és csökkent májzsírtartalomhoz vezetnek. Több állatmodell támogatja az inzulinrezisztencia, a hiperinsulinémia és a máj steatosis közötti közvetlen oksági kapcsolatot (4). Bizonyíték arra, hogy az inzulinrezisztencia embernél steatózist okoz, AKT2 mutációval rendelkező betegekből származik (20). Ezek a betegek mélységesen ellenállnak az inzulin glükoregulációs hatásaival szemben, de feltehetően megtartják az érzékenységet a hormon lipogén hatásaival szemben. Metasztatikus inzulinkiválasztó daganatok (inzulinómák) és hasnyálmirigy-szigetsejt-transzplantációk vizsgálata további bizonyítékokat szolgáltat arra vonatkozóan, hogy az inzulin közvetlenül elősegíti a zsír felhalmozódását a májsejtekben. Az áttétes inzulinómákat körülvevő hepatociták elnyelődnek a TG-kkel, valamint az átültetett szigetsejteket körülvevő hepatociták (21).
A máj steatosis és az inzulinrezisztencia egybeeső előfordulása ahhoz a hipotézishez vezetett, hogy a májban lévő TG felesleg inzulinrezisztenciát okoz. A máj steatosis és az inzulinrezisztencia együttesen fordul elő több genetikailag módosított egér törzsben (4, 22). Mindazonáltal azzal a felfogással, hogy a máj steatosis inzulinrezisztenciát okoz, ellentmondanak azok az egerek, amelyek különböző útvonalak hibáival járnak, és amelyek inzulinrezisztencia nélkül okoznak máj steatosist. Csökkentett zsírsavszintézissel (23), mobilizálással (24) vagy oxidációval (4), valamint hibás citokinjelzéssel (25) vagy kolinszintézissel (26) rendelkező egerek a máj TG felhalmozódása ellenére is fenntartják a normális vagy javított inzulinérzékenységet. A TG lehet egy másik molekula, amely zavarja az inzulin hatását, például a diacilglicerin (DAG), a hosszú láncú acil-CoA vagy a ceramid. Ezen lipidek bármelyikének májban történő felhalmozódása azonban mindig nem eredményez inzulinrezisztenciát, legalábbis egerekben [áttekintés céljából lásd (22)]. Továbbra is lehetséges, hogy ezek a lipidek csak akkor járulnak hozzá az inzulinrezisztenciához, ha meghatározott szubcelluláris rekeszekben halmozódnak fel, vagy ha van egy bizonyos zsírsav-komplementjük.
Emberekben a természetesen előforduló mutációk hatékony eszközt jelentenek az erősen korrelált metabolikus tulajdonságok közötti mechanisztikus kapcsolatok kibontásához. Ha a megnövekedett máj-TG-tartalom inzulinrezisztenciát okoz, akkor a máj steatosisát elősegítő genetikai variánsokkal rendelkező egyéneknek fokozottabban kell veszélyeztetniük az inzulinrezisztencia kialakulását. Egyre több mendeli genetikai hiba szétválasztotta ezt a két változót. Az APOB-ban inaktiváló mutációval rendelkező egyéneknél megemelkedett a máj TG szintje, ugyanakkor normális inzulinérzékenységet tartanak fenn (15). Az ATGL vagy a CGI58 mutációi által okozott autoszomális recesszív rendellenességekben szenvedő betegek súlyos steatosisban szenvednek, de nem inzulinrezisztensek (áttekintve (12)]. Populáció-alapú vizsgálatokban a PNPLA3 máj steatosishoz társuló genetikai változata nem társul inzulinrezisztenciával (lásd alább) (5). Az APOC3 szekvencia variánsai mind a máj steatosisával, mind az inzulinrezisztenciával társultak (25), de ezt az összefüggést más független populációkban nem figyelték meg (26, 27). Így a bizonyítékok túlsúlya nem kompatibilis azzal a hipotézissel, hogy a hepatocitákban a TG felhalmozódása inzulinrezisztenciát okoz az emberekben.
A máj steatosisának genetikai kockázati tényezői
Noha az elhízás és az inzulinrezisztencia a NAFLD leggyakoribb kockázati tényezője, a máj zsírtartalma jelentősen változik az egyenlő zsírtartalmú egyének között, ami azt jelzi, hogy más tényezők járulnak hozzá ehhez az állapothoz. Ezen tényezők egyike a nem. 60 éves kor előtt a férfiaknál lényegesen nagyobb a steatosis kialakulásának esélye, mint a nőknél (16), de idősebb korban a betegség inkább a nőknél fordul elő. Ennek a nemi dimorfizmusnak az okai nem ismertek. Egy másik tényező az etnikum. A Dallasi Szívvizsgálatban a máj steatosisát a spanyolok 45% -ában, az európai származású egyének 33% -ában és az afroamerikaiak 24% -ában találták (16). A spanyoloknál a máj steatosis nagyobb gyakorisága részben az elhízás és az inzulinrezisztencia nagyobb gyakoriságának tudható be ebben a populációban, de az afro-amerikaiak alacsonyabb prevalenciája nem magyarázható a BMI, az inzulinrezisztencia, az etanolfogyasztás vagy a gyógyszerhasználat etnikai különbségeivel. . Egy másik etnikai csoport, ahol a máj steatosisának gyakoribb előfordulása van, az ázsiai indiánok. Egy 482 sovány fiatal egyed vizsgálata kétszer magasabb máj TG-tartalmat tárt fel az ázsiai indiánoknál, mint az európai származású férfiak (28).
Máj steatosis, NASH és cirrhosis klaszter a családokban (29), a NAFLD öröklődésének becslése szerint
39% (30). Az egyik genetikai variáns, amely következetesen összefügg a NAFLD-vel, egy missense mutáció [Ile 148 → Met 148 (I148M)] a patatin-szerű foszfolipáz domént tartalmazó (PNPLA) 3 gén PNPLA3 (más néven adiponutrin) génben (5). Ezt a változatot kezdetben 9299 nem szinonim szekvenciaváltozat társulási tanulmánya révén azonosították, és a máj TG-tartalmával való kapcsolatot számos független tanulmány megerősítette [áttekintés céljából lásd (31)]. Az érzékenységi variáns (PNPLA3-148M) gyakorisága az etnikai csoportokban tükrözi a NAFLD elterjedtségét, és
A máj steatosis gyakoriságának 70% -a a spanyolok, az afro-amerikaiak és az európai származású egyének között (5). A PNPLA3 (MM) kockázati alléljának homozigótái a
kétszer magasabb máj TG-tartalom, bár a hatás nagyságát erősen befolyásolja az adipozitás és az inzulinérzékenység.
A PNPLA3 a PNPLA család tagja, leginkább hasonlít az ATGL-re (PNPLA2) (2. ábra) (11). A PNPLA3 a zsírszövetben és a májban fejeződik ki leginkább, és az inzulin transzkripciós úton szabályozza az LXR-t és az SREBP-1c-t tartalmazó jelátviteli kaszkádon keresztül; a máj PNPLA3 mRNS-szintje az éhezés során szinte észrevehetetlen szintre csökken, és az egerek újratáplálásával 80-szorosára nő (32). A hepatocitákban lévő PNPLA3 több mint 90% -a lipidcseppekben található, amelyek speciális organellák, amelyek részt vesznek a fehérje megosztásában, kereskedelmében és lebontásában [áttekintés céljából lásd (33)].
A PNPLA3 fiziológiai szerepe és az I148M izoform zsírmájat kiváltó mechanizmusa nem ismert. A tisztított fehérje mind TG hidroláz, mind transzaciláz aktivitással rendelkezik (34, 35). Az I148M szubsztitúció jelentősen csökkenti a TG hidroláz aktivitását in vitro (35), ami arra utal, hogy az I148M szubsztitúció funkcióvesztést okoz. Azonban a Pnpla3 inaktiválása egerekben nem növeli a máj TG-tartalmát (36, 37), és a PNPLA3-I148M adenovírus által közvetített túlzott expressziója egérmájban a máj TG-tartalmának növekedését okozza (35), ami jobban megfelel az I148M szubsztitúciójának funkciónyereséget biztosítva. További vizsgálatokra lesz szükség annak a molekuláris mechanizmusnak a meghatározásához, amellyel a PNPLA3 variációja érzékenységet kölcsönöz a NAFLD-nek.
Egy nemrégiben végzett, a máj steatosisának genom-szintű társulási vizsgálata 7176 résztvevővel (6) további fogékonysági lokuszokat tárt fel a NAFLD számára. Meglepő módon az újonnan azonosított genomiális intervallumok egyike sem tartalmazott olyan géneket, amelyek a máj steatosisának ritka Mendeli-rendellenességeihez kapcsolódnak, például APOB, ATGL, CGI-58, vagy a lipodystrophiához kapcsolódó géneket. A legnagyobb hatásméretű allél a PNPLA3-I148M volt, amely 3,26-os esélyarányt adott a NAFLD számára. A máj steatosishoz társuló többi genomi régió az NCAN és a PPP1R3B volt (1. táblázat). A szövettanilag definiált NAFLD-vel végzett független kohorsz elemzése ugyanazon csoport által összefüggést talált az NCAN-nal, a GCKR-rel és a LYPLAL1-vel, de a PPP1R3B-vel nem. Az esélyarány 1,37 (LYPLAL1) és 1,65 (NCAN) között változott. A GCKR és a PPP1R3B funkcióvesztésű alléljai várhatóan növelik a glükóz-6-foszfát szintjét, és ezáltal elősegítik a zsírsavszintézist. A NAFLD és a másik két érintett gén, az NCAN és a LYPLAL1 közötti mechanisztikus kapcsolatot még meg kell határozni. E gének szerepének tisztázása új betekintést nyújthat az anyagcsere útjaiba, amelyek hozzájárulnak a NAFLD általános formáihoz a populációban.
Asztal 1
A nem alkoholos zsírmájbetegséghez kapcsolódó gyakori változatok A NAFLD esélyarányait úgy számoltuk ki, hogy biopsziával igazolt NAFLD-t alkalmaztunk, és az ősökhöz illesztett kontrollokban (6). EA, európai amerikai; AA, afro-amerikai; ÉN, nincs meghatározva.
- A magas fehérjefogyasztás csökkenti a zsírmájbetegséget, a 2-es típusú cukorbetegséget
- A nem alkoholos zsírmáj betegségének felsorolása (11 összehasonlítva)
- Lipotoxicitás és steatohepatitis alkoholmentes zsírmájbetegség túltáplált egérmodelljében -
- A fogyás utáni több fehérje csökkentheti a zsírmáj betegségét
- A fogyás utáni több fehérje csökkentheti a zsírmáj betegségét