Az étrendi energiatartalom és a szivárványos pisztráng genetikai szelekciója által kiváltott máj- és izomcsere-anyagcsere-változások (Oncorhynchus mykiss)
Absztrakt
az izom lipidkészletei fontos energiaforrást jelentenek az izomfunkciók számára [például hosszan tartó izomgyakorlat (18, 35) vagy böjt (17) során]. Ezenkívül az izom lipidszintje jelentős érdeklődésre tart számot a haszonállat-ipar számára, mivel tápértékét és érzékszervi tulajdonságait tekintve erősen befolyásolja a hús minőségét (1, 36, 44). Az étrendi manipuláció és a genetikai szelekció jelenleg a haszonállatok izomzsírtartalmának kezelésére használt fő eszköz. Az energiafogyasztás és a genetikai tényezők szintén nagy hatással vannak az emberek elhízására (30).
Az étrendi energiaellátás növelése elősegíti a zsírlerakódást az egész testben, beleértve az izmokat a legtöbb halban (1, 36), valamint más haszonállatokban (11, 45). A lazacfélék nagyon képesek zsírokat raktározni az izmokban, és étrendi manipuláció során az izom lipidtartalmának széles skálája változik, 3% -ról 18% -ra (12, 36, 8), így a lazacfélék különösen alkalmas fajok, amelyekben az izomzsír-lerakódás és mobilizáció mechanizmusainak tanulmányozása.
Kísérleti halak és diéták
A szivárványos pisztráng két vonalát, amelyet L (sovány izomvonal) és F (zsíros izomvonal) néven terveztek, három generációs divergens szelekció után kapták meg a magas vagy alacsony izomzsírtartalomra, roncsolásmentes módszerrel (Distell Fish Fatmeter). A kiválasztási folyamatot Quillet és munkatársai részletezték. (32) A halakat az Institut National de la Recherche Agronomique (INRA) kísérleti létesítményekben (PEIMA, Drennec, Sizun, Finistère, Franciaország) 11,5 ± 0,5 ° C állandó vízhőmérsékleten nevelték. A kísérletet a A francia kutatási minisztérium állatgondozással kapcsolatos nemzeti jogszabályainak irányelvei.
Két kísérleti étrendet, melyeket LE (alacsony energiatartalmú étrend) és HE (nagy energiájú étrend) terveztek, az INRA fogalmazott meg, és egy takarmánygyártó készített extrudált pelleteként. Ugyanabból a halliszt alapú keverékből készültek. Mintegy 15% halolajat adtak a HE étrendhez, hogy a két étrend között nagy különbség legyen a lipidtartalomban. Az LE étrend 9,8% lipidet tartalmazott, amelyet halliszt szolgáltatott, míg a HE étrend 23% lipidet tartalmazott (1. táblázat), ami közel áll a fiatal szivárványos pisztrángok kereskedelmi étrendjeinek legmagasabb zsírtartalmához. Az étrendi nyers zsírtartalom növekedését a fehérje és a keményítő arányának csökkenése kísérte a HE étrendben, és a n-3 /n-6 többszörösen telítetlen zsírsav (1. táblázat).
Asztal 1. A kísérleti étrendek hozzávetőleges összetétele
LE, alacsony energiatartalmú étrend; HE, nagy energiájú étrend; DM, szárazanyag; FA, zsírsavak.
Etetési próba
Közvetlenül az első etetési idő előtt az egyes vonalak halait elosztották hat tartályba, 500 állatból (átlagos testtömeg: 0,16 g). Az egyes genotípusok három példányát LE vagy HE diétával etették 6 hónapig. Az első 4 hónapban az ételt feleslegben osztották szét annak biztosítására, hogy az élelmiszer-ellátás ne legyen korlátozó. Az ötödik hónaptól kezdve az étkezési pellet mérete elég magas volt ahhoz, hogy az el nem fogyasztott ételeket összegyűjthesse. A halakat 2 hétenként csoportonként súlyoztuk, és megszámláltuk az átlagos testtömeg kiszámításához. A takarmányfelvételt naponta regisztráltuk a vizsgálat utolsó 2 hónapjában, és a takarmány-hatékonyságot a 2 hónapos periódusra számítottuk.
Mintavételi eljárás
Az étrendi kezelés hosszú távú és nem a tesztétkezés hatásának tanulmányozásához az étkezés után 24 órával mintákat vettünk a halakból, hogy biztosítsuk az emésztés és az átjutás teljes folyamatát. Ez a táplálkozás utáni idő nem felel meg az éhezési állapotnak, mivel a pisztrángban, csakúgy, mint más ektoterm állatokban, az alap metabolikus szint később érhető el, mint az emlősöknél. Ez annak köszönhető, hogy alacsonyabb hőmérsékleten lassabb az átjutás és hosszabb a gyomor kiürülési ideje, mint az endoterm állatoknál. Tartályonként tíz halból vettünk mintát a „takarmányfelvétel mérési időszakának” kezdetén (5. hónap) és a végén (6. hónap). Tartályonként összegyűjtötték, őrölték és fagyasztva szárították, mielőtt elemezték volna az egész test fehérje- és zsírtartalmát.
A 6 hónapos etetési kísérlet végén az összes halat étkezés után 24 órával 2-fenoxi-etanollal altattuk a műtéti beavatkozásokhoz ajánlott dózisban (0,2 ml/l). Egyenként mérték a súlyukat és a hosszukat. Tartályonként tizenkilenc halat pusztítottak el egy éles fejütéssel. A májat és a zsigereket megmértük a hepatosomatikus index kiszámításához [HSI (%) = 100 × (májtömeg/testtömeg)], valamint a viszceroszomatikus index [VSI (%) = 100 × (teljes zsigertömeg/testtömeg)] kiszámításához. Az enzimaktivitás mérése céljából fehér izomdarabokat vágtunk ki a hátsó jobb filéből. A hal bal oldalán lévő filéket a vágás és a bőrelvonás után mintákként tartották a lipidtartalom elemzéséhez. Tartályonként három további halból vettünk mintát máj- és fehérizomra RNáz-mentes körülmények között a génexpressziós elemzés elvégzése céljából. Az összes szövetmintát folyékony nitrogénben lefagyasztottuk és -80 ° C-on tároltuk az elemzésig.
Kémiai elemzés
Az étrend kémiai összetételét és az egész test fagyasztva szárított, az ötödik és a hatodik hónapban gyűjtött mintáit a következő eljárásokkal elemeztük: szárazanyag 24 órán át 105 ° C-on, lipidek petróleum-éterrel 160 ° C-on végzett extrakció után, fehérje Kjeldahl módszerrel, bruttó energia adiabatikus bombakaloriméterben és keményítő az étrendekben glükóz-amiláz-glükóz-oxidáz módszerrel (40). Az izom teljes lipidtartalmát a Folch-módszer (10) szerint mértük oldószerként kloroform helyett diklór-metánnal.
Metabolikus utak
A genetikai szelekció és az étrendi kezelés hatását a lipogenezisre, a zsírsav oxidációra, a glikolízisre és az energiatermelésre az ezen utakban részt vevő kulcsfontosságú enzimek génexpressziójának és aktivitásának elemzésével tanulmányozták. Az acetil-CoA karboxiláz (ACC; EC 6.4.1.2) lipogén enzim, valamint a glükóz-6-foszfát-dehidrogenáz (G6PDH; EC 1.1.1.49) és az almas enzim (ME; EC 1.1.1.40), amelyek a zsírsavakhoz NADPH-t szolgáltatnak szintézist csak az aktivitás szempontjából elemeztük, mivel az adatbázisokban nem voltak szivárványos pisztráng szekvencia információk. A transzkripciós faktor peroxiszóma proliferátor által aktivált α (PPARα) gén expresszióját a zsírsav oxidáció kulcsszabályozójaként mértük.
Gén expressziós elemzés: kvantitatív RT-PCR.
2. táblázat. Hozzáférési szám és a célgén szekvenciák megfelelő adatbázisa
3. táblázat. A célgének qRT-PCR-rel történő amplifikálásához használt szivárványos pisztráng-primerek szekvenciái
Enzim tevékenységek.
Az enzimaktivitásokat megolvasztott máj- és fehérizom mintákon mértük. A zsírsav-szintáz (FAS; EC 2.3.1.85), az ACC, a G6PDH és az ME aktivitását a májban mértük Richard et al. (34), egyedi teljes májból nyert homogenátumok felhasználásával. A lipoprotein lipáz (LPL; EC 3.1.1.34) aktivitását izomintákban mértük Richard et al. (34).
A következő enzimek aktivitását mérték máj- és izommintákban. A hidroxi-acil-CoA dehidrogenáz (HAD; EC. 1.1.1.35) enzimaktivitást Kobayashi és mtsai. (22) A glikolízis útját a hexokináz 1 (HK1; EC 2.7.1.1) és a piruvát kináz (PK; EC 2.7.1.40) aktivitásának mérésével vizsgáltuk, a korábban leírtak szerint (21). A citrát szintázt (CS; EC 4.1.3.7) Singer és mtsai. (38) a DTNB 412 nm-en történő redukcióját követve. A NADP-függő izocitrát-dehidrogenáz (ICDH-NADP; EC 1.1.1.42) aktivitásának mérésére a mintákat jéghideg pufferben (20 mM Tris · HCl, 250 mM mannit, 2 mM EDTA, 100 mM NaF, 10 mM merkaptoetanol) homogenizáltuk. és 0,5 mM PMSF), ultrahanggal kezeltük és 12 000-nél centrifugáltuk g. Az aktivitást a NADP 340 nm-en történő redukcióját követően 89,7 mM tetraetil-ammónium-klorid pH-ján 7,4, 41 mM NaCl, 0,34 mM NADP, 0,43 mM MnSO4 és 4,17 mM d, l-izocitrát felülúszóhoz való hozzáadása után értékeltük. Az enzimaktivitás egy egységét az az enzimmennyiség határozta meg, amely 1 μmol szubsztrát/perc hidrolízisét katalizálta a vizsgálati hőmérsékleten. Az enzimaktivitásokat milligramm oldható fehérjében fejeztük ki. A fehérje koncentrációt Bradford módszerrel határoztuk meg, Bio-Rad protein assay kit (München, Németország) alkalmazásával, szarvasmarha szérum albuminnal standardként.
Statisztika
Az adatok átlag ± SE. Az elemzések elvégzése előtt szögtranszformációt alkalmaztunk az arányokra (lipid-, fehérje- és nedvességtartalom, VSI és HSI), hogy megfeleljünk a varianciaanalízis feltételezéseinek (a variancia homogenitása és a normálisan elosztott maradványok). Az étrendi kezelések, a vonalak és a vonal × étrend interakciók különböző paraméterekre gyakorolt hatásait az SAS statisztikai szoftver segítségével kétirányú (vonali és diétás) varianciaanalízissel (ANOVA) teszteltük. A különbségeket akkor tekintettük jelentősnek, ha a valószínűségi szint volt
4. táblázat. Az L és F vonalakból származó pisztráng növekedési teljesítménye és tápanyag-felhasználása 6 hónapig táplálta az LE és HE diétákat
5. táblázat. Az L és F vonalakból származó pisztráng teljes testösszetétele, morfológiai paraméterei és izom lipidtartalma 6 hónapig táplált LE és HE diétát
L vonal F vonal P Értékek LEHELEHEDietLineLine × DiétaTeljes testösszetétel,% WW Nedvesség70,7 ± 0,365,9 ± 0,669,9 ± 0,266,9 ± 1,30,00010,750,08 Fehérje17,3 ± 0,415,6 ± 0,316,8 ± 0,715,4 ± 0,40,00030,210,67 Lipid9,5 ± 0,215,3 ± 1,110,8 ± 0,515,2 ± 1,00,00010,270,16HSI,%1,3 ± 0,21,2 ± 0,21,3 ± 0,21,3 ± 0,30,140,990,33VSI,%8,3 ± 0,8 c 12,4 ± 1,3 a 7,7 ± 0,9 d 11,0 ± 1,9 b 0,00010,00010,0034Izom lipidtartalom,% WW4,3 ± 0,8 c 6,4 ± 1,2 b 6,3 ± 1,2 b 10,1 ± 2,3 a a, b, c, d P
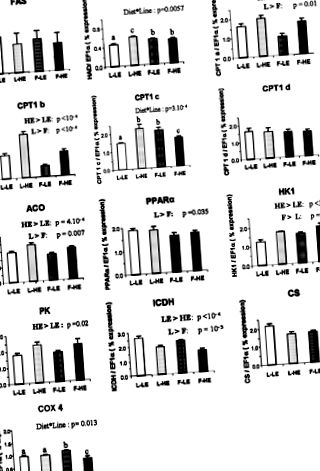
1. ábra.Kiválasztott enzimek génexpressziója a sovány izomvonal (L) és a zsírizomvonal (F) szivárványos pisztrángának májában magas (HE) vagy alacsony energiájú (LE) étrenddel, valós idejű kvantitatív RT alkalmazásával mérve -PCR. Lipid anyagcsere: zsírsav szintáz (FAS), hidroxi-acil-CoA dehidrogenáz (HAD), karnitin-palmitoil-transzferáz 1 izoformák (CPT1a, CPT1b, CPT1c és CPT1d), acetil-CoA-oxidáz (ACO) és peroxiszóma-proliferátor-aktivált receptor α (PPAR) α). Glikolízis: hexokináz 1 (HK1) és piruvát kináz (PK). Energetikai anyagcsere: izocitrát-dehidrogenáz (ICDH), citrát-szintáz (CS) és citokróm-oxidáz 4 (COX4). mRNS-t készítettünk egyedi májból (n = Csoportonként 9). Az adatok három példányban végzett 9 minta átlagai ± SE. Az expressziós értékeket az a-megnyúlási faktor 1 (EF1α) -val expresszált transzkriptumokkal normalizáljuk. a, b, c, d P
6. táblázat. Az L és F vonalak pisztráng májának specifikus enzimaktivitásai 6 hónapig táplálták az LE és HE diétákat
L vonal F vonal P Értékek LEHELEHEDietLineLine × DiétaLipogenezis FAS36,5 ± 2,024,8 ± 1,334,8 ± 3,526,7 ± 0,70,00020,950,42 G6PDH444,4 ± 39,1308,8 ± 16,3492,4 ± 35,5348,3 ± 33,50,00030,190,90 NEKEM76,2 ± 6,260,7 ± 3,780,1 ± 5,966,1 ± 8,40,030,460,93 ACC3,8 ± 0,22,9 ± 0,26,1 ± 0,34,6 ± 0,3
2. ábra.A kiválasztott enzimek génexpressziója az L és F vonalak szivárványos pisztrángjának fehér izmában HE vagy LE étrendet táplált, valós idejű kvantitatív RT-PCR-rel mérve. Lipid metabolizmus: lipoprotein lipáz (LPL), HAD, CPT1a, CPT1b, CPT1c, ACO és PPARα. Glikolízis: HK1 és PK. Energetikai anyagcsere: ICDH, CS és COX4. mRNS-t készítettünk a fehér izom egyedi mintáiból (n = 9 csoportonként, kivéve a HAD, CPT1a, CPT1b és PPARα értékeket, amelyek esetében n = 8). Az adatok három példányban végzett 9 minta átlagai ± SE. Az expressziós értékeket az EF1a-expressz transzkriptumokkal normalizáljuk.
7. táblázat. Specifikus enzimaktivitások a pisztráng izomában az L és F vonalakból 6 hónapig táplálták az LE és HE diétákat
- Az endoteliális nitrogén-oxid-szintáz (NOS3) genetikai variánsainak és metabolikus anyagainak elemzése
- A CD36 elvesztése véd az étrend okozta elhízás ellen, de károsodott izom őssejtet eredményez
- Hogyan járul hozzá a zsíros szájérzet, a sósság vagy a diéták édessége az étrend energiafelvételéhez?
- Hogyan kell enni az egész napos energiáért és az atlétikai teljesítményért az izomtörésért
- Életmódbeli és étrendi változások az endometriózis szempontjából