Az étrendi előrehaladott glikációs végtermék fogyasztása az egér csigolyatárcsainak mechanikai merevedéséhez vezet
Társított adatok
ABSZTRAKT
BEVEZETÉS
A fejlett glikációs végtermék (AGE) felhalmozódása a DM szövődményeinek forrása, és ismert, hogy növeli az arthrosclerosis (Saremi et al., 2017), a retinopathia és a veseelégtelenség kockázatát (Beisswenger et al., 1995). Az AGE nagyobb mértékben felhalmozódik a diabéteszes emberi IVD-kben is, ahol fokozott mátrixbontó enzimekkel társulnak (Tsai et al., 2014). Patkányokban a II típusú DM degeneratív változásokkal társult az IVD-kben, ideértve a glikozaminoglikán veszteséget és az IVD merevedését, amelyek ismét az AGE felhalmozódásának tulajdoníthatók (Fields et al., 2015). Korábban kimutattuk, hogy az I típusú DM egerek fokozott IVD strukturális zavarokat és gyulladáscsökkentő citokineket jelentettek, amelyek az AGE felhalmozódásával társultak (Illien-Jünger et al., 2013). Úgy gondoljuk, hogy az AGE a keresztkötések és a katabolizmus valószínű forrása az IVD-ben, ugyanakkor nem világos, hogy az AGE-k felhalmozódhatnak-e az avaszkuláris IVD-ben magas AGE-diéták bevitele miatt, vagy hiperglikémiás állapotokat igényelnek-e a DM-től.
Az AGE erősen oxidáló vegyületek, amelyek endogén (azaz hiperglikémia) és exogén (azaz hőkezelt élelmiszerek) források révén felhalmozódhatnak a szövetekben; Az étrendi AGE 10% -a felszívódik a belekben és felszabadul a véráramba (Koschinsky et al., 1997). Riasztó, hogy az elmúlt 20 évben a magasan feldolgozott élelmiszerekből álló nyugati étrend fogyasztása jelentősen megnőtt, növelve az elhízás és a DM előfordulását is (Cordain et al., 2005).
Nemrégiben az idősödő, pre-diabéteszes egerekben megmutattuk, hogy a specifikus AGE prekurzorral (metil-glicoxal) dúsított étrendek krónikus bevitele felgyorsította az életkorral összefüggő csigolyacsontvesztést és AGE felhalmozódást váltott ki a véglemezen belül (Illien-Jünger et al., 2015). További vizsgálatok után az étrendi AGE-k lenyelése nemi függő csontvesztést okozott alacsonyabb biomechanikai tulajdonságokkal fiatal (6 hónapos) nőstény egerekben (Illien-Jünger et al., 2018). Ezek a tanulmányok szolgáltatták az első bizonyítékot arra, hogy az étrendi AGE-k közvetlen hatással voltak a csigolyák szerkezetére és működésére, és azt is megmutatták, hogy ez a hatás nemtől függ. Továbbá, bár a véglemeznek erős immunfestése volt az AGE-kkel szemben, továbbra sem tisztázott, hogy az étrendi AGE-k felhalmozódhatnak-e IVD-kben, és hozzájárulhatnak-e a degenerációban ismert strukturális vagy katabolikus változásokhoz. Ezért a jelenlegi tanulmány célja az volt, hogy értékelje az étrendi AGE hatásait a női és hím egerek IVD-k szerkezetére és működésére. Feltételezzük, hogy a magas AGE étrend krónikus bevitele felhalmozódik az IVD-kben, és nemspecifikus IVD strukturális zavarokat és funkcionális változásokat eredményez, amelyek fokozott AGE térhálósodást és kollagén károsodást tartalmaznak.
EREDMÉNYEK
Általános megfigyelés
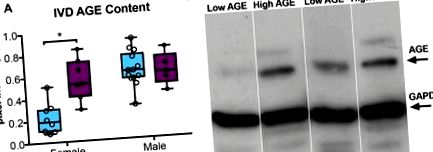
Míg az alacsony (L) -AGE és a magas (H) -AGE nőstény egerek között nem volt szignifikáns különbség [testtömeg: L-AGE = 26,6 ± 4,1 g, H-AGE = 26,3 ± 2,6 g, nem szignifikáns (n.s.); éhomi vércukorszint: L-AGE = 79,2 ± 15,3 mg/dl, H-AGE = 84,2 ± 18,7 mg/dl, ns], a hím H-AGE egerek testtömege kissé csökkent és az éhomi vércukorszint emelkedett a hím L-AGE-hez képest egerek (testtömeg: L-AGE = 29,6 ± 1,2 g, H-AGE = 27,3 ± 1,3 g, P = 0,002; éhomi vércukorszint: L-AGE = 71,2 ± 10,6 mg/dl, H-AGE = 88,4 ± 11,6 mg/dl, P = 0,006). Az áldozatot megelőző utolsó hónapban regisztrált ételfogyasztás szignifikánsan alacsonyabb chow-bevitelt jelzett a H-AGE-ben, összehasonlítva mindkét nembeli L-AGE egerekkel (nőstény: L-AGE = 4,6 ± 0,4 g/nap, H-AGE = 3,1 ± 0,3 g/nap, P 1. ábra) a női H-AGE-t a nőstény L-AGE egerekhez képest, Western-blot elemzés alapján. Míg a szérumban és az IVD-ben több AGE várható, a Western blot adatok a legkiemelkedőbb sávot fedezték fel, körülbelül 70 kDa-nál, ami a karboxi-metil-lizin becsült mérete, az egyik legelterjedtebb és legelterjedtebb AGE in vivo (Ikeda et al. Schleicher és mtsai., 1997). Úgy gondoljuk, hogy ezen a Western blot módszerrel a karboxi-metil-lizin volt az elsődleges AGE. Az AGE növekedése összhangban van a keringő teljes AGE-k H-AGE-ben észlelt növekedésével az L-AGE nőstényekhez képest, amint azt a szérum ELISA elemzés mutatja (16,9 ± 4,3 U/ml vs 9,5 ± 4,8 U/ml, P = 0,01 ). A hím egereknél nem figyeltek meg különbségeket az AGE-szintekben az IVD-kben vagy a szérumban (szérum AGE, hím: 11,7 ± 4,2 U/ml (H-AGE) vs 8,3 ± 1,1 U/ml (L-AGE), n.s.). Ezek az adatok azt sugallják, hogy az étrendi AGE-k szisztémásan felhalmozódnak, és valószínűleg nőstény egerekben DM vagy elhízás hiányában az IVD szövetben is felhalmozódnak. Az AGE felhalmozódásának étrendi hatását támasztja alá korábbi tanulmányunk is, amelyben a H-AGE diéta 80% -kal növelte a szérum AGE tartalmát, míg az öregedés csak 60% -os szérum AGE felhalmozódást eredményezett nőstény egerekben (Illien-Jünger et al., 2018 ). Nem figyeltek meg különbségeket hím egerekben.
AGE felhalmozódás az IVD-ben. (A) Western-blot analízis nagyobb AGE fehérjetartalmat mutatott a H-AGE nőstény (n = 7) IVD-kben az L-AGE nőstényeknél (n = 9), a H-AGE (n = 5) és az L-AGE között nincs különbség (n = 13) hím. Az adatokat dobozos ábrákként mutatjuk be a minimumtól a maximumig ± s.d. A P-értékek kétfarkú, nem párosított Student t-teszten alapulnak Bonferroni korrekcióval, és szignifikánsak, ha P≤0,05 (*). (B) Reprezentatív AGE western blot, az AGE és a GAPDH (belső kontroll) reprezentatív sávjaival. AGE-BSA pozitív kontrollt alkalmaztunk a mért AGE sávok validálásához. Egyes minták alacsony fehérjekoncentrációja miatt néhány mintát össze kellett gyűjteni a helyes mérés érdekében.
Az étrendi AGE-k megváltoztatták a női IVD-k biomechanikai tulajdonságait
Az IVD-k funkcionális értékelését axiális kompressziós-feszültségi és torziós biomechanikai vizsgálatokkal végeztük a caudalis IVD mozgásszegmenseken. A 2. ábrán bemutatott biomechanikai tulajdonságokat a nyomaték-forgatás (3. ábra) és az erő-elmozdulás (4. ábra) görbék második-utolsó ciklusától számítottuk. A nőstény H-AGE egerek IVD-jeinek szignifikánsan nagyobb volt a nyomómerevsége (+ 70%, P 5. ábra A) és nőtt a nyomatéktartományuk (+ 47%, P = 0,031, 5. ábra E) a nőstény L-AGE egerekhez képest. A kudarcelemzés azt mutatta, hogy a végső hiba nagyobb nyomatékkal következett be a nőstény H-AGE-ben, mint az L-AGE egerekben (+ 46%, P = 0,05, 5. ábra F), és hasonlóan a hibáig végzett munkához, amely összehasonlítható az anyaggal szívóssága nőtt a nőstény H-AGE-ben is az L-AGE egerekhez képest (+ 129%, P = 0,04, 5. ábra H). Nem tapasztaltunk különbséget a húzómerevség, az axiális mozgástartomány, a torziós merevség (5. ábra BD) vagy az IVD keresztmetszeti területei (keresztmetszeti terület: L-AGE: 1,89 ± 0,24 mm 2; H-AGE: 1,75 ± 0,28 mm 2, P> 0,05). A hím IVD-ket az étrend nem befolyásolta a mért biomechanikai paraméterek egyikében sem (5. ábra; keresztmetszeti terület: L-AGE = 1,65 ± 0,39 mm 2, H-AGE = 1,78 ± 0,17 mm 2, P> 0,05). Ezek az adatok azt mutatják, hogy a mozgásszegmens viselkedése a kompresszióban és a torzióban megváltozik a nőstény egereknél H-AGE diétán.
Biomechanikai vizsgálati elemzések. (A) Az erő-elmozdulás görbék vázlata tengelyirányú feszültség-kompressziós és torziós vizsgálatokhoz, bemutatva a merevség méréséhez használt lineáris régiókat, az axiális mozgástartományhoz mért régiókat és a nyomatéktartományt. CW, az óramutató járásával megegyező irányban; CCW, az óramutató járásával ellentétes irányba. (B) A torziós és a meghibásodási görbe sematikus ábrája, amely a végső meghibásodás pontját és a görbe alatti területet mutatja a meghibásodásig végzett munkaként.
Reprezentatív nyomaték-elmozdulás görbék. Ezek a görbék jelentik az (A, B) női és a (C, D) férfi L-AGE és H-AGE mozgásszegmensek torziós terhelésének második-utolsó ciklusát.
Reprezentatív erő-elmozdulás görbék. Ezek a görbék jelentik az (A, B) nő és a (C, D) férfi L-AGE és H-AGE mozgásszegmensek axiális feszültség-kompressziós terhelésének második-utolsó ciklusát.
Feszültség-kompressziós és torziós biomechanikai teszt. (A) A kompressziós merevség nőtt a H-AGE nőstényben ('F') (n = 11) az L-AGE F nőstényhez képest (n = 10), a (B) húzómerevségben, (C) axiális mozgástartományban nincs különbség vagy (D) torziós merevség. (E) A nyomatéktartomány növekedett a H-AGE F-ben (n = 8) az L-AGE F-ben (n = 7). A kudarcelemzésből kiderült, hogy az (F) végső meghibásodási nyomaték és (H) a meghibásodásig tartó munka nőtt a H-AGE F-ben (n = 7) az L-AGE F-hez (n = 6) képest, a (G) végső meghibásodásban nincs különbség fokozat. Nem találtunk különbséget az L-AGE hímek (‘M’) (n = 5) és a H-AGE M (n = 7) között. Az adatokat dobozos ábrákként mutatjuk be a minimumtól a maximumig ± s.d. A P-értékek kétfarkú, nem párosított Student t-teszten alapulnak Bonferroni korrekcióval, és szignifikánsak, ha P≤0,05. * P≤0,05, ** P≤0,001.
Az étrendi AGE megváltoztatta a női IVD-k annulus fibrosus szerveződését
Az IVD morfológiai változásainak értékeléséhez Picrosirius Red és Alcian Blue (PR/AB) festett metszeteket képeztek differenciális interferencia kontraszt (DIC) és polarizált szűrők alatt. A DIC képalkotás nem mutatott ki jelentős változásokat a morfológiában a nucleus pulposusban vagy a véglemezben (6. ábra A). Polarizált szűrőkön történő képalkotás során azonban a nőstény egerek annulus fibrosus (AF) kollagén rostjai világosabbnak tűntek a H-AGE-ben az L-AGE csoporthoz képest, a hím IVD-k között nem volt különbség (6. ábra B). Ezek a különbségek leginkább az elülső AF-ben voltak láthatóak, ahol a kollagén lamellák zöld/sárga színben jelennek meg. Ezek az adatok a kollagén rostok kettős törésében mutatkozó különbséget jelzik a H-AGE és az L-AGE nőknél.
Az IVD morfológiájának szövettani elemzése. Reprezentatív szagittális szakaszok Picrosirius Red/Alcian Blue-val (PR/AB) festve (A) differenciális interferencia kontraszt (DIC) és (B) polarizált fény alatt. Mindkét étrend nőstényei között nem figyeltek meg különbségeket a véglemezben és a nucleus pulposusban. A polarizált képek különbséget mutattak az annulus fibrosus (AF) kollagén rostok fényerejében az L-AGE (n = 5) és a H-AGE (n = 8) nőstények között. Nem figyeltünk meg különbséget az L-AGE (n = 5) és a H-AGE (n = 7) hímek között. Mérlegsorok: 100 μm.
Az étrendi AGE károsította a kollagén minőségét a női IVD-kben
A kollagén minőségének vizsgálatához két foton képalkotást alkalmaztunk a kollagén második harmonikus generáció (SHG) intenzitásának és egy kollagén hibridizáló peptid (CHP) számszerűsítésére, amely feltárja a sérült kollagén molekulákat. Nőstény, de hím egerekben az elülső AF-ben mért SHG kevésbé világosnak tűnt a H-AGE-ben, mint az L-AGE fotomikrográfoké (7. ábra A). Ezt megerősítették az SHG intenzitás kvantitatív mérésével, amely a női H-AGE-ben szignifikánsan csökkent az L-AGE IVD-khez képest (P = 0,037, 7. ábra C). Továbbá ugyanebben a régióban a kétfoton gerjesztésű fluoreszcencia (TPEF)/SHG, vagy a teljes AGE autofluoreszcencia mérése (Marturano és mtsai, 2014) nőtt a női H-AGE-ben az L-AGE IVD-khez képest (P = 0,03, 7. ábra B). Ugyanazon szövettani metszetek CHP-festése szignifikánsan megnövekedett CHP (zöld fluoreszcencia) festést mutatott a női H-AGE AF-jében az L-AGE IVD-khez képest (P = 0,03, 8. ábra), ami nagyobb kollagén károsodást jelzett. Úgy tűnik, hogy az AGE felhalmozódása nem befolyásolja a kollagén rostok összehangolását (a rost koherenciáján keresztül mérve) vagy a lamellák szerveződését (törésfaktoron keresztül mérve). A hím egerekben egyetlen paraméter tekintetében sem figyeltek meg különbséget. Ezek az adatok azt mutatják, hogy a H-AGE diéta csak nőstény egereknél vezetett AGE felhalmozódáshoz és kollagén károsodáshoz.
SHG kollagén az annulus fibrosus (AF) szövetben. (A) Reprezentatív képek kék színnel körvonalazva az érdeklődési területet. (B) Az AGE autofluoreszcencia növekedett és (C) az SHG intenzitás csökkent a H-AGE nőstényben ('F') (n = 6) az L-AGE F nőstényhez képest (n = 7), a (D) relatív kollagén különbségei nélkül a szálak orientációja vagy a (E) lamellák törése. A hímek között nem találtunk különbséget (L-AGE M és H-AGE M, n = 5 csoportonként). Az adatokat dobozos ábrákként mutatjuk be a minimumtól a maximumig ± s.d. A P-értékek kétfarkú, nem párosított Student t-teszten alapulnak Bonferroni korrekcióval, és szignifikánsak, ha P≤0,05 (*).
A kollagén molekuláris értékelése. (A) Az elülső AF CHP-vel festett fluoreszkáló képei megnövekedett CHP-festést mutatnak a H-AGE-ben a nőknél (’F’) és a hímeknél (’M’) összehasonlítva az L-AGE-vel. Az érdeklődési terület kék színnel van körvonalazva. (B) A CHP átlagos intenzitásának számszerűsítése jelentős kollagén károsodást mutat a H-AGE F-ben (n = 5) az L-AGE F-hez (n = 7) képest. A hímek között nem találtunk különbséget (L-AGE M n = 4, H-AGE M n = 5). Az adatokat dobozos ábrákként mutatjuk be a minimumtól a maximumig ± s.d. A P-értékek kétfarkú, nem párosított Student t-próbán alapulnak Bonferroni korrekcióval, és szignifikánsak, ha P≤0,05 (*).
VITA
Biomechanikai tesztelés
Valamennyi minta csak egy fagyás-olvadási cikluson ment keresztül, mivel ez befolyásolhatja az IVD mechanikai tulajdonságait (Azarnoosh et al., 2017). A mechanikai tesztelés előtt a mozgásszegmenseket felengedtük és hidratáltuk hideg 1 × PBS-ben 5-10 percig, és az IVD átmérőket féknyereggel mértük. Caudalis mozgásszegmenseket használtunk biomechanikai vizsgálatokhoz henger alakú geometriájuk, valamint viszonylag nagy IVD és csigolyamagasságuk miatt, amelyek egyszerűbbé teszik a megfogást és a tesztelést, mint az ágyéki mozgásszegmensek használatát ezekhez a kis egérmintákhoz. Korábbi tanulmányok összehasonlították a patkány ágyéki és farokkorongjainak torziós és kompressziós mechanikai viselkedését, és kimutatták, hogy a farok IVD-k némileg nagyobb semleges zónával és alacsonyabb merevséggel rendelkeznek, mint az ágyéki gerinc régiói (Espinoza Orías et al., 2009; Sarver és Elliott, 2005).
Szövettani értékelés
IVD morfológia
A rögzített, meszesedett ágyéki szegmenseket poli (metil-metakrilát) (PMMA) sejtekbe ágyazva 5 μm-es sagittális szakaszokat vágunk. A közép-szagittális szakaszokat PR/AB-vel festettük a kollagén-, illetve a proteoglikán-tartalom értékelése céljából. Ezután a PR/AB-vel festett metszeteket DIC-ben készítettük, az Axio Imager Z1 (Zeiss, Oberkochen, Németország) alkalmazásával az IVD teljes morfológiájának és összetételének felmérésére. Ugyanezeket a mintákat azután polarizált fényben, LEICA DM6 B (Leica Microsystems, IL, USA) alkalmazásával készítettük, az AF kollagén szerveződésének és elrendezésének kvalitatív értékeléséhez. Az összes szövettani elemzés során, míg a mintaméretek kezdetben kiegyensúlyozottak voltak a csoportok között, a végső számok az egyes csoportokban eltérőek voltak, mert csak közepes-sagittális szakaszokat használtak összehasonlításra, és a nem sagittális szakaszokat kizárták az elemzésből; a festéssel kapcsolatos technikai hibák miatti kivételeket szintén kizárták.
A kollagén molekuláris értékelése
A PMMA-beágyazott közép-sagittalis ágyéki szakaszokat kollagén hibridizáló peptid-biotin konjugátum (B-CHP; BIO300, 3Helix Inc.; Salt Lake City, UT, USA) segítségével festettük a kollagén károsodás jelenlétének kimutatására az előzőekben leírtak szerint (Hwang et al. (2017; Zitnay et al., 2017). Ez az eljárás magában foglalja 2 µM CHP-oldat létrehozását, az oldat 5 percen át 80 ° C-on történő melegítését a peptidek monomerizálására, jeges fürdőben 30 másodpercig történő leoltását és az oldat felvitelét a szövetre. A szövetet egy éjszakán át inkubáltuk, majd pozitív kötődést detektáltunk GFP-vel jelölt streptavidin (Dylight 488 Strepavidin; Vector Laboratories Inc., Burlingame, CA, USA) alkalmazásával.
SHG képalkotás
A nem festett gyantába ágyazott részeket Olympus FV1000 MPE lézerszkennelő mikroszkóppal (Olympus Corporation, Tokió, Japán) készítettük az Icahn Orvostudományi Egyetemen, a Sínai-hegyi Mikroszkópmagon. Kétfoton gerjesztést végeztünk a hangolható Coherent Chameleon Vision II lézerrel. A visszafelé irányuló jelterjedést a dedikált Olympus WLPLN 25 × objektív segítségével vettük be, 1,05-ös numerikus rekesszel. Lépésenkénti megközelítést alkalmaztunk a fibrilláris kollagén SHG jelének és a teljes AGE autofluoreszcencia TPEF jelének (Tang et al., 2007; Vashishth, 2009) rögzítésére az egyes minták elülső AF-jében. A hátrafelé irányuló SHG (B-SHG) gerjesztését 910 nm-en végeztük, és 440 ± 10 nm-en fényszorzó csővel (PMT) rögzítettük. A lézert ezután 740 nm-re hangoltuk, és a TPEF-et ugyanazzal a detektorral 440 ± 10 mm-en rögzítettük. Az SHG és a TPEF képalkotás során az összes paramétert (azaz a lézerintenzitást, az erősítést, a feszültséget, a várakozási időt, a képarányt) állandó értéken tartottuk, hogy lehetővé tegyük a kép intenzitásának összehasonlítását. Az optikai szeleteket minden szakaszon át vettük 1,5 µm lépésmérettel, és maximális intenzitású z-vetítést hajtottunk végre mind SHG, mind TPEF esetében. A B-SHG és a TPEF intenzitást úgy értékeltük, hogy az elülső AF átlagos pixelintenzitását/területét NIH-ImageJ alkalmazásával mértük (http://rsbweb.nih.gov/ij/).
Rost orientáció elemzés
Statisztika
Minden adat dobozos ábrákként jelenik meg, minimális, első kvartilis, medián, harmadik kvartilis és maximális értékekkel, hibasávokkal jelezve a szórást. Kétfarkú, párosítatlan, Bonferroni-korrekciójú Student-féle t-tesztet alkalmaztunk az L-AGE és a H-AGE nőstények, valamint az L-AGE és a H-AGE hímek között. Minden adatot szignifikánsnak tekintettünk, ha P≤0,05, és trendnek, ha P≤0,10.
- A fejlett glikációs végtermékek (AGE) étrendi bevitele és a testtömeg változásai Európában
- Diétás fejlett glikációs végtermékek és lehetséges szerepük a kardiometabolikus betegségben
- Diétás változatosság és táplálékcsoport-fogyasztás teheneket fogyasztó gyermekeknél; tejkizárásos étrend -
- A magas tejelő étrend fogyasztása egészséges emberek koleszteril-észtereinek magasabb 15 0-át eredményez
- Táplálkozási szokások, ételfogyasztás és tápanyagbevitel serdülőkorban - ScienceDirect