Az étrendi lecitin megvédi a kolesztatikus májbetegségeket a kolinsav-táplálékban Abcb4− Hiányos egerek
Absztrakt
Egerek homozigóta zavarával Abcb4 gén nem képes szétválasztani a PL-ket az epébe, és olyan elváltozásokat fejleszt ki, amelyekre a portális traktus gyulladása, az epevezeték proliferációja és a portál fibrózis jellemző (7–9). Ezek az állatok modellnek tekinthetők az ember számára Abcb4 hiány, a csecsemők PFIC3-tól a felnőtt májcirrhosisig terjedő betegség (10). Az elváltozások azonban lassan haladnak be Abcb4-hiányos egerek valószínűleg azért, mert az epe 50–70% muricholátot tartalmaz és hidrofil, míg a hidrofób kolát és a dezoxikolát az emberekben kiemelkedő. A kolát etetése Abcb4 -/- az egerekről kimutatták, hogy növelik az epesó medence hidrofóbicitását és rontják a máj patológiáját, beleértve az epefibrózt is (11), megerősítve, hogy a krónikus epehám károsodása részben a hidrofób epesavak működéséhez kapcsolódik, amelyeket a micellarizáció nem inaktivál. PL-vel.
Annak ellenére, hogy rendelkezésre állnak bizonyos kezelések, például az ursodeoxycholsav, a májkárosodás gyakran májcirrhosissá válik Abcb4 hiányra (12) és májtranszplantációra van szükség, hangsúlyozva, hogy az új terápiás szerek keresése továbbra is kiemelt prioritás. A laboratóriumi vizsgálatok kimutatták, hogy az állatok etetése L-dúsított étrenddel serkenti az epeváladékot az alapállapotban és a máj epesó-terhelése után (13,14). Az L korlátozza az állatokban szén-tetraklorid vagy alkohol által kiváltott májfibrózis kialakulását is (15,16).
Ezek a megállapítások arra késztettek bennünket, hogy azt javasoljuk, hogy az L-kiegészítő étrend előnyös lehet kolesztatikus májbetegségben. Jelen tanulmány megvizsgálta az L-kiegészített étrend hatását az epeválasztásra, a szérum májenzimekre és a máj patológiájára Abcb4 -/- egerek.
ANYAGOK ÉS METÓDUSOK
Állatok és kísérleti tervezés.
Abcb4 -/- és Abcb4 + /+ hím egereket (FVB/NJ genetikai háttér) a Jackson Laboratóriumtól (Bar Harbor, ME) szereztünk be. Az elválasztás után az állatokat négy étrend-csoportra osztottuk, amelyek mindegyike öt-nyolc olyan állatot tartalmazott, akik a következő sémákat kapták: C-diéta; L-kiegészített étrend; C-étrend 0,025% CA-val (Calbiochem Corp, San Diego, Kalifornia); L-kiegészített étrend, 0,025% CA-val (L + CA). Kísérleti kísérletek alapján megállapították, hogy ez az alacsony CA szint elegendő a májbetegség fenotípusának fokozásához. A kezelési módok lipidtartalmát 16% triacil-glicerin (napraforgómagolaj) képviselte a C diétában és 20% L granulátum (Sigma Chemical Co., St. Louis, MO) az L-kiegészített étrendben. Az L granulátum 78% triacil-glicerint és 22% PL-t tartalmazott. A triglicerid százalékos aránya mindkét étrendben összehasonlítható volt, és a zsírsav-összetétel nem különbözött szignifikánsan az egyes étrendek között. A C- és L-kiegészített étrend összetételét máshol írták le (13,14). Az egereket 12: 12-órás világos-sötét ciklus alatt helyezték el, és szabadon hozzáférhettek az élelemhez és az ivóvízhez. Valamennyi protokoll teljes mértékben megfelelt az Université de Montreal állatgondozási irányelveinek.
2 hetes étrendi beavatkozás után az állatokat lemértük és i.p. bróm-dezoxiuridin (BrdU) (4 mg/testtömeg-kg (BW). Egy órával később ip ketaminnal (4 mg/testtömeg-kg) és ip-xilazinnal (11,3 mg/testtömeg-kg) altattuk őket, a hasat kinyitottuk és a epehólyag-kötés után PE-10 polietilén katéterrel kanülált közös epevezeték. A testhőmérsékletet 37 ° C-on tartottuk egy termosztáttal szabályozott infravörös lámpa alkalmazásával. Az epe összegyűlt (3 óra éhgyomorra után) jégen előmérlegelt csövekben 1 órán át 15 perc alatt. -min alikvot részeket és azonnal lefagyasztottuk. Az epeáramlást a csövek összegyűjtése után történő lemérésével meghatároztuk, 1 g/ml sűrűséget feltételezve. Aortából a punkcióval vért vettünk, és centrifugálás után szérumot nyertünk, és az elemzésig -80 ° C-on tároltuk. Kivágás után egy darab friss májszövetet 10% semleges formalinban rögzítettünk és paraffinba ágyaztunk fénymikroszkópos vizsgálat céljából; egy másik darabot azonnal folyékony nitrogénnel hűtött izopentánban fagyasztottunk le és -80 ° C-on tároltunk.
Szérum bilirubin és májenzimek.
Az alanin-aminotranszferázt (ALAT), az alkalikus foszfatázt (ALP), a GGT-t és a bilirubint rutin klinikai biokémia segítségével vizsgálták.
Szövettan, Sirius vörös festés, immunhisztokémia és immunfluoreszcens festés.
Az 5 μm vastag májszekciókat hematoxilin-eozinnal festettük a szokásos szövettani vizsgálatokhoz és Sirius vörös színnel [telített pikrinsav 0,1% (tömeg/térfogat%) Sirius vöröset tartalmazó desztillált vízben (BDH Chemicals Ltd., Poole, Egyesült Királyság)] a májfibrózis (17). Az összes tárgylemezt az EUKITT-vel (O. Kindler GmbH, Freiburg, Németország) szereltük fel. A kísérletsorozat összes mintáját egyszerre festettük.
A miofibroblasztok által expresszált a-simaizom aktin (SMA) kimutatásához a paraffin metszeteket paraffinizáltuk, hidratáltuk, Tris-pufferolt sóoldattal mostuk és 3% H2O2-val metanolban inkubáltuk az endogén peroxidáz gátlásához. A metszeteket ezután SMA elleni egér monoklonális antitesttel (IgG2a) inkubáltuk (DakoCytomation, Glostrup, Dánia), 1/250-et hígítva Tris-pufferolt sóoldattal 30 percig. Mosás után az epitópokat az Envision + system HRP detektáló készlettel (DakoCytomation) 30 percig detektáltuk, majd a metszeteket 1 mg/ml diaminobenzidinnel és 0,1% H2O2-val kezeltük 0,05 mol/l Tris-HCl-ban (pH 7,6) kb. 20 perc Vízzel történő mosás után a metszeteket hematoxilinnal festettük és EUKITT-rel szereltük fel.
A BrdU kimutatásához a metszeteket paraffinmentesítettük, hidratáltuk, és 3% H2O2-val metanolban, majd 20% humán szérummal kezeltük, amely 1% szarvasmarha-szérum albumint (BSA) tartalmazott, és 2 mol/l HCl-t 1 órán át. A metszeteket egy éjszakán át 4 ° C-on inkubáltuk a BrdU elleni patkány antitesttel [1/500 arányban hígítva foszfáttal pufferolt sóoldatban (PBS)/1% BSA-ban; Oxford Technology, Oxford, Egyesült Királyság], majd egy nyúl anti-patkány antitest (1/100 arányban hígítva PBS-ben/1% BSA-ban; DakoCytomation) 45 percig. Mosás után az epitópokat az Envision + rendszer HRP detektáló készletével detektáltuk, és folyékony diaminobenzidinnel tártuk fel (DakoCytomation).
Az epevezeték hámsejtjeiben a citokeratin expressziójának kimutatására a fagyasztott szakaszokat levegőn szárítottuk, 10 percig -20 ° C-on acetonban rögzítettük, 20% -os PBS/1% BSA humán szérummal kezeltük és PBS-ben öblítettük. Ezután 45 percig inkubáltuk az epe epithelium specifikus pancitokeratinnal szembeni nyúl poliklonális antitesttel (Wide Spectrum Screening; DakoCytomation), 1/800 arányban hígítva 1% BSA-t tartalmazó PBS-ben. Mosás után a metszeteket 45 percig inkubáltuk Alexa Red-hez (1/200 hígított; Molecular Probes, Eugene, OR) konjugált kecske nyúlellenes antitesttel. Kifalásgátló szerelő közegben történő feldolgozás után a metszeteket Zeiss Axioplan 2 mikroszkóppal vizsgáltuk, amely epi-megvilágítással és specifikus szűrőkkel volt felszerelve (Carl Zeiss Microscopy, Jena, Németország). A képeket az AxioVision képfeldolgozó és elemző rendszer (Carl Zeiss Vision) segítségével szerezték be. A mennyiségi adatokat számítógépes képelemző rendszerrel (KS 300, Carl Zeiss Vision) kaptuk.
A Sirius vörös festéssel, az epevezeték hámsejtjeinek proliferációjával (citokeratin festés) és a miofibroblaszt differenciálódással (SMA festés) értékelt fibrózis lerakódást a festett területek százalékában fejeztük ki a teljes mért területen. A sejtszaporodást a portális területeken jelenlévő BrdU-val festett fibroblasztos sejtek számával értékeltük. A BrdU-val festett májsejteket vagy epeúti hámsejteket nem vettük fel.
Az összes hisztopatológiai vizsgálatot ugyanaz a vizsgáló (T. L.) végezte, akit elvakítottak az egerek genetikai és étrendi állapotától.
Epesav meghatározások az epében.
Az összes epesavat 3a-hidroxi-szteroid-dehidrogenázzal (Sigma Chemical Co.) (18) vizsgáltuk. Az epesavakat gázkromatográfia-tömegspektrometriával határoztuk meg, Hewlett-Packard 5971A tömegszelektív detektorral felszerelt Hewlett-Packard 5896 gázkromatográfiával, kiválasztott ionfigyelési módban. Korrekciós tényezőt kaptunk a mennyiségi meghatározáshoz 5β-kolánsav belső standardként történő alkalmazásával (19).
Lipidek az epében.
A koleszterin (CHOL) és a PL koncentrációt a lipidek extrahálása után mértük Bligh és Dyer (20) szerint. Mindkét paramétert enzimatikusan számszerűsítettük kereskedelmi készletekkel.
Statisztikai analízis.
Az átlagértékeket háromutas ANOVA alkalmazásával hasonlítottuk össze. Ha pozitív volt, két csoport közötti különbségek jelentőségét értékelte t teszt; o
EREDMÉNYEK
BW és a máj súlya.
Az étrendeket minden állat jól elfogadta, és a bevitt étrend mennyisége hasonló volt a különböző csoportokban. A BW nyereség hasonló volt 2 hét kísérlet után az összes WT csoportban. Ban ben Abcb4 -/- egereknél a BW önmagában a C- vagy L-kiegészített étrenden nem változott. Azonban a CA-val kiegészített étrendcsoport 9,4% -os testtömeg-veszteséget mutatott, amelyet ellensúlyozott az L-kiegészítés (L + CA) (az adatokat nem közöltük).
Az összes WT csoport májtömege/100 g testtömeg-tömeg változatlan volt. A kiütéses (KO) egerekben a máj súlya szignifikánsan megnőtt a CA-val kiegészített étrend csoportban a C diéta csoporthoz képest (9,01 ± 0,48 g/100 g testtömeg ellen 5,37 ± 2,15 g/100 g testtömeg-tömeg; o ≤ 0,05). Amikor ezek az állatok L + CA-val kiegészített étrendet is kaptak, a máj súlya jelentősen csökkent (5,38 ± 0,45 g/100 g testtömeg-súly) és hasonló maradt a C-diétás csoport súlyához.
Szérum májenzimek és bilirubin.
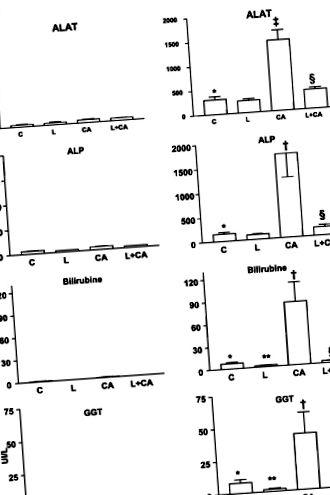
A májenzimek és a szérumban levő bilirubin a normális tartományban voltak a WT egerek négy étrendi csoportjában (1. ábra).
Ban ben Abcb4 -/- a C-étrenddel etetett egerek, a szérum májenzimek és a bilirubin szignifikánsan magasabb volt, mint a C-étrendet fogyasztó WT-egereknél (1. ábra). Az L-kiegészített étrend csoportban csökkent a bilirubin és a GGT szint a C diétás csoporthoz képest, míg az ALAT és az ALP megközelítőleg nem változott. A CA-val kiegészített étrendcsoport jelentősen megemelkedett májenzimeket és bilirubint mutatott a C diétacsoporthoz képest. L megakadályozta ezeket a megemelkedéseket, az L + CA-val kiegészített étrendcsoport értéke összehasonlítható volt a megfelelő CA-val nem rendelkező kontrollokkal (L-kiegészített étrend-csoport).
Epeáramlás és epeösszetevők.
WT egerekben az epeáramlás és az összes epesav, a CHOL és a PL biliáris szekréciója jelentősen megnőtt a CA vagy L hozzáadása után a C diétához képest (2. ábra). Az L + CA étrendet tápláló egerek értékei még hangsúlyosabbak voltak, mint amikor ezeket a szereket egyenként adták.
A PL és a CHOL mindegyike jelentősen károsodott maradt Abcb4 -/- egerek, kivéve az L-kiegészített étrendcsoportot, amely a CHOL-kibocsátás jelentős emelkedését mutatta. A WT egerekkel ellentétben a CA etetés után nem tapasztaltak az epe áramlásának és az összes epesav szekréciójának növekedését a KO egerekben. L (L + CA-kiegészített étrend) hozzáadása nem volt szignifikáns hatással az epe áramlására és az epesav-szekrécióra (2. ábra).
Az epesó-összetétel eredményei (az adatokat nem közöljük) a várakozások szerint azt mutatják, hogy Abcb4 -/- a C étrenddel etetett egerekben a fő epesavak a muricholsavak voltak (55 ± 3,6%), majd a CA (43 ± 3,6%). A dihidroxilezett epesavak (deoxikolsav, chenodeoxycholic sav és ursodeoxycholic sav) 2,25 ± 0,06% -kal járultak hozzá. A CA-t kapó egerekben a CA hozzájárulásának százaléka 77 ± 7,7% -ra, a muricholsavak hozzájárulása 18 ± 10% -ra csökkent. A dihidroxilezett epesavak százalékos aránya nem változott. A CA-val és L-vel egyaránt táplált egerekben a CA volt a fő epesav (90 ± 2,6%), és a muricholátok hozzájárulása 8,0 ± 2,6% volt, míg a dihidroxilezett epesavaké az összes epesav 1,31 ± 0,23% -a. Így a CA volt a fő biliáris epesav a C-étrenddel táplált egerekben vagy az L + CA-kiegészített étrendben.
Duktuláris hiperplázia, myofibroblast aktiváció, sejtproliferáció a portális területeken, valamint májfibrózis WT és KO egerekben.
A standard szövettan normál portálterületeket tárt fel a négyben Abcb4 + /+ csoportok, beleértve a CA-t kapó állatokat (az adatokat nem közöljük). A citokeratin immunfestés normális epe struktúrákat tárt fel, nincsenek szaporodó fibroblasztos sejtek és nincs myofibroblast aktiváció a portál területén. A fibrózis lerakódása hiányzott.
Az adatok Abcb4 -/- az egereket a 3. és 4. ábrán mutatjuk be. A C diéta csoportban csak kevéssé károsodott az epehám, amely helyenként álrétegződött. A citokeratin immunfestés normális számú epebeli struktúrát mutatott ki. A BrdU festés kevés proliferáló fibroblaszt sejtet tárt fel a portál területén (az adatokat nem mutatjuk be). Az SMA immunfestés azt mutatta, hogy nem történt myofibroblast aktiváció a portál területén. A fibrózis lerakódása, amelyet a Sirius vörös festéssel értékeltek, szinte hiányzott. A szövettani eredmények hasonlóak voltak az L-kiegészített étrend csoportban.
Normál szövettan, immunfestés citokeratin (CK) és α-simaizom aktin (SMA), valamint Sirius vörös (SR) festés esetén Abcb4 -/- egerek. A CA-vel táplált egerekben (CA) a portális traktusokat megnövelték (HES) az epeúti duktuláris struktúrák kiterjedésével a perifériájukon (CK), számos aktivált myofibroblaszt (SMA) és a fibrosis depozíció (SR) mellett. L drámai módon javította ezt a májkárosodást az L + CA-diéta egerekben, amelyek szövettani eredményei hasonlóak maradtak a C-diéta és az L-kiegészített étrendcsoportokéhoz (C és L). Nagyítás × 100.
A CA-val kiegészített étrenddel etetett egerekben a portális traktusokat megnövelték, jelentősen megnövelve a perifériájukon lévő epeúti duktuláris struktúrák számát. A BrdU festés a portális területeken a proliferáló fibroblasztos sejtek növekedését mutatta (az adatokat nem mutatjuk be), és számos SMA-pozitív myofibroblaszt volt jelen, különösen a portális traktusok perifériáján a duktuláris struktúrák körül. A fibrózis lerakódása szignifikánsan megnövekedett a portál területein és a septákon belül.
L drámai módon javította a májkárosodást az L + CA diéta csoportban. A fibroblasztikus sejtproliferáció és a miofibroblaszt-aktiváció még hasonló maradt a megfelelő C diéta csoportban. Jelentős fibrózis lerakódást nem figyeltek meg.
Képelemzéssel történő számszerűsítés megerősítette a CA csoportban a duktuláris struktúrák növekedését, a fibroblasztikus sejtproliferációt, a miofibroblaszt aktiválódást és a fibrózist. Az értékek hasonlóak maradtak a kontrollok értékéhez, amikor ezek az egerek szintén kaptak L-t (L + CA csoport) (4. ábra).
VITA
Összefoglalva, L képes ellensúlyozni a májbetegség progresszióját Abcb4 -/- egerek, új kezelési lehetőségeket nyitva a gyermekek számára ABCB4 hiány.
- Élelmiszer-adalékanyagok, étrend-kiegészítők és parenterális táplálkozás által kiváltott kolesztatikus májkárosodás -
- Az alkoholmentes steatohepatitis (NASH) vagy az alkoholmentes zsírmáj betegség diétás kezelése
- Étrendi változások a zsírmájbetegség és az alkoholmentes steatohepatitis dLife kezelésére
- Kutya májbetegség diéta
- Az ezekben a zöldségekben található vegyület segíthet a zsírmájbetegség elleni küzdelemben. Study Lifestyle News, The