Az intravénás immunglobulin (IVIG) A20 expresszió indukálásával csillapítja a TNF által kiváltott patológiás csontreszorpciót és elnyomja az osteoclastogenezist.
Min Joon Lee
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
Elisha Lim
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
Sehwan Mun
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
Seyeon Bae
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
Koichi Murata
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
Lionel B. Ivashkiv
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
2 fokozatú immunológiai és mikrobiális patogenezis program, Weill Cornell Orvostudományi Doktori Iskola, New York, NY 10021 USA
3 Orvostudományi Tanszék, Weill Cornell Orvosi Főiskola, New York, NY 10021 USA
4 dr. Park-Min és Ivaškiv egyaránt hozzájárult ehhez a munkához
Kyung-Hyun Park-Min
1 Arthritis és szövetdegenerációs program, David Z. Rosensweig Genomikai Kutatóközpont, Speciális Sebészeti Kórház, New York, NY 10021 USA
3 Orvostudományi Tanszék, Weill Cornell Orvosi Főiskola, New York, NY 10021 USA
4 dr. Park-Min és Ivashkiv egyaránt hozzájárult ehhez a munkához
Társított adatok
Absztrakt
Bevezetés
Az intravénás immunglobulin (IVIG) több ezer egészséges donor plazmájából származó összesített immunglobulinokat tartalmaz, és az IVIG-terápia hatékony volt számos autoimmun és krónikus gyulladásos betegségben (Kazatchkine és Kaveri, 2001; Schwab és Nimmerjahn, 2013). Az IVIG különböző receptorokon keresztül juttatja el a jeleit, beleértve az Fc gamma receptorokat (FcγR), amelyek kötődnek az immunglobulin G Fc részéhez, és a CD209-et (más néven DC-SIGN, dendritikus sejt-specifikus intercelluláris adhéziós molekula-3-megragadó nem-integrin). (Anthony és mtsai, 2011). Az IVIG gyulladáscsökkentő funkciójának mechanizmusai összetettek, és számos lehetséges mechanizmust leírtak (Kazatchkine és Kaveri, 2001; Schwab és Nimmerjahn, 2013). Az IVIG terápia immunmoduláló és gyulladáscsökkentő hatásainak pontos mechanizmusait azonban nem sikerült teljesen tisztázni.
Az antitestek által kiváltott arthritis modellekben az Fcγ receptorok aktiválása nem volt közvetlen hatással a csont pusztulására (MacLellan et al., 2011; van Lent et al., 2006), de az FcγRIV, amely az egyik aktiváló Fcγ receptor, pozitív szerepet játszik az immun komplexben közvetített csontrombolás a K/BXN szérum által kiváltott arthritis modellben (Ochi et al., 2007; Seeling et al., 2013). Az FcγR-hiányos egerek normális csontfenotípusúak (Seeling et al., 2013), ami azt mutatja, hogy az Fcγ receptorok fiziológiai körülmények között minimálisan modulálják a csont homeosztázisát. Fontos, hogy az embereknek és az egereknek az Fcy-receptorok más-más repertoárral rendelkeznek, és az FcyRIV nem expresszálódik az emberi sejtekben. Ezért az IVIG emberi sejtekben kifejtett hatásáért felelős receptorok továbbra is megfoghatatlanok.
ANYAGOK ÉS METÓDUSOK
Egerek és a csontfenotípus elemzése
Hat hetes C57BL/6 nőstényt vásároltak a The Jackson Laboratory-tól (Bar Harbor, ME). Valamennyi állatkísérletet a Speciális Sebészeti Kórház IACUC hagyta jóvá. Valamennyi állatot véletlenszerűen osztottunk kísérleti csoportokba. A gyulladásos osteolysis kísérleteihez bevett egérmodellt, a TNF által kiváltott supracalvarialis osteolysis modellt (Kitaura és mtsai, 2005) alkalmaztunk kisebb módosításokkal. Röviden, a TNF-et naponta adtuk be az ábrákon feltüntetett dózisokban az egerek calvarialis periosteumához négy-öt egymást követő napon keresztül. Ezután az egereket feláldoztuk a kalvariális csontok szelvényezés céljából történő gyűjtésére. A hisztopatológiai értékeléshez az egereket eutanizáltuk, a calvarialis csontokat összegyűjtöttük és 4% paraformaldehidben rögzítettük 2 napig. Ezeket a mintákat ezután 10% semleges pufferolt EDTA-val (Sigma-Aldrich) meszesítettük és paraffinba ágyazottuk. Az oszteoklasztogenezis és a csontfelszívódás értékeléséhez a metszeteket TRAP-val (tartarátrezisztens savfoszfatáz) és hematoxilinnal festettük az oszteoklaszt vizualizálásához, és a hisztomorfometrikus elemzést a BioQuant képanalízis rendszerrel (Nashville, TN, USA) végeztük standard eljárásokkal (Parfitt et al ., 1987). Az oszteoklasztokat TRAP + sejtekként azonosították, amelyek többmagvúak voltak és szomszédosak a csontokkal.
Reagensek
A humán M-CSF-et és az sRANKL-t a Peprotech-től (Rocky Hill, NJ) szereztük be. A klinikailag használt Carimune NF ® IVIG készítményt a Cardinal Health-től (Dublin, OH) szereztük be. Az immunblotoláshoz használt antitestek a következők: NFATc1 (BD Pharmagen); p38 (Santa Cruz Biotechnology); B-lamin (Abcam); p65, p100/p52, p100/p50 és I-κBα (sejtjelzés).
Sejtkultúra
Osteoclast differenciálás
A humán CD14 + sejteket 20 ng/ml M-CSF-mel inkubáltuk egy napig OCP-k előállítása céljából. A humán osteoclastogenezis vizsgálatokhoz a sejteket 96 lyukú lemezekre adtuk három példányban, 5/104 sejt/lyuk oltási sűrűséggel. Az osteoclast prekurzorokat 20 ng/ml M-CSF-mel és 40 ng/ml humán oldható RANKL-vel inkubáltuk további 5 napon át 10% FBS-sel kiegészített a-MEM-ben. A citokineket 3 naponta töltjük fel. A 6. napon a sejteket rögzítettük és TRAP-ra festettük a savas foszfatáz leukocita diagnosztikai készlet (Sigma) alkalmazásával, a gyártó ajánlása szerint. A többmagos (több mint 3 mag) TRAP-pozitív oszteoklasztokat három kútban számoltuk.
A génexpresszió elemzése
Valós idejű PCR-hez DNS-mentes RNS-t nyertünk a QIAGEN RNeasy Mini Kit-jével, DNase-kezeléssel, és 1 µg össz-RNS-t reverz átírunk egy First Strand cDNS-szintézis készlet segítségével (Fermentas, Hanover, MD). A valós idejű PCR-t három példányban hajtottuk végre az iCycler iQ termikus ciklusos és detektáló rendszerrel (Applied Biosystems, Carlsbad, CA) a gyártó protokolljainak betartásával. A tesztelt gén expresszióját normalizáltuk a GAPDH szintjéhez viszonyítva. A vizsgálatban használt alapozók a következők: hA20 5’-CCGGCTGCGTGTATTTTGGGACTC-3 ’, 5’-GGAACCTGGACGCTGTGGGACTGA-3; hNFATc1 5’- ’CTTCTTCCAGTATTCCACCTAT-3’, 5’-TTGCCCTAATTACCTGTTGAAG-3 ’; hITGB3 5’-GGAAGAACGCGCCAGAGCAAAATG-3 ’5’-CCCCAAATCCCTCCCCACAAAAAC-3’; hCTSK 5’-CTCTTCCATTTCTTCCACGAT-3 ’, 5’-ACA CCA ACT CCC TTC CAA AG-3’; hBCL6 5’-CCTCGCCAGCCACAAGACCG-3 ’, 5’-CTGGCTCCGCAGGTTTCGCA-3’; hIRF8 5’-TGCGCTCCAAACTCATTCTCGTG-3 ’, 5’-GTCTGGCGGCGGCTCCTC-3’; hMAFB 5’-CTCAGCACTCCGTGTAGCTC-3 ’, 5’-GTAGTTGCTCGCCATCCAGT-3’; hFcγRIIa 5’-CATCACTGTCCAAGTGCCCA-3 ’, 5’-CCACAATGATCCCCATTGGT-3’; hGADPH 5’-ATCAAGAAGGTGGTGAAGCA-3 ’, 5’-GTCGCTGTTGAAGTCAGAGG-3’
RNS interferencia
0,2 nmol három rövid interferáló RNS (siRNS), kifejezetten humán FcγRIIa (L-014152-00-0005, Dharmacon), humán A20 (TNFAIP3: M-009919-99-0005, Dharmacon) vagy nem célzó kontroll siRNS ( Dharmacont) az elsődleges humán CD14 + monocitákba transzfektáltuk az Y-001 programozásra beállított Amaxa Nucleofector eszközzel a Human Monocyte Nucleofector kit (Amaxa) alkalmazásával, a korábban leírtak szerint (Park-Min et al., 2007).
Áramlási citometria
A különféle fehérjék sejtfelszíni expressziójának festését humán CD64, CD32 és CD16 elleni antitestek (BD Parmingen) alkalmazásával végeztük. FACSCalibur áramlási citométert használtunk CELLQuest szoftverrel (Becton Dickinson).
Statisztikai analízis
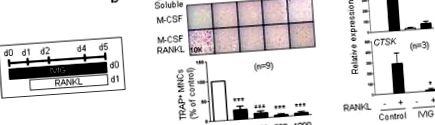
Az összes statisztikai elemzést a Graphpad Prism 5.0 szoftverrel hajtottuk végre, a kétfarkú, páros t-tesztet (két feltétel) vagy az egyirányú ANOVA-t Tukey post-t-tesztjével, több összehasonlítás céljából (több mint két feltétel). p 1a és b) ábra. Ennek megfelelően az IVIG gátolta az oszteoklaszt-specifikus génexpressziókat, mint például a CTSK (kódolja a katepszin K-t) és az ITGB3 (a p-3 integrint kódolja), amikor azt a RANKL-stimuláció előtt adták hozzá (1c. Ábra). Az általunk alkalmazott legnagyobb IVIG dózis (1 mg/ml) releváns a betegek terápiás dózisában (20 mg/testtömeg-kg), és teljesen gátolta az in vitro osteoclastogenesist. Az IVIG endotoxin-mentes, és megerősítettük azt is, hogy ez a szuppresszív hatás nem az LPS szennyeződéséből származik (1. kiegészítő ábra). Eredményeink azt mutatják, hogy az IVIG közvetlenül elnyomja az osteoclast prekurzor sejtek oszteoklaszt differenciálódását.
- Intravénás immunglobulin (IVIg) Mellékhatások, idő a munkára
- A kezdeti intravénás immunglobulin-dózist az elhízott betegek beállított testtömegén kell alapulnia
- Hogyan jár az aszalt szilva fogyasztása a haj, a csont és az emésztőrendszer egészségének
- Szakaszos csontleves böjt kezdőknek húsleves terv szerint
- Immun globulin intravénás mellékhatások Gyakori, súlyos, hosszú távú