Életmódbeli hatások a vérképzésre és az érelmeszesedésre
A rendszerbiológiai központból, Massachusetts General Hospital, Harvard Medical School, Boston.
A rendszerbiológiai központból, Massachusetts General Hospital, Harvard Medical School, Boston.
Absztrakt
Az érelmeszesedés kockázati tényezői
Az epidemiológiai vizsgálatok az ateroszklerózis számos rizikófaktorát azonosítják, beleértve az életkorot, a nemet, a magas vérnyomást, az alacsony sűrűségű lipoproteint és a nagy sűrűségű lipoprotein koleszterint, a triglicerideket, a dohányzást, a családtörténetet, az elhízást, a diabetes mellitust és a már meglévő krónikus gyulladásos betegségeket, például a reumatoid arthritis . 7,8 Ezek a kockázati tényezők prevalenciájukban és hatékonyságukban változnak, és gyakran súlyos ateroszklerózisban szenvedő betegeknél kombinálódnak, ami alátámasztja azt az elképzelést, hogy az érelmeszesedés egy multifaktoriális betegség. A kockázati tényezők feltételezett hatásmechanizmusainak azonosítása már eredményezett néhány sikeres terápiás stratégiát, különösen a sztatinokat és az antihipertenzív gyógyszereket, amelyek gátolják az érelmeszesedés progresszióját és csökkentik annak szövődményeit az alacsony sűrűségű lipoprotein koleszterinszint csökkentésével és a vérnyomás csökkentésével. Ezek a példák motiváló tervekként szolgálhatnak a stressz, az étrend, a fizikai aktivitás és az alvási szokások vizsgálatához, mint az immunitás, a vérképzés és végső soron a szív- és érrendszeri betegségek lehetséges módosítói.
A makrofágok szerepe az ateroszklerotikus plakkban
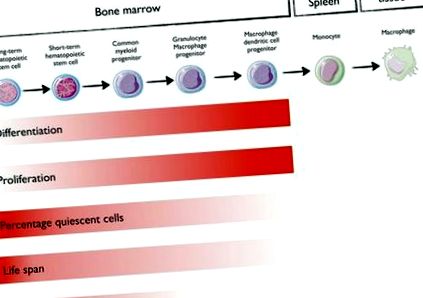
Macrophage Lineage
Bár a legfrissebb jelentések szerint a plakkok makrofágszerű sejtjei simaizom sejtekből is származhatnak, 13 az adatok nagy része azt az elképzelést támasztja alá, hogy a léziós makrofágok a csontvelőben és a lépben elhelyezkedő valódi hematopoietikus progenitorokból származnak. 4 A plakkos makrofágok élettartama meglehetősen rövid: bromodeoxiuridin-követési kísérletek 4 hónapos apolipoprotein E-hiányos (Apoe) -/- egerek szemléltetik, hogy a teljes plakk-makrofág populáció 1 hónapon belül megújul 14, következésképpen az újonnan termelt sejtekre támaszkodik. A betegség stádiumától függően a makrofág-termelés a keringésből származó monocita-toborzás és a helyi plakk-makrofág-proliferáció függvénye, 14 míg a csökkent toborzás, 15 a makrofág-halál és a plakkból való kilépés mellett valószínűleg hozzájárul az artéria falának alacsonyabb makrofág-számához. 2,16 Az alábbiakban a gyulladt érfal monocita- és makrofágellátását szabályozó tényezőkről ismerjük meg a jelenlegi ismereteket.
Csontvelő vérképződés
1.ábra. A hematopoietikus fa és a mieloid progenitorok tulajdonságai differenciálódásuk függvényében.
2. ábra. A vérképző fülke. A rajz olyan komponenseket ábrázol, amelyek közvetetten szabályozzák a hematopoietikus őssejtek aktivitását. Bal felső, Az egér csontvelőjének eredeti mikroszkópos képe, amely a csontvelő erek mentén haladó szimpatikus idegrostokat szemlélteti. Alsó, bal, Az ischaemiás stroke után az egér csontvelőjéből nyerhető, és replikáló hematopoietikus progenitor sejteket mutat (nyilak). Mindkét képet Courties és mtsai 83-ból adták át engedély alapján. A CXCL a C-x-c kemokin ligandumot jelöli; GM-CSF, granulocita makrofág kolóniastimuláló faktor; HSC, hematopoietikus őssejt; MSC, mesenchymális őssejt; VCAM, vaszkuláris sejtadhéziós fehérje; és VE, vaszkuláris endoteliális.
Annak ellenére, hogy egyre jobban megértjük a makrofágok jelentőségét az érelmeszesedésben és a vér monocita szintjének lenyűgöző korrelációját a szív- és érrendszeri mortalitással, 21,22-rel kevesebbet tudunk arról, hogyan változik a monocita termelés a szív- és érrendszeri betegségekben. Az érelmeszesedés során a monocitaszint fokozatosan, 23-an és még hirtelenebben növekszik akut miokardiális infarktus után, ami azt jelenti, hogy a myelopoiesis gyorsulása összefügg a betegség progressziójával. A károsodott koleszterin-kezelés 25 közvetlenül növeli a hematopoietikus progenitor aktivitást, és az ischaemiás szívbetegség sok csontvelő-szabályozási jelet megváltoztat, beleértve a gyulladásos molekulákat, például az interleukin (IL) -1β-t, a toll-szerű receptor ligandumokat és a kemokineket. Ezen túlmenően, a szívizominfarktus után megfigyelt megváltozott szimpatikus aktivitás 24 lényegesen megváltoztatja a hematopoietikus csontvelő rést. 26 Azt azonban csak most kezdjük megérteni, hogy a kardiovaszkuláris kockázati tényezők és az életmód miként befolyásolhatják a vérképző tevékenységet és a lokációt.
Splenikus monocita ellátás
Sok kérdés megválaszolatlan marad a lépből származó monociták és a neutrofilek jelentőségéről az általános mieloid válasz szempontjából. Nem világos például, hogy a lép monociták megegyeznek-e a csontvelőből származó társaikkal, vagy generatív aláírással rendelkeznek, amely differenciális funkcióval ruházza fel őket. A lép monociták gyulladásos (M1-szerű) plakk-makrofágok forrásai, vagy alternatív felbontású fenotípusú sejteket eredményeznek-e? Ezen elképzelések teszteléséhez gondos sorstérkép-tanulmányokra van szükség. Mivel a lép életre elengedhetetlen, csábító ezeket a kérdéseket lépmûeltávolítással kezelni. A műtéti eljárás azonban eltávolít egy szervet, amely azonban sok immunológiai folyamat szempontjából fontos. Például a lép eltávolításával a B-sejtek nagy mennyisége is megszűnik, amelyek létfontosságú szerepet játszanak a veleszületett és adaptív immunitásban, nem beszélve a makrofágokról, amelyekről ismert, hogy az öregedő eritrocitákat, és valószínűleg a monocitákat és a neutrofileket is megsemmisítik. Így a lép eltávolítása valószínűleg elfedi a szerv myeloid sejttermelésének valódi hozzájárulását.
Plakk makrofágok szaporodása
A vérképző fa mozgásban: A makrofágtermelés elmozdul a perifériára az ateroszklerózisban
3. ábra. A vérképző fa mozgásban. A rajzfilm bemutatja az életmódbeli tényezők hipotetikus hozzájárulását a makrofág-ellátás perifériás elmozdulásához és az ateroszklerózis progressziójához és szövődményéhez való társuláshoz. A HSPC vérképző ős- és progenitorsejtet jelöl.
Egészséges versus betegség-elősegítő életmód
Diéta/elhízás
Az étrend, az érelmeszesedés és a vérképzés közötti lehetséges összefüggésekkel foglalkozó másik vizsgálati terület a mikrobiomra összpontosít. Megtudjuk, hogy a bizonyos tápanyagokban gazdag étrend hajlamosítja az érelmeszesedést azáltal, hogy befolyásolja a bél bélflóráját. 71 Az allergiás légúti gyulladással kapcsolatos vizsgálatok kimutatták, hogy az étkezési rosttartalom megváltoztatja a bél és a tüdő mikrobiota összetételét, amely megváltoztatja a rövid láncú zsírsavak koncentrációját a vérben, megváltoztatva ezzel a csontvelőben a vérképzést. 72 Bár ezek az összefüggések még mindig gyérek, arra késztetnek bennünket, hogy az érelmeszesedés megértését irányítsuk át úgy, hogy az tartalmazzon speciális étrendi összetevőket, és mélyebben gondolkodjunk az étrend alapjain és azok betegségre gyakorolt hatásán.
Pszichoszociális stressz
Emberekben az akut és krónikus stressz expozíció növeli a vér leukocitáit, valószínűleg demarginációval és esetleg a megnövekedett sejttermeléssel is. 84 Ezenkívül a leukocita gyulladásos gén expresszióját a stressz szintje befolyásolja. 88 Csábító feltételezés, hogy a leukocytosis és a gyulladás stresszel összefüggő növekedése elősegíti az érelmeszesedés előrehaladását és szövődményeit, mivel a vér monocitózis előre jelzi a kardiovaszkuláris mortalitást. Ezt a hipotetikus betegségmechanizmust, különösen a csontvelő aktivitásával való összefüggést, tovább kell vizsgálni humán betegeknél.
Alvászavarok
Életünk legalább egyharmadánál alszunk vagy kellene aludnunk. Az alvás elengedhetetlen az élet számára; akut nélkülözése csökkenti az éberséget és a teljesítőképességet, rontja a memóriát és a megismerést, míg a krónikus alváshiány magas vérnyomással, szélütéssel, szívinfarktussal és szívelégtelenséggel jár. Az alváshiány számos oka a saját maga által elrendelt tagadástól kezdve a stresszel kapcsolatos álmatlanságig, alvási apnoéig és mentális betegségig terjed. Az alváshiány és a betegség közötti sok összefüggés ellenére még mindig keveset tudunk a mögöttes biológiáról és a betegségekkel való összefüggésekről. E megbeszélés fényében van-e bizonyíték arra, hogy az alvás hajlamosít a szívbetegségekre a vérképzés befolyásolásával?
Fizikai aktivitás és testmozgás
Hosszabb időtartam alatt az intenzív testmozgásról úgy gondolják, hogy elnyomja az immunitást egerekben és emberekben, bár a pontos mechanizmusok nem tisztázottak. 115 118 például 12 hetes aerob és rezisztencia edzés csökkentette az emberek keringő gyulladásos monocitáit. A testmozgás csökkentheti a keringő limfociták és a természetes gyilkos sejtek számát, 115 potenciálisan hozzájárulhat az immunszuppresszív hatásokhoz.
A rendszeres aerob testmozgás növeli a szisztémás vagális tónust. A megnövekedett vagus idegaktivitás immunszuppresszív, például a lépben lévő T-sejteknek és makrofágoknak történő jelzés révén. 123 Nem világos, hogy a vagális aktivitás befolyásolja-e a lép vérképződését, esetleg modulált makrofág-aktivitás révén. Ez ésszerű hipotézis, mivel a CD169 + makrofágok fontos szerepet játszanak a 124 hematopoietikus fülkében, és mivel a lépes makrofágok acetilkolin-receptorokat expresszálnak. Kísérletileg tesztelni kell azt a hipotézist, miszerint a testmozgással összefüggő vagális aktivitás növekedése csökkentheti a gyulladásos makrofágok aktiválódását, és ezáltal védőhatást gyakorolhat az érelmeszesedésre.
Következtetések
- Litotripszia - Előkészítés, eljárás, helyreállítás és mellékhatások Országos Vese Alapítvány
- Jóság egy tálban Miért a müzli erőteljes reggeli lehetőség Lifestyle News, The Indian Express
- JLA Journal of Lipid and Atherosclerosis
- Joey; s Rizs zabkása - Recept Laura Iz Anyaság életmód blog Naptime Joey-val
- HGH szteroid mellékhatások; Kockázatok a HGH szteroid használata után egy ciklusú PT részvény világ jövőjéhez