Fogyókúra és gyomor-bélrendszer bypass okozta fogyás
Keval Chandarana
1 Elhízáskutató Központ, Orvostudományi Tanszék, University College London, Rayne Institute, London, Egyesült Királyság.
Cigdem Gelegen
1 Elhízáskutató Központ, Orvostudományi Tanszék, University College London, Rayne Institute, London, Egyesült Királyság.
Efthimia Karra
1 Elhízáskutató Központ, Orvostudományi Tanszék, University College London, Rayne Institute, London, Egyesült Királyság.
Agharul I. Choudhury
2 Metabolikus jelzőcsoport, Medical Research Council Clinical Sciences Center, Imperial College, London, Egyesült Királyság.
Megan E. Drew
1 Elhízáskutató Központ, Orvostudományi Tanszék, University College London, Rayne Institute, London, Egyesült Királyság.
Veronique Fauveau
3 Institut Cochin, IFR Alfred Jost, Université Paris Descartes, Plate Forme de Microchirurgie, Faculté de Médecine Cochin, Párizs, Franciaország
Benoit Viollet
4 Institut Cochin, Université Paris Descartes, Párizs, Franciaország
5 INSERM, Párizs, Franciaország
6 Centre National de la Recherche Scientifique, UMR 8104, Párizs, Franciaország
Fabrizio Andreelli
4 Institut Cochin, Université Paris Descartes, Párizs, Franciaország
5 INSERM, Párizs, Franciaország
Dominic J. Withers
2 Metabolikus jelzőcsoport, Medical Research Council Clinical Sciences Center, Imperial College, London, Egyesült Királyság.
Rachel L. Batterham
1 Elhízáskutató Központ, Orvostudományi Tanszék, University College London, Rayne Institute, London, Egyesült Királyság.
Társított adatok
Absztrakt
CÉLKITŰZÉS
A bariatrikus műtét tartós fogyást okoz. A bélhormonok szerepet játszanak az elhízás patogenezisében, az étkezési kudarcban és a gasztrointesztinális bypass (GIBP) műtéti fogyás közvetítésében. Egerekben meghatároztuk a diéta által kiváltott elhízás (DIO), az azt követő diétázás és a GIBP műtétek hatását a ghrelinre, az YY peptidre (PYY) és a glukagon-szerű peptid-1-re (GLP-1). Hogy értékeljük a PYY szerepét a súlycsökkenés közvetítésében a GIBP után, vállaltunk GIBP műtétet PyyKO egerekben.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
A magas zsírtartalmú étrendbe vagy kontroll étrendbe randomizált hím C57BL/6 egereket 4 hetes időközönként leöltük. A DIO egereken 4 hétig átálltak az ad libitum alacsony zsírtartalmú étrendre (DIO-switch) vagy a kalória-korlátozásra (CR), mielőtt megölték őket. A PyyKO egerek és DIO vad típusú (WT) alomtársaik GIBP vagy ál műtéten estek át, és 10 nappal a műtét után megsemmisítették őket. Meghatároztuk az éhgyomri acil-ghrelin, az összes PYY, az aktív GLP-1 koncentrációkat, a gyomor ghrelin expresszióját, valamint a vastagbél Pyy és a glükagon expresszióját. Az éhomi és étkezés utáni PYY és GLP-1 koncentrációkat 30 nappal a műtét után értékeltük GIBP és színlelt páros táplálású (ál. PF) csoportokban.
EREDMÉNYEK
A DIO fokozatosan csökkentette a keringő éhomi acil-ghrelin, PYY és GLP-1 szintet. A CR és a DIO-switch súlycsökkenést okozott, de a keringő PYY-t nem sikerült a súlynak megfelelő szintre állítani. A GIBP után a WT egerek lefogytak és fokozott keringésben lévő éhomi PYY, valamint vastagbél Pyy és glükagon expressziót mutattak ki. Ezzel szemben a GIBP testtömegre gyakorolt akut hatása elveszett a PyyKO egerekben. Az éhomi PYY, valamint az étkezés utáni PYY és GLP-1 szintek növekedtek a GIBP egerekben, mint a színlelt.
KÖVETKEZTETÉSEK
A PYY kulcsfontosságú szerepet játszik a GIBP után megfigyelt korai súlycsökkenés közvetítésében, míg a fogyókúra alatti relatív PYY-hiány veszélyeztetheti a fogyás kísérleteit.
Az elhízás globális egészségügyi probléma, a nem sebészeti terápiák azonban továbbra is korlátozottak. A testtömeget olyan komplex fiziológiai rendszerek vezérlik, amelyekben a hormonok jelzik a test energiakészleteit és a tápanyagbevitelt az energiaháztartást szabályozó központi idegrendszeri utak felé. A bélhormonok fontos szerepet játszanak a testsúly szabályozásában (1), és részt vehetnek az elhízás patogenezisében (2–4). Az elhízás kialakulása és a megváltozott bélhormonok közötti időbeli kapcsolat azonban nem ismert.
Az étrend módosítása, például a makrotápanyagok összetételének megváltoztatása vagy a kalóriabevitel korlátozása, az első vonalbeli elhízási kezelések. A fogyás fenntartása azonban gyakran nehéz (5). A diéta által kiváltott kompenzatív bélhormon-változások diétás eszközökkel hozzájárulhatnak a fogyás kudarcához (6). A gasztrointesztinális bypass (GIBP) műtét hatékony elhízáskezelés, amely jelentősen csökkenti a morbiditást és a mortalitást (7). Bár a GIBP súlycsökkentő hatásainak hátterében álló mechanizmusok továbbra sem ismertek, az ezen eljárások által kiváltott bélhormonok változásai okozati szerepet játszhatnak (8,9). Az elhízás, az étkezési kudarc és a GIBP súlycsökkenés patogenezisében szerepet játszó két hormon az orexigén acil-ghrelin hormon és az YY (PYY) anorektikus hormon peptid (8,9). A ghrelint főleg a gyomor termeli; a keringési szintek az éhezés során növekednek, és étkezés után csökkennek (6). A ghrelin O-acil-transzferáz (GOAT; mBOAT4) enzimmel történő acilezése elengedhetetlen a ghrelin biológiai aktivitásához (10,11). Az étrend okozta súlycsökkenés növeli a keringő grelint, ami veszélyeztetheti a fogyás fenntartását (12). A GIBP hatása a keringő ghrelin-koncentrációkra ellentmondásos, néhány tanulmány a jelentős súlycsökkenés ellenére alacsony szintről számolt be (9,13,14).
A PYY csonka formája, a PYY3–36, anorektikus hormon (1). A PYY-t elsősorban a distalis gyomor-bél traktusban található enteroendokrin l-sejtek termelik. A keringő PYY3–36 koncentrációk étkezés után növekednek, és az étkezések közötti időszakban magasak maradnak (15). A plazma PYY szintje csökken az elhízásban (3). Az elhízott alanyok azonban a leptintől eltérően továbbra is reagálnak az exogén PYY3–36 anorektikus hatásaira (2). Az egérgenetikai vizsgálatok a PYY-t is bevonják a testtömeg szabályozásába: A PyyKO egerek hiperfágiak és elhízottak (3), míg a Pyy túlzottan expresszáló egerek védettek az étrend okozta és genetikai elhízás kialakulása ellen (16 Bár az elhízás kialakulása a keringő PYY csökkenését eredményezi (3,4), a későbbi étrend által kiváltott fogyás hatásai nem egyértelműek (17–19). Beszámoltak arról, hogy a GIBP műtét növeli az éhgyomri és a tápanyagokkal stimulált keringő PYY koncentrációt (20,21). A bél l-sejtjei szintetizálják az inkretin hormon glükagonszerű peptid-1-et (GLP-1) (1) is. Az elhízás és a fogyás fogyókúrával gyakorolt hatása a keringő GLP-1 szintre nem egyértelmű, változó eredményekről számoltak be. Ezzel szemben a vizsgálatok többsége arról számol be, hogy a keringő tápanyagokkal stimulált GLP-1 szintek megemelkednek a GIBP után (8).
A magas zsírtartalmú étrenddel (HFD) táplált rágcsálók zsírtartalmukban és kalóriasűrűségében analógak a nyugati étrenddel, a közös emberi elhízás állatmodelljét képviselik (22). Így megvizsgáltuk a ghrelin, a PYY és a GLP-1 időbeli változását, valamint azokat a változásokat, amelyek a diéta által kiváltott elhízás (DIO) kialakulásával következtek be egerekben HFD-re reagálva. Ezután értékeltük az étrend módosításával és a GIBP műtéttel kiváltott súlycsökkenés ghrelinre, PYY-re és GLP-1-re gyakorolt hatását. Hogy meghatározzuk a PYY szerepét a GIBP után észlelt korai fogyás közvetítésében, vállaltuk a GIBP-t PyyKO egerekben.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
Az egereket 12 órán át tartó világos/sötét cikluson (0700–1900 óra) tartottuk állandó hőmérsékleten, és specifikus kórokozóktól mentes létesítményekben helyeztük el őket. Minden vizsgálatot az Egyesült Királyságban a Home Office Animal Procedures Act (1986) törvénynek, valamint a laboratóriumi állatok védelméről szóló európai egyezményben meghatározott elveknek és irányelveknek megfelelően végeztünk. Hat hetes C57BL/6 hím egereket a Charles River U.K. Ltd.-től (Margate, Egyesült Királyság) vásároltak. PyyKO egereket és alomtárs kontroll egereket hozunk létre C57BL/6 háttérrel, és genotipizáljuk a korábban leírtak szerint (3). A HFD-t (D12451) és az alacsony zsírtartalmú étrendet (LFD) (kontroll étrend) (D12450B) a Research Diets-től (New Brunswick, NJ) szereztük be. Az étrendi összetételt az 1. kiegészítő táblázat tartalmazza.
1. vizsgálat: a ghrelin, a PYY és a GLP-1 időbeli változásainak vizsgálata HFD által kiváltott elhízással.
A 88 hetes C57BL/6 hím egereket randomizálták ad libitum HFD-re vagy kontroll étrendre (n = 40 csoportonként). A testtömeget hetente ellenőriztük. Minden étrendcsoportból tíz egeret öltek meg 16 órás éjszakai böjt után 4, 8, 12 és 16 hetes étrendi expozíció után. Az éheztetett vért és szöveteket a később leírtak szerint gyűjtöttük be.
2. vizsgálat: Az étrendi módosítás hatásának vizsgálata a ghrelinre, a PYY-re és a GLP-1-re DIO egerekben.
A 48 hetes hím C57BL/6 egereket randomizálták ad libitum HFD-re (n = 30) vagy LFD-re (n = 10). 16 hét elteltével a HFD csoportot 4 héten keresztül két különféle táplálkozási csoport egyikébe randomizálták: folytatták az ad libitum HFD-t (DIO) (n = 10), vagy átálltak ad libitum kontroll étrendre (n = 20). Miután 1 hétre átálltunk a kontroll étrendre, az egereket ezután tovább randomizáltuk vagy diéta/kalória korlátozásra (CR), vagy az ad libitum kontroll étrend folytatására (DIO-kapcsoló) (n = 10). A CR-t lépcsőzetes kezeléssel hajtottuk végre (23). Az egereket egy éjszakai 16 órás böjt után leöltük, és vért és szöveteket gyűjtöttünk össze.
3. tanulmány: A GIBP műtétnek a ghrelinre, a PYY-re és a GLP-1-re gyakorolt hatásainak értékelése és az endogén PYY szerepe a fogyás közvetítésében.
Hím PyyKO egereket (n = 30) és vad típusú (WT) alomtársaikat (n = 30) 3 hetes korban választottunk el. A PyyKO egerek nagyobb súlyt kapnak a kontroll étrenden és a HFD-n, mint a WT alomtársak (3). Így a súly-egyeztetés lehetővé tétele érdekében a HFD-n 6 hetes WT egereket kezdtek el, és a PyyKO egerek 14 hetes korukig folytatták a kontroll étrendet, amikor HFD-re váltottak. 24 hetes korukban minden csoportból 16 súly-egyeztetett egeret szállítottak olyan létesítményekbe, ahol a műtétet el kellett végezni. Az egereket 1 hétig akklimatizálták a randomizálás előtt bypass vagy ál műtét előtt (n = 8).
Az egereket éjszakán át 16 órán át éheztettük műtét előtt. A GIBP-csoport entero-gasztro-anasztomózison (EGA) ment keresztül, amint azt korábban az izoflurán-érzéstelenítésben leírták (24). Röviden: középvonalas laparotómiát hajtottunk végre, és a pylorus záróizomot ligáltuk, majd egy EGA-t követtünk a jejunum közepe és a gyomor fundus között, kivéve a duodenumot és a proximális jejunumot a tápanyagáramlásból (1. kiegészítő ábra). A színlelt műtéteket azonos módon altatták, közepes metszést végeztek, a gyomrot és a beleket kitették és manipulálták. A bemetszést olyan ideig nyitva tartották, amely megfelel az EGA műtétének. Két egér elhunyt műtét után, egy WT színlelt és egy PyyKO megkerülés, így hét WT álműködtetett (WT.S), nyolc WT bypass (WT.BP), nyolc PyyKO álműködtetett (PyyKO.S) és hét PyyKO bypass ( PyyKO.BP). Az egereket naponta ellenőriztük az általános jólét szempontjából, és 10 nappal az operáció után megöltük egy éjszakai 16 órás böjt után. Vért és szövetet gyűjtöttünk. A pyloros ligációt ellenőriztük és sértetlen volt minden EGA-állatban.
4. vizsgálat: A GIBP és a páros etetés által kiváltott súlyvesztés éhomi és étkezés utáni GLP-1 és PYY hatásainak értékelése.
A 8 hetes hím C57Bl6 egereket 3 hónapig ad libitum HFD-vel etették. A súly-egyeztetett csoportokat ezután randomizálták vagy EGA-ba, vagy ál-pár-táplálékba (ál-PP) (n = 5). Műtét után az egérenkénti napi táplálékfelvételt monitoroztuk az EGA csoportban, és a páros táplálású csoport ugyanannyi HFD ételt (ál-PP) kapott. Harminc nappal a műtét után az egereket egy éjszakán át éheztettük, és farokvérzést vettünk. Az EGA csoportot 90 percig újratápláltuk, és kiszámítottuk az elfogyasztott élelmiszer mennyiségét (0,3 ± 0,1 g). Az étkezés utáni farok vérzése történt. Az ál-PF csoportot 90 perc alatt ugyanannyi élelmiszerrel etették újra, és étkezés utáni farokvérzést vettek. Az éheztetett és táplált plazma aktív GLP-1-et és az összes PYY-koncentrációt meghatároztuk.
Terminális eljárások és szövetszedés.
Az 1–3. Vizsgálatban szereplő egereket végső érzéstelenítéssel leöltük. A vért szívpunkcióval vették össze, és a korábban leírtak szerint dolgozták fel (15). A gyomor-bél traktust boncolták; az egész gyomrot és a leszálló vastagbél 3 cm-es szakaszát gyorsan eltávolítottuk, megtisztítottuk a hashártyától, a zsírtól és az emésztőrendszer tartalmától, folyékony nitrogénben lefagyasztottuk és -80 ° C-on tároltuk az elemzésig.
A génexpresszió kvantitatív PCR elemzése.
Az összes RNS-t TRIzol-reagenssel extraháltuk, és 2 μg RNS-t reverz átírással cDNS-be. A valós idejű kvantitatív PCR-t az előzőekben leírtak szerint hajtottuk végre, a Taqman Gene Expression Assay FAM/TAMRA szondákkal (Applied Biosystems, Warrington, Egyesült Királyság) (3).
Hormonvizsgálatok.
Minden mintát két példányban futtattunk. A vizsgálatok közötti variáció csökkentése érdekében az 1. és a 2. vizsgálat összes mintáját egy vizsgálatban futtattuk, csakúgy, mint a 3. és a 4. vizsgálat összes mintáját. Az 1-3. A plazma leptin és az aktív GLP-1 koncentrációkat a kereskedelemben kapható ELISA készletekkel (Millipore, Watford, Egyesült Királyság) mértük. A rágcsálókra vonatkozóan nincsenek specifikus PYY3–36 vizsgálatok; így megmértük a teljes PYY értéket. A plazma-acil-ghrelin és az összes PYY-koncentrációt kereskedelmi forgalomban kapható radioimmun-vizsgálattal (Millipore, Watford, Egyesült Királyság) mértük (2. kiegészítő táblázat a vizsgálat további részleteihez).
Statisztikai analízis.
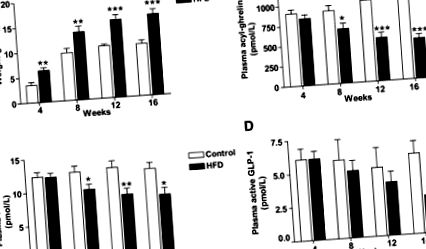
Az adatokat átlag ± SEM formában mutatjuk be. A csoportok közötti összehasonlításokat egyirányú ANOVA-val, Dunnett post hoc tesztekkel vagy adott esetben Student t teszttel végeztük. Valamennyi statisztikai elemzéshez P 1A ábra, 1. táblázat). A HFD egereknél a várható éhomi hiperleptinémia mutatkozott (1. táblázat). Az éhgyomorra keringő acil-ghrelin szintek idővel stabilak maradtak a kontroll-diétás egerekben, míg az éhgyomorra keringő acil-ghrelin fokozatosan csökkent a HFD egerekben (1B. Ábra). A testtömeg és az acil-ghrelin között negatív összefüggést figyeltünk meg minden vizsgált időpontban (2A – D. Kiegészítő ábra). A DIO egerekben (26–28) a gyomor ghrelin mRNS expressziójának csökkenésével kapcsolatos jelentésekkel ellentétben az éhgyomri gyomor ghrelin expresszióban nem figyeltünk meg különbségeket a kontroll és a HFD csoportok között (1. táblázat). A 4 hetes időpontban fordított összefüggés mutatkozott a gyomor ghrelin és a testtömeg között (r = −0,43, P = 0,06). Nem figyeltünk meg különbséget a gyomor Mboat4 expressziójában a HFD és a kontroll csoport között (1. táblázat). A testtömeg és a gyomor Mboat4 expressziójának korrelációanalízise fordított összefüggést mutatott ki a 4 hetes (r = −0,48, P = 0,03; Kiegészítő 2E. Ábra) és a 8 hetes időpontokban (r = −0,49, P = 0,03; Kiegészítő) 2F ábra). Hasonlóképpen, 12 hét elteltével a negatív korreláció irányába mutató tendencia figyelhető meg (r = −0,39, P = 0,09), de 16 hét után nem volt összefüggés (r = 0,02, P = 0,93). Nem találtunk kapcsolatot a plazma acil-ghrelin és a gyomor Mboat4 expressziója, illetve az acil-ghrelin és a gyomor ghrelin expressziója között.
2. vizsgálat: Az étrendi módosítás hatásának vizsgálata a ghrelinre, a PYY-re és a GLP-1-re DIO egerekben.
Az étrend módosítása, a DIO-kapcsoló vagy a CR csökkentette a testsúlyt, míg a DIO és a kontroll egereknél a súly stabil maradt (Kiegészítő 4A. Ábra). 4 hetes étrendi beavatkozás után a kontroll és a DIO-switch egerek testtömege hasonló volt, és a CR egerek súlya lényegesen kisebb volt (2A. Ábra). Az éhomi leptinszintek tükrözték a testtömeget: a legnagyobb a DIO csoportban, a legalacsonyabb a CR csoportban, és hasonló a kontroll és a DIO-switch egerekben (2B. Ábra).
Az étrend módosításának hatása a testsúlyra, a leptin, az acil-ghrelin éhomi koncentrációira, a teljes PYY, az aktív GLP-1 és az Mboat4 gyomor expressziójára. A DIO egereket három csoportba randomizálták, folytatták a HFD-t (DIO), átálltak a kontroll étrendre (Switch) vagy a kalória-korlátozásra (CR) 4 hétig, majd egy éjszakai böjt után megölték. A testtömeg (A), a plazma leptin (B), a plazma acil-ghrelin (C), a gyomor Mboat4 expressziója (D), a plazma teljes PYY (E) és a plazma aktív GLP-1 (F) értékek voltak. Az adatokat átlag ± SE-ként fejezzük ki. n = 10. ** P 2C ábra). A DIO-switch egerek éhomi acil-ghrelin koncentrációja közepes volt a kontroll és a DIO csoportban megfigyeltek között. Az éhomi acil-ghrelin koncentrációk a CR csoportban összehasonlíthatók voltak a kontroll csoportéval annak ellenére, hogy a CR egerek 21,3 ± 2,0% -kal kevesebbek voltak, mint a kontroll egerek. Kiértékeltük a testtömeg és a plazma acil-ghrelin kapcsolatát, és negatív összefüggést találtunk (r = −0,46, P = 0,003; Kiegészítő 4B. Ábra). A HFD vagy az étrendi módosítás hatása a gyomor ghrelin expressziójára nem volt látható (ghrelin expresszió: kontroll = 1,00 ± 0,08 tetszőleges egység [AU], DIO = 0,94 ± 0,06 AU, DIO-switch = 0,94 ± 0,06 AU és CR = 0,91 ± 0,08 AU). A gyomor Mboat4 expressziója azonban csökkent a DIO-ban a kontroll-diéta egerekhez képest (P = 0,02, 2D. Ábra). A korrelációs elemzések nem mutattak kapcsolatot a gyomor ghrelin, az Mboat4 és a keringő acil-ghrelin között (az adatokat nem közöljük).
A DIO egereknek csökkent a keringő teljes PYY és az aktív GLP-1 koncentrációja a kontroll egerekhez képest (2E és F ábra). Az éhezés teljes PYY és aktív GLP-1 szintje általában növekedett az étrend-módosításnak alávetett DIO egerekben (DIO-switch és CR), de nem érte el a szignifikanciát a DIO egerekhez képest (2E és F ábra). A CR egerek éhgyomorra keringő teljes PYY és aktív GLP-1 szintje hasonló volt a kontroll egereknél megfigyeltekhez, annak ellenére, hogy súlyuk lényegesen kisebb volt. A vastagbél Pyy és a glükagon expressziója minden csoportban hasonló volt (3. kiegészítő táblázat).
- Grapefruit diéta fogyás esetén kövesse ezt a szigorú 10 napos alacsony szénhidráttartalmú étrend NDTV ételt
- Fogyókúrás tabletták, főtt érett útifű jó fogyókúrás keto fejlett fogyókúrás tabletták eredményei &
- Fogyókúrás tabletták, vényköteles fogyókúra, étvágycsökkentők
- Fogyókúrás diétaprogramok étrendje LloydsPharmacy
- Étrend-terv gyorsan fogyni Nápoly fogyás karcsú most MD