Gyomor véráramlás
A gyomor véráramlása fontos szerepet játszik a gyomor normális fiziológiai funkcióinak fenntartásában, és segít megvédeni a gyomor nyálkahártyáját a fekélyképződés ellen.
Kapcsolódó kifejezések:
- Epinefrin
- Hisztamin
- Szekréció (folyamat)
- Mucosa
- Epidermális növekedési faktor
- Szenzoros ideg
- Immobilizációs stressz
- Gyomorsav-szekréció
- Gyomor nyálkahártya
Letöltés PDF formátumban
Erről az oldalról
Forgalom, áttekintés
D. Neil Granger, Peter R. Kvietys, a Gasztroenterológiai Enciklopédia, 2004
Bevezetés
A gyomor véráramlása fontos szerepet játszik a gyomor normális fiziológiai funkcióinak fenntartásában, és segít megvédeni a gyomor nyálkahártyáját a fekélyképződés ellen. A belső szabályozó mechanizmusok biztosítják a véráramlás beállítását, hogy megfeleljen a gyomorszekréció és a mozgékonyság energiaigényes folyamatainak. A gyomor véráramlása szintén segít a gát fenntartásában a lumenális sav visszadiffúziója ellen, megakadályozva ezzel a nyálkahártya károsodását és fekélyképződését. A gyomor véráramlásának sérülése a nyálkahártyát sebezhetővé teszi a gyomornedv, valamint a bevitt szerek, például etanol, aszpirin és baktériumok (pl. Helicobacter pylori) káros hatásainak.
Az intraabdominális nyomás monitorozása
Guillaume L. Hoareau DrVet, DACVECC, Matthew S. Mellema DVM, PhD, DACVECC, a kisállatok kritikus gondozásának orvoslásában (második kiadás), 2015
Visceralis hatások
A gasztrointesztinális véráramlás idegi szabályozása
29.4.1.1 Az idegstimuláció hatásai
A neurogén vazokonstrikció a splanchnikus keringésben kizárólag a szimpatikus vazokonstriktor rostok aktiválásából származik. 19 A gyomor felé vezető szimpatikus utak elektromos stimulálása csökkenti a gyomor teljes véráramlását, a véráramlást a cöliákia és a gasztroepiploicus artériákban, valamint a véráramlást a gyomor nyálkahártyájában, ez utóbbi jelentősen csökken, mint a gyomor teljes vérárama. 4,7 A vékonybél és a vastagbél véráramlását hasonlóan csökkenti a szimpatikus idegstimuláció. Ennek oka a mesenterialis artériák és az intramuralis erek összehúzódása, különösen a GI falán belüli submucosalis arteriolák. 4,19,85 Az artériás rendszer ellenállásának emelésén kívül a szimpatikus idegstimuláció a GI traktus nagyobb vénáit is összehúzza, ezáltal csökkentve a splanchnicus érekben lévő vér térfogatát. 14,85
A GI véráramlásának csökkenése 1-3 perc hosszan tartó szimpatikus idegstimuláció után csökken, hogy új egyensúlyi szintet érjen el. Ezt a jelenséget „autoregulációs menekülésnek” nevezik. 86–88 A stimuláció leállításakor az áramlás a stimuláció előtt regisztráltnál magasabb szintre emelkedhet, ezt a folyamatot idegstimuláció utáni hiperémiának nevezik. 89 A submucosalis arteriolák szimpatikus összehúzódása elől a patkány gyomor submucosa-ban való megszökés nem az arteriovenózus shuntek megnyitásából fakad, hanem az eredetileg összehúzódott erek relaxációjából ered. 86 További tanulmányok azt mutatták, hogy az autoregulációs szökés a gyomorban 90 és a belekben, 88, valamint az idegstimuláció utáni hiperémia, 89 aktív folyamat, amely érzékszervi értágító idegeket foglal magában.
Ghrelin és stresszvédelem
A stressz okozta gyomorfekélyek patogenezise
A GI traktus érrendszeri rendellenességei
Portál hipertóniás gasztropátia
A portál hipertenzív gasztropátia a cirrhosishoz kapcsolódó portális hipertóniában szenvedő betegek legfeljebb 90% -ában fordul elő, és endoszkóposan mozaik nyálkahártya-minta jelenléte jellemzi petechialis vérzéssel vagy anélkül, általában a proximális gyomorban. Cirrhosis nélküli betegeknél portál hipertenzív gastropathia is előfordulhat. Általában portális hipertóniában szenvedő betegeknél fedezik fel, akiket a varicealis vérzés szempontjából vizsgálnak. A portál hipertóniás duodenopathiát a portál hipertóniás betegek 51% -ánál írták le, és ez nem gyakori oka az okkult GI vérzésnek. Az endoszkópos jellemzők közé tartozik az erythema, az erózió, a fekély, a telangiectase és a duodenum varicus. 31
A megváltozott gyomor véráramlás szerepet játszik a portál hipertenzív gasztropátia patogenezisében. Egyéb feltételezett mechanizmusok közé tartozik a nitrogén-oxid termelés, a tumor nekrózis faktor-α szintézise és a prosztaglandin gátlásra való érzékenység. 32
A portál hipertenzív gasztropátia leggyakrabban a gyomor fundusában és testében fordul elő. A szövettani jellemzők között szerepel számos ektatikus kapilláris és venula jelenléte az egyébként normális nyálkahártyában és submucosában. A fibrin trombusok, a gyulladás, a nyálkahártya fibrózis és a fibrohyalinosis nem a 33–35 portális hipertenzív gastropathia szövettani elemei (10-7A. Ábra). Nincs összefüggés atrófiás gyomorhurut, CREST szindróma (calcinosis, Raynaud-jelenség, nyelőcső érintettség, sclerodactyly és telangiectases) vagy csontvelő transzplantációval (10-3. Táblázat). A portál hipertenzív duodenopathia általában a gasztropátiával társulva fordul elő, és a kapilláris torlódás, a kapilláris angiogenezis és az ödéma jellemzi a nyombél nyálkahártyájában (lásd 10-7B-D. Ábra), de csak minimális gyulladással. 31
A portális hipertóniás gastropathiából származó vérzés általában krónikus, és gyakran kontrollálható a beteg portális hipertóniájának kiváltó okának orvosi vagy műtéti kezelésével.
A felső gyomor-bél traktus
A gyomor volvulusa
A gyomor volvulusa viszonylag ritka állapot, amely leggyakrabban 50 éves kor után fordul elő, és fejlődéséhez a gyomorszalagok lazítását igényli. A gyomor volvulusa felelős lehet a krónikus hasi tünetekért, vagy megnyilvánulhat fojtással és gangrénával.
A gyomor volvulusát annak a tengelynek megfelelően osztályozzuk, amely körül a gyomor forog: a kardiót és a pylorust összekötő vonal által képzett hosszanti tengely körüli torziót organoaxiális volvulusnak nevezzük; a kisebb és nagyobb görbületek közepén áthaladó függőleges tengely körüli elfordulást mesenteroaxiális volvulusnak nevezzük. Az érintett betegek megközelítőleg 60% -ának organoaxiális, 30% -ának mesenteroaxiális típusa, 10% -ának pedig kombinációs formája van. A forgatás lehet részleges vagy teljes; a teljes fordulatok gyakran súlyosan rontják a gyomor véráramlását és gangrént okozhatnak, míg a részleges fordulatok tünetmentesek lehetnek vagy felelősek a krónikus tünetekért.
Az organoaxiális volvulusnak általában akut megjelenése van, és gyakran társul egy nagy paraesophagealis hiatus sérv jelenlétével vagy a rekeszizom bekövetkezésével. A betegek panaszkodnak a felső hasi vagy az alsó mellkasi fájdalom hirtelen megjelenéséről. A hányás utat enged a retchingnek, és nehéz átjutni a nasogastricus csövön a gasztro -ophagealis csatlakozáson túl. A tünetek és jelek ezen csoportját a Borchardt-triádnak nevezték. A röntgenogrammák gázzal töltött viszkust mutathatnak ki a mellkasban vagy „fejjel lefelé fekvő gyomrot” a has felső részében (76–14. Ábra). A gangrén az esetek körülbelül 5% -ában következik be, főleg traumás rekeszizom-sérvben szenvedőknél. Az organoaxiális volvulus általában műtéti korrekciót igényel.
A mesenteroaxiális volvulus gyakran szakaszos és hiányos. Az érintett személyek krónikus étkezés utáni fájdalomról, böfögésről, puffadásról, hányásról és korai jóllakottságról panaszkodnak; a fojtás ritka. A diagnózist bárium-röntgenogrammal végezzük. A nasogastricus csővel történő dekompresszió visszaállíthatja a gyomrot normális helyzetébe. A műtét tartós tünetek esetén javallt. Néhány beteget sikeresen kezeltek a gyomor rögzítésével két perkután endoszkópos gastrostomia csővel; ezeket eltávolítják, miután az összenövések rögzítik a gyomrot az elülső hasfalhoz.
Az orvosbiológiai kutatás kortárs vonatkozásai
A C H2S megakadályozza az NSAID-ok okozta fekélyképződést és elősegíti a fekélygyógyulást
A gyomor nyálkahártyája H2S-t is termelhet, amely hozzájárulhat a luminális anyagokkal szembeni védekezéséhez. Különböző NSAID-okat (aszpirin, indometacin, ketoprofen vagy diklofenak), NaHS-t vagy NSAID és NaHS kombinációját kapó patkányokat értékelték a gyomorkárosodás, a H2S-szintetizáló enzimekre gyakorolt hatások, a gyomor véráramlása és a szövetkárosodás szempontjából releváns egyéb paraméterek szempontjából ( Fiorucci és mtsai., 2005). A NaHS szignifikánsan gátolta a gyomor nyálkahártya károsodását, a TNF-α, az ICAM-1 és a limfocita funkcióval összefüggő antigén-1 mRNS felpörgetését, amelyet aszpirin indukált. A NaHS megakadályozta a gyomornyálkahártya véráramlásának csökkenését és csökkentette az ASA által kiváltott leukocita tapadást a mesenterialis venulákban. Ez azonban nem változtatta meg a PGE2 szintézis NSAID-ok általi szuppresszióját. A glibenklamid (KATP csatorna antagonista) és a d, l-propargilglicin (CSE gátló) súlyosbította, míg a pinacidil (KATP csatorna agonista) gyengítette az ASA okozta gyomorsérülést. Az NSAID-eknek való kitettség csökkentette a H2S képződését, valamint a CSE mRNS és fehérje expresszióját (Fiorucci et al., 2005). Ezek az eredmények arra utalnak, hogy a nyálkahártya H2S szintézisének elnyomása a COX aktivitás gátlásán túl egy másik mechanizmust is jelenthet, amelyen keresztül az NSAID-k GI károsodást okoznak (Wallace, 2007a).
Nitritek és nitrátok
Elérhetőség, felszívódás és anyagcsere
Az étrendből bevitt nitrát gyorsan felszívódik a vékonybélben, összekeveredik az NO oxidációjából származó endogén nitráttal, és könnyen eloszlik a testben. Az orális nitrátterhelés körülbelül 25% -át koncentrálják és választják ki a nyálmirigyek, így a nyál-nitrát-koncentráció körülbelül 10-szer magasabb, mint a plazma-nitrát. A nyál-nitrát körülbelül 20% -át redukálják a szájban nitritté a fakultatív anaerob baktériumok, amelyek a nyelv felszínén találhatók, ami az összes elfogyasztott nitrát körülbelül 5% -os csökkenését eredményezi nitritté. A nyálban lenyelt nitrit aránytalanul növekszik az NO képződésével (nitrit pKa
A nitritnek és a nitrátnak számos funkciója van a bőrben, ideértve a gyulladás közvetítését és az antimikrobiális védekezést, a sebgyógyulást, a keratinocita homeosztázis szabályozását és az ultraibolya (UV) sugárzást követő NO-anyagcseréjük révén történő apoptózis szabályozását. A bőrön jelen lévő nitrát, nitrit vagy nitrozotiolok addig stabilak, amíg az UV-hatással NO-t nem szabadít fel. Ez részben megmagyarázhatja a mérsékelt napfény-kitettség egészségügyi előnyeit. A verejtékben található nitrát és nitrit nagyon fontos a NO termelésében. A nitrit és a nitrát koncentrációját a testünkön és testünkön ezen anionok étrendi bevitele, valamint az NO oxidációjából és denitrifikáló baktériumok jelenlétéből származó endogén termelés szabályozza.
Kórélettani következmények
A GCRP szerepe a gasztrointesztinális védelemben
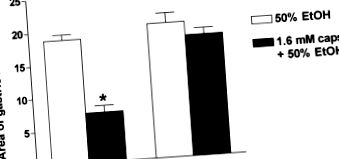
A hCGRP8–37 szisztémás beadása fokozza az indometacin vagy etanol által kiváltott nyálkahártya elváltozásokat, míg a kapszaicin és/vagy a TRPV-1 agonisták alacsony dózisa egyértelműen kimutatta, hogy az érzékszervek stimulálásával és a CGRP 18 helyi felszabadulásával gyomorvédelmet fejtenek ki, ami azt jelzi, hogy az endogén CGRP trofikus szerepet játszik a gyomor nyálkahártya-védelmében. Ezenkívül a kapszaicin általi gasztroprotektálást dózisfüggően antagonizálták a CGRP antagonista, a hCGRP8–37 és a CGRP elleni monoklonális antitestek. 7 A CGRP-knockout egerek alkalmazásával végzett legújabb vizsgálatok 24 erősen megerősítették ezeket a megállapításokat: a kapszaicin védőhatása az etanol által kiváltott elváltozások ellen teljesen megszűnt a CGRP -/- egerekben (3. ábra). A szerzők azt is kimutatták, hogy a gyomor korábbi enyhe irritáló hatásának indukálta adaptív gyomorvédelmet az okozta, hogy a CGRP teljesen hiányzott a CGRP knockout egerekből. 24.
3. ÁBRA A kapszaicin (sapkák) által kiváltott gyomornyálkahártya-védelem hiánya az egerek 50% -os etanol-indukálta elváltozásai ellen a CGRP-re kopogtatva (CGRP -/-). 5–6 egér átlagos ± S.E értéke csoportonként. ∗ P 24 .
Ezenkívül számos tanulmány beszámolt a szövet CGRP-LI kimerüléséről több gyomorfekély kialakulása során. 7 A gyomor CGRP-LI szintjének csökkenését figyelték meg ecetsav-, ciszteamin-, tömény etanol- vagy vízimmerziós stressz fekélyek után, míg a fekélyesek nem befolyásolták más peptidek szövettartalmát 7, ami arra utal, hogy a gyomor CGRP-LI csökken nem tulajdonítható csak a szövet károsodásának. Emberekben a TRPV-1 receptort és a CGRP-t immunhisztokémiai módszerekkel detektálták különböző gyomorbetegségben szenvedő betegeknél. A 6,31 és a TRPV-1 jelölést immunhisztokémiai, in situ hibridizációs és Western módszerekkel lokalizálták a gyomor parietális sejtjeiben. blot elemzés. 10 Ezenkívül egészséges önkéntesekben a kapszaicin alacsony koncentrációja véd az etanol vagy az indometacin által kiváltott gyomorsérülések ellen, 22 és 20 g chili szuszpenzió képes volt megvédeni az emberi gasztroduodenális nyálkahártyát az acetilszalicilsav nagy dózisának okozta károsodástól. 34
A CGRP-LI helyreállítását azonban megfigyelték a gyógyulás alatt fekélyt hordozó állatoknál, 7 és intenzív CGRP immunfestést figyeltek meg a gyomorfekélyben szenvedő betegek fekélyszélén. Az ecetsav által kiváltott fekély gyógyulása a CGRP knockout egerekben jelentősen késett, összehasonlítva a vad típusú egerekével, valamint a granulációs szövetekkel, és ezeknek a fekélyeknek az alapjain az újovaszkularizáció gyenge volt a CGRP -/- állatokban. 24 Ezen túlmenően, izolált patkány gyomorban, amely hiperosmoláris nátrium-klorid-koncentrációnak van kitéve, a CGRP hozzáadása elősegítette a nyálkahártya integritásának helyreállítását a károsító szer által okozott enyhe, de nem súlyos károsodás után. Ezek a megállapítások és az a megfigyelés, hogy a CGRP tonikusan áramlik az érzékszervi szálak perifériás végei felé, arra utalnak, hogy a peptid az ulcerogen által termelt felszabadulása után a fekélyek gyógyulásával összefüggésben helyreáll.
Ami az ismert CGRP antiszekretorikus hatást 7 és a gyomor D sejtjeiből származó szomatosztatin felszabadító aktivitást illeti, további 27 mechanizmust kutattak a CGRP gyomorvédő szerepének magyarázatára. Ismeretes, hogy a sérülés által kiváltott hiperémia fiziológiai reakció a szövetkárosodásra, és korlátozza a gyomor sérülésének mértékét. Ennek a válasznak a modulációja fontos védekezési mechanizmus, és arról számoltak be, hogy a kapszaicin-érzékeny szálak által felszabadított CGRP részt vesz a gyomor hiperémiás védőhatásaiban. 16.
Alacsony dózisú kapszaicin vagy TRPV-1 agonisták helyi alkalmazása, amelyek képesek stimulálni a gyomor idegvégződéseit (18,30), fokozzák a gyomor véráramlását a nyálkahártyán, tágítják a nyálkahártya alatti arteriolákat és csökkentik az etanol által termelt egyidejű durva nyálkahártya elváltozásokat. 16,30
Beszámoltak arról, hogy a hátsó gyök ganglionjaiból származó, a coeliakia/superior mesentericus ganglion komplexen áthaladó afferens idegvégződések modulálják ezeket a hatásokat, amelyeket a nagy dózisú kapszaicinnel végzett előkezelés indukál kémiai ablációval. 16,30
Figyelemre méltó, hogy a sav-back diffúzió 16 vagy a 20 hipertóniás oldat gyomor hiperémiás reakciói a szövet érzékszervi beidegzésétől függenek. Másrészt bebizonyosodott, hogy a patkány gyomor izolált szöveteinek alacsony pH-jú oldatnak való kitettsége a CGRP szelektív felszabadulását eredményezi. 12 A megszakadt nyálkahártya-gát gyomorfalába diffundáló hidrogénionok elősegíthetik a védőágulat tágulását, aktiválva a kapszaicin-érzékeny afferens idegek „efferens” funkcióját (4. ábra).
4. ÁBRA. A gyomor szenzoros rostjai által kiváltott CGRP által közvetített értágulat. A megszakadt nyálkahártya gátjának gyomorfaljába diffundáló hidrogénionok az afferens idegvégződések nyálkahártya és szubmukózális ágait egyaránt aktiválhatják, hogy felszabadítsák a CGRP-t, és arterioláris dilatációt okozhassanak.
A CGRP mediátor szerepe ebben az afferens szálak által kiváltott védő hiperémiában a következő megfigyelésekből is származik:
a kapszaicin felszabadította a CGRP-t a patkány gyomor izolált szöveteiből, 7,16, ezt a hatást a kapszaicin-érzékeny idegsejtek 16 megszakadása vagy CGRP -/- állatokban eltüntették, 24
a kapszaicin intravaszkuláris alkalmazása a CGRP felszabadulását indukálta a patkány gyomor vaszkuláris ágyában, amelyet markáns értágító hatás követett, 16,30
alacsony dózisú lokálisan alkalmazott CGRP-tágító submucosalis arteriolák és fokozott gyomorvéráramlás, 16,18
A CGRP által kiváltott értágulat összhangban van ennek a peptidnek a gyomorban lévő erek körüli eloszlásával 29 és a vaszkuláris CGRP receptorok nagy számával ebben a régióban, 11
A kapsaicin helyi alkalmazásakor a gyomor értágító reakcióját legalább részben gátolta a hCGRP8–37 antagonista. 19.
Ezek a megfigyelések együttvéve határozottan arra utalnak, hogy a CGRP a gyomor szenzoros idegeinek védő funkciójának valószínű közvetítője.
Hasonlóképpen más gyomor- és bélrendszeri rendellenességekről is beszámoltak, amelyek összefüggésben vannak a CGRP beidegzésében bekövetkezett változással. 18 A trinitrobenzensulfonsav (TNB) által kiváltott kísérleti vastagbélgyulladás és a gyulladásos bélbetegségek a szövet CGRP csökkenésével és a vastagbél idegrostjában a TRPV1 szabályozásával függtek össze. 35 A CLR elnémítása vagy a CGRP antagonista alkalmazása növelte a TNB elváltozások súlyosságát. 4,26 Ez csak egy példa arra, hogyan lehet a CGRP beidegződést felügyeleti rendszerként használni, amely más (immun-, endokrin stb.) Mentén képes koordinálni az összes gyomor-bél traktus védekezését a sérülésektől.
CGRP a gasztrointesztinális motilitási rendellenességekben és a zsigeri érzékenységben
Figyelemre méltó, hogy a jól jellemzett rektális túlérzékenységgel rendelkező betegekből vett rektális biopsziás minták a TRPV1 jelentős növekedését mutatták az izom, a nyálkahártya és a nyálkahártya rétegekben, összehasonlítva a 3. kontrolléval (1. táblázat). A ganglion sejtekben, de az SP-ben nem expresszált submukozális immunreaktív CGRP szintén megnőtt (1. táblázat). A TRPV1 növekedése szignifikánsan korrelált a hő- és feszültségérzékelő küszöbérték csökkenésével, megerősítve, hogy mind afferens, mind belső rostok részt vesznek a zsigeri túlérzékenység jelátviteli útvonalainak változásában.
ASZTAL 1 . Az 1. vanilloid receptor (TRPV1), a P anyag és a CGRP immunreaktív területek százalékos aránya rektális mintákban rektális túlérzékenységgel és kontrollokkal jellemzett betegekből. Az értékek medián, 95% -os tartományban vannak. Módosítva a Ref. 3
- Skin Turgor - áttekintés a ScienceDirect témákról
- Parietális sejt antitest - áttekintés a ScienceDirect témákról
- Fehérje intolerancia - áttekintés a ScienceDirect témákról
- Formák (gombák) - áttekintés a ScienceDirect témákról
- RNS Binding Protein FUS - áttekintés a ScienceDirect témákról