A metforminnal összefüggő hosszú távú biztonság, tolerálhatóság és súlyvesztés a cukorbetegség megelőzési program eredményeinek tanulmányában
Absztrakt
CÉLKITŰZÉS
A metformin fogyást és késleltetett vagy megelőzött cukorbetegséget eredményezett a Diabetes Megelőzési Programban (DPP). Megvizsgáltuk hosszú távú biztonságosságát és tolerálhatóságát, a súlycsökkenést, a derék kerületének változását a DPP során és annak hosszú távú nyomon követését.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
A randomizált kettős-vak klinikai vizsgálat metforminnal vagy placebóval, amelyet 7–8 éves nyílt kiterjesztés követett, valamint elemezték a nemkívánatos eseményeket, az elviselhetőséget és a tapadás hatását a súly és a derék kerületének változására.
EREDMÉNYEK
Jelentős biztonsági kérdéseket nem azonosítottak. A gyomor-bélrendszeri tünetek a metforminban gyakoribbak voltak, mint a placebo-résztvevőknél, és idővel csökkentek. A DPP során az átlagos hemoglobin és a hematokrit szint valamivel alacsonyabb volt a metformin csoportban, mint a placebo csoportban. A metformin csoportban a hemoglobin és a hematokrit csökkenése a randomizációt követő első évben következett be, az idő múlásával további változásokat nem figyeltek meg. A DPP során a metformin résztvevőinek csökkent volt a testsúlyuk és a derékbőségük a placebóhoz képest (súlya 2,06 ± 5,65%, szemben 0,02 ± 5,52%, P 2 (ázsiai amerikaiaknál ≥22 kg/m 2), emelkedett éhomi glükóz (95– 125 mg/dl), és csökkent glükóz-tolerancia (140–199 mg/dl) 2 órával a 75 g-os orális glükózterhelés után. A résztvevőket kizárták a cukorbetegség vagy olyan állapotok vagy gyógyszerek előzetes diagnosztizálása miatt, amelyek rontanák részvételi képességüket vagy Minden résztvevő írásos beleegyező nyilatkozatot adott az egyes intézményi bírálóbizottságok jóváhagyásával.
A metformint vagy a megfelelő placebót napi 850 mg-os dózisban kezdték el, és 1 hónappal napi kétszer 850 mg-ra emelték, hacsak a gyomor-bélrendszeri tünetek nem indokolják a hosszabb titrálási időszakot. Évente szabványos életmódra vonatkozó ajánlásokat és írásos információkat nyújtottak az egészséges táplálkozásról, az egészséges testsúlyról és a fizikai aktivitásról (4). Az esetmenedzserek egy rövid strukturált interjú és egy szokásos problémamegoldó megközelítés alkalmazásával mozdították elő a DPP vizsgálati gyógyszerek betartását.
A DPP első szakasza 2001-ben fejeződött be, miután átlagosan 3,2 év után követték nyomon az Adat- és Biztonsági Monitorozó Testület tanácsát az életmód és a metformin beavatkozások hatékonysága miatt a cukorbetegség megelőzésében (4). A DPP eredmények kihirdetése után a résztvevők 1-2 hetes tanulmányi/gyógyszermosási perióduson mentek keresztül, amelyet ismételt glükóztolerancia-teszt követett (9). Ezt követően feloldották őket, és felajánlottak egy 6 hónapos, 16 munkamenetű, csoportosan megvalósított programot, amelynek tartalma megegyezik az eredeti DPP életmódbeli beavatkozással (10). Minden DPP résztvevőt, függetlenül attól, hogy kialakult-e a cukorbetegség, arra bátorították, hogy csatlakozzon a DPPOS-hoz, és 88% -uk csatlakozott (6). A résztvevők követték eredeti kezelési feladataikat, és mindegyiknek negyedéves csoportos életmód órákat kínáltak. A placebókezelést befejezték. A kezdetben a metforminhoz rendelt résztvevők folytatták a vizsgálat által biztosított nyílt metformin szedését, hacsak nem voltak ellenjavallatok, vagy ha az éhomi plazma glükózszint ≥140 mg/dl volt a DPP-ben, vagy a HbA1c ≥7% volt a DPPOS alatt, ami a protokollon kívüli kezelést igényelt.
A DPP és a DPPOS során végzett adatgyűjtés összefoglalója megtalálható a Kiegészítő Függelék 1. táblázatában. A nemkívánatos eseményeket a következőképpen állapítottuk meg: 1) A DPP során, de nem a DPPOS során, minden vizsgálat résztvevőjét minden negyedévben megkérdeztük: „Az intervallum alatt a legutóbbi látogatás óta voltak-e a résztvevőnek új tünetei, sérülései, betegségei vagy mellékhatásai, vagy a már meglévő állapotok súlyosbodtak? " A válaszokat az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatalának (FDA) COSTART (Coding Symbols for a Thesaurus of Negative Reaction) kódolási rendszerével kódolták. A lehetséges hipoglikémiás eseményeket a „HYPOGLY”, „TUDATOS” és „COMA” kereséssel, a lehetséges vérszegénységet pedig „ANEMIA” vagy „B12” keresésével azonosítottuk. A súlyos nemkívánatos eseményeket (SAE) az FDA meghatározása szerint kezelték. 2) A gasztrointesztinális tüneteket évente azonosították a DPP-ben és a DPPOS-ban, megkérdezve a résztvevőket bármilyen gyomorfájdalomról, puffadásról, hányingerről, hasmenésről vagy étvágytalanságról. 3) A vizsgálati gyógyszeres kezelésnek tulajdonított gyomor-bélrendszeri tüneteket a DPP során és azoknál a résztvevőknél állapították meg, akik aktívan szedtek metformint a DPPOS alatt.
A súlyt évente kétszer, a derék kerületét pedig évente mértük (4,8). A hemoglobint és a hematokritot minden klinika laboratóriumában évente mértük minden résztvevőn, akiket randomizáltak a gyógyszeres kezelésre a DPP alatt, és azon résztvevők esetében, akik aktívan szedtek metformint a DPPOS alatt. Az alacsony hematokrit értéket az 1. táblázat határozta meg). A résztvevőket a metformin adherencia csoportból cenzúrázták, amikor a tanulmány által szállított metformint nem kontrollált hiperglikémia miatt leállították, és a cukorbetegség kezelését a protokollon kívül sikerült kezelni. Az összes résztvevőt, kivéve a cenzúrázottakat, bevonták a betartási intézkedésekbe, függetlenül az alacsony betartás okaitól (pl. Biztonság vagy standard ellenjavallatok), hogy teljes körűen feltárják a metformin és a fogyás kitettségét.
Asztal 1
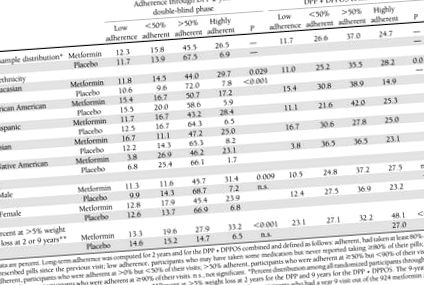
A metforminhoz és a placebóhoz való ragaszkodás megoszlása a DPP (2 év) és a DPP + DPPOS együttes (9 év) és faj/etnikum és nem szerinti bontásban, valamint a DPP/DPPOS résztvevők százalékos aránya 5% -nál nagyobb súlycsökkenést ért el a minden időszakban
A hosszú távú metformin biztonságosságának és tolerálhatóságának értékeléséhez a cukorbetegség diagnosztizálása után az összes látogatást kizárták, hogy elkerüljék a cukorbetegség kezelésével való összetévesztést (pl. Nem tanulmányi gyógyszerek alkalmazása).
A normál eloszlású hibák feltételezésével rögzített hatású modelleket alkalmaztunk az ismételt mérésekkel korrigált átlagok kiszámításához a testsúlyban és a derék kerületében a tapadási kategóriák és a kezelési csoportok között. A modelleket az alapvonal súlyához és a derék kerületéhez igazították (11). A tünetek és a nemkívánatos események időbeli értékeléséhez általánosított becslési egyenleteket alkalmaztunk kezelési csoportonként (11).
EREDMÉNYEK
DPP - a kettős-vak fázis eredménye
Beszámoltak a DPP résztvevőinek jellemzőiről (4). Azoknak a résztvevőknek az aránya, akik az előírt dózis ≥80% -át vették idővel a DPP alatt, alacsonyabb volt a metforminban (71%), mint a placebo csoportban (77%) (P 1. táblázat). A férfiak jobban ragaszkodtak a metforminhoz a DPP során, de nem a teljes követési periódus alatt. Nem figyeltek meg különbségeket a placebo résztvevők között. Az 1. év végén a súlycsökkenés a metformin csoportban 2,7 ± 4,7% (átlag ± SD) volt, szemben a placebo csoport 0,43 ± 4,7% -os veszteségével (P Az 1. ábra a testtömeg és a derék kerületének változását mutatja mindegyiknél kezelési csoport szerint a 2 éves kettős-vak fázis alatti tablettafogyasztás betartása szerint A metformin csoport 72 százaléka és a placebo csoport 74 százaléka ≥50% -ban tapadó vagy erősen tapadó kategóriába tartozott (1. táblázat), bár kevesebb placebó résztvevő volt erősen tapadó. A metforminnal kezelt csoportban a ragaszkodás szorosan összefüggött a súlyvesztéssel. A súlycsökkenés tartósságát a ragaszkodás is befolyásolta. A nagymértékben ragaszkodó résztvevők átlagos tömege 2 év alatt 3,5 ± 0,35% volt a kiindulási érték alatt, nagyon Az alacsony adherenciájúak 2. évre visszatértek az alapsúlyra (1A. ábra) (P 1. táblázat), kivéve azokat a 7% -okat, akik nagyon tapadtak a placebóhoz, akiknek kis súlygyarapodásuk volt 1,2% (P 50% tapadó csoport; az összes többi P va lues> 0,05). A gyógyszerhez való ragaszkodás és a derékkörfogat változásának összefüggései statisztikailag nem voltak szignifikánsak sem a metformin, sem a placebo csoportban. (1C. És D. Ábra).
A metformin vagy a placebo betartásának hatása a százalékos súlyváltozásra (A és B) és a derék kerületének változására (C és D) a kezelés két éve alatt a DPP kettős-vak fázisában.
Eredmények, beleértve a DPPOS-t - nyílt kezelés
A teljes követési periódus alatt a metformin résztvevők 62% -a ≥50% vagy erősen tapadó kategóriába tartozott, szemben a 2 éves kettős-vak fázis 72% -ával (1. táblázat). A placebót abbahagyták, amikor a nyílt jelölésű fázis elkezdődött, és a betartást nem lehetett kijelölni.
A DPP-n és a DPPOS-on keresztül a gyógyszeres kezelés (B) által tulajdonított, emésztőrendszeri (GI) problémák (A) és emésztőrendszeri tünetek.
Sem a vizsgálat adat- és biztonságfigyelő bizottsága, sem ez az elemzés nem azonosított váratlan nemkívánatos eseményeket vagy a nemkívánatos események kezelési csoportbeli különbségeit. Korábban beszámoltak a DPP alatti káros eseményekről (4). A gasztrointesztinális tünetek aránya magasabb volt a metformin csoportban. A DPP alatti hypoglykaemia és anaemia súlyos mellékhatásai szintén ritkák és hasonlóak voltak a metformin és a placebo résztvevőinél: hét metformin résztvevő és nyolc placebo résztvevő jelentett valaha hipoglikémiát, ötven metformin résztvevő és harminc nyolc placebo résztvevő valaha is vérszegénységről számolt be. A tanulmányi gyógyszerrel potenciálisan összefüggő SAE-k ritkák voltak. Három SAE-jelentés volt vérszegénységről (két metformin és egy placebo résztvevő), és csaknem 18 000 betegévi követés során nem voltak tejsavas acidózis vagy hipoglikémia.
A DPP során az átlagos hemoglobin és a hematokrit szint a kiindulási értéknél megegyezett, és idővel valamivel alacsonyabb volt a metformin csoportban, mint a placebo csoportban (hemoglobin: 13,6 vs. 13,8 mg/dl; hematokrit: 40,6 vs. 41,1%; P 1; Sharon L. Edelstein, ScM 2; Jill P. Crandall, MD 3; Vanita R. Aroda, MD 4; Paul W. Franks, MD 5,6; Wilfred Fujimoto, MD 7; Edward Horton, MD 8; Susan Jeffries, BSN, MSN 9; Maria Montez, RN, MSHP, CDE, CCRA 10; Sunder Mudaliar, MD 11; F. Xavier Pi-Sunyer, MD 12; Neil H. White, MD 13; és William C. Knowler, MD, DrPH 14 .
Az 1 Pennington Orvostudományi Kutatóközpontból, Baton Rouge, Louisiana; 2 A George Washington Egyetem Biostatisztikai Központja, Rockville, Maryland; a 3 Albert Einstein Orvostudományi Főiskola, Bronx, New York; a 4 Medstar Egészségügyi Kutatóintézet, Hyattsville, Maryland; az 5 Lundi Egyetem Diabétesz Központja, Skåne University Hosptial, Malmö, Svédország; a 6 Harvard Közegészségügyi Iskola, Boston, Massachusetts; a 7 University of Washington, Seattle, Washington; a 8 Joslin Diabetes Center, Boston, Massachusetts; a 9 Pittsburghi Egyetem, Pittsburgh, Pennsylvania; a Texasi Egyetem 10 Egészségtudományi Központja, San Antonio, Texas, Texas; a 11 University of California, San Diego, San Diego, Kalifornia; a 12 St. Luke’s-Roosevelt Kórházközpont, New York, New York; a 13 Washingtoni Egyetem Orvostudományi Kar, St. Louis, Missouri; valamint a 14 Nemzeti Diabetes és Emésztési és Vesebetegség Intézet, Phoenix, Arizona.
Lábjegyzetek
* A Diabetes Megelőzési Program kutatócsoportjának, központjainak és munkatársainak teljes listája megtalálható a Kiegészítő adatok online oldalon, az író csoport tagjai pedig a függelékben .
A megfogalmazott vélemények megegyeznek a nyomozók véleményével, és nem feltétlenül tükrözik a finanszírozó ügynökségek véleményét.
Lásd a kísérő cikkeket, 663., 717. és 723. o.
- Hosszú távú fogyás metforminnal vagy életmódbeli beavatkozással a cukorbetegség megelőzési programjában
- Hosszú távú fogyás metforminnal vagy életmódbeli beavatkozási belgyógyászati évkönyvekkel
- Az evangélikus súlycsökkentő központ hosszú távú, átfogó ellátást nyújt az SCL egészségre
- Hipnózis a fogyókúra gyakorlásához Diabetes napi fórumok
- A sovány tömegveszteség az alacsony fehérjetartalomhoz kapcsolódik az étrend okozta fogyás során