Koleszterin-zavarok és a megfelelő táplálkozás szerepe CKD-s betegeknél
Absztrakt
1. Bemutatkozás
A krónikus vesebetegség (CKD) széles körben elterjedt betegség, amelynek gyakorisága növekszik a modern társadalmakban [1]. A lipidek zavarai gyakoriak ebben a betegcsoportban. A legtöbb CKD-ben szenvedő betegnél aterogén diszlipidémiát észlelnek [2]. A vesebetegségben szenvedő betegeknél a diszlipidémia nemcsak a szív- és érrendszeri betegségek kockázatát növeli, hanem felgyorsítja a krónikus vesebetegség végső stádiumáig történő előrehaladását [1]. A diszlipidémia enyhülése és az oxidatív stressz, a gyulladásos folyamatok, az inzulinérzékenység és a maradék lipoproteinek szintjének csökkentése a kardiovaszkuláris terhek csökkenéséhez vezethet [1]. Úgy gondolják, hogy a hiperkoleszterinémia, a hipertrigliceridémia és az alacsony sűrűségű lipoprotein-koleszterin szintjének emelkedése kulcsfontosságú tényező a szív- és érrendszeri betegségek (CVD) kockázatának szempontjából CKD-s betegeknél [3]. A táplálkozási beavatkozások erősíthetik a kezelés jótékony hatását, és fontos szerepet játszanak a krónikus veseelégtelenségben szenvedő betegek általános jólétének megőrzésében, mivel a megfelelő étrend célja a kardiovaszkuláris események kockázatának csökkentése, az alultápláltság megelőzése és az előrehaladás akadályozása. vesebetegség [3,4,5,6].
2. Koleszterin-zavarok a CKD-ben
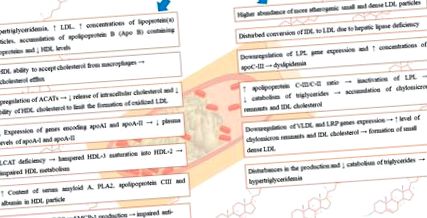
Számos tanulmány mutatott összefüggést a veseműködési zavar és a lipoprotein anyagcsere zavarai között, amelyek diszlipidémiát és azt követő aterogén részecskék felhalmozódását eredményezik [7]. A krónikus vesebetegség során gyakran a következő zavarokat figyelik meg: megemelkedett VLDL, IDL, triglicerid szint, normális és megnövekedett LDL szint mellett, ugyanakkor emelkedett koncentrációjú oxidált LDL, HDL hiány és diszfunkció, csökkent apolipoprotein szint A-1, az apolipoprotein B (Apo B) -t tartalmazó lipoproteinek, valamint magasabb apolipoprotein C-III/C-II arány felhalmozódása [7]. A lipoproteinek rendellenességei a vesekárosodás mértékétől, az elsődleges betegség etiológiájától, a nephroticus szindróma (NS) jelenlététől és a vesepótló terápiát igénylő betegeknél a vesepótló terápia módszerétől is függenek - hemodialízis (HD) vagy peritonealis dialízis (PD). [8]. A megváltozott lipoprotein szint stimulálhatja a vesefunkció károsodásának progresszióját [9,10]. A CKD során fellépő lipoproteinszint-zavarokat az 1. ábra foglalja össze .
Összefoglaló a CKD során fellépő lipoproteinszint-zavarokról.
2.1. Koleszterin-zavarok a CKD 2–3a, 3b és 4 szakaszában
A krónikus veseelégtelenségben megfigyelt máj lipáz (HL) hiány hiányos IDL – LDL transzformációt, a szérum IDL növekedését, az LDL TG-dúsulását és hipertrigliceridémiát eredményez [20,29]. Patkányokon végzett vizsgálatok kimutatták, hogy krónikus vesebetegségben a máj lipáz mRNS-je alacsony szinten van szabályozva, ezért a HL termelése, aktivitása és felszabadulása zavart okoz. Feltételezték, hogy ennek a jelenségnek a mechanizmusa összefügg a másodlagos hiperparatireoidizmussal, mivel a túlzott PTH PTX általi megelőzése vagy a verapamillal végzett kezelés (amely blokkolja a PTH hatásait) korrigálta a máj lipáz metabolizmusának károsodását [29]. Ezenkívül a VLDL clearance-e krónikus veseelégtelenségben károsodott a VLDL-receptor génexpressziójának és a fehérje-bőség jelentős csökkenése miatt, ami a VLDL és a triglicerid plazmaszintjének emelkedéséhez vezet [20,30,31].
A csökkent HDL-szinteken kívül a CKD-ben a HDL-asszociált enzimek, beleértve a paraoxonázt is, csökkent aktivitása figyelhető meg [32].
2.2. Koleszterin-zavarok az ESRD-ben (5ND)
A HDL csökkenő szintje az ESRD-ben jelentősen csökkent ApoA-I plazmakoncentrációval járhat, mivel ez a HDL kulcsfontosságú fehérje alkotóeleme [20]. A hipoalbuminémia, amely gyakran gyulladás, alultápláltság stb. Következtében fordul elő az ESRD-ben, hozzájárulhat a HDL-szint alacsonyabb szintjéhez, mivel a HDL koleszterintartalmának jelentős részét az albumintól kapja. Az albuminok a perifériás szövetekből a HDL-3-ra jutó szabad koleszterin hordozójaként működnek [20,43].
ESRD-s betegeknél szignifikánsan csökkent plazma LCAT-aktivitás és koncentráció figyelhető meg [37,44]. Végstádiumú vesebetegségben (ESRD) szenvedő betegeknél az apoA-I nem enzimatikus glikációja az LCAT csökkent aktiválódását eredményezi, ami magasabb apoA-I keringésből való kiürüléséhez, valamint a HDL gyulladáscsökkentő és antioxidáns tulajdonságainak gátlásához vezet [45 ]. Az LCAT hiánya nemcsak a HDL szint csökkenéséhez, a HDL érésének károsodásához és a pre-béta HDL részecskék szérumszintjének növekedéséhez járul hozzá, hanem meggyorsíthatja a HDL lebomlását is [20]. A HDL felgyorsult lebomlása a máj endocitikus receptorához való preferenciális kötődéssel jár, ami az éretlen HDL részecskék internalizációjához és lebomlásához vezet az ESRD populációban [20]. Az ESRD-ben a lipoprotein lipáz aktivitást csökkentő további tényezők között a következők vannak: az érett HDL részecskék alacsony szintje (amely ApoE és ApoC donor), de a pre-béta HDL magas szintje (ellentétesen hat), csökkent az ApoC-II/ApoC-III arány, alacsonyabb fizikai aktivitás, zavarta a tiroxin (T4) –tri-jodotironin (T3) átalakulását, valamint az inzulinrezisztencia [20]. Kimutatták, hogy a végstádiumú CKD-ben szenvedő betegek HDL-je prooxidáns, mivel oxidatív módosuláson megy keresztül [37].
Vizsgálatok szerint a plazma lipoproteinek mintázatában az ESRD-vel kapcsolatos változások jelentősen megváltoztathatók a dialízis modalitásával [20]. Például a szérum koleszterin- és LDL-koleszterinszint gyakran a normál határokon belül vagy alatt van a hemodialízisben részesülő ESRD-s betegeknél, míg a peritonealis dialízisben szenvedő betegeknél.
2.3. Koleszterin-zavarok dializált betegeknél
2.3.1. Hemodialízis
A teljes és az LDL koleszterinszint, valamint a nem HDL koleszterinszint általában a normál határokon belül marad [42,49]. Hemodialízis alatt álló ESRD-ben szenvedő betegeknél csökkent apoAI-szint figyelhető meg, amely összefügg a fokozott katabolizmussal. Ezenfelül ezeknél a betegeknél az anti-apoAI autoantitestek magasabb szintjét figyelték meg, ami az ApoAI szintjének csökkenését és e fehérjék diszfunkcióját eredményezi [33]. Attman és mtsai. [47] szerint a dialízisben szenvedő betegeknél az apoB és az apoE mérsékelt emelkedése figyelhető meg, és az apoC-III koncentrációk jelentős növekedése figyelhető meg. HD betegeknél az ApoA-IV szintje megemelkedik. Az apoC-III és a VLDL-koleszterinszint emelkedése és az alacsonyabb HDL-koleszterinszint még hiperlipidémia nélküli betegeknél is megfigyelhető [46,47,50]. Attman és mtsai. [46,47] az apoB-tartalmú lipoproteinek és az trigliceridekben gazdag apoB-tartalmú lipoproteinek szintjének növekedését is kimutatta, ami az apoB-tartalmú lipoproteinek jelentős növekedését eredményezte az IDL9-ben.
Lee és munkatársai által végzett tanulmány eredményei. nem mutatott ki szignifikáns különbséget a lipoprotein lipáz reaktivitásában a HD és a pre-dialízisben szenvedő betegek VLDL és IDL között [51].
Egyes tanulmányok azt mutatták, hogy a hemodializált betegek és a normál alanyok között nincs jelentős különbség a plazma CETP-koncentrációban [20,52,53]. A krónikus vesebetegség nemcsak stimulálja a HDL-koncentráció csökkenését, hanem megváltoztatja ennek a lipoproteinnek az összetételét is [54]. A fokozott szisztémás gyulladás és az oxidatív stressz jelenléte miatt megfigyelték a HDL antioxidáns, gyulladáscsökkentő funkcióinak csökkenését vagy akár a HDL átalakítását prooxidáns/gyulladáscsökkentő részecskévé [20,55] . Hemodializált betegeknél a paraoxonáz és a glutation-peroxidáz plazmaszintjének jelentős csökkenése figyelhető meg, a HDL antioxidáns kapacitásának súlyos elvesztésével együtt [37]. Yamamoto és mtsai. [56] emelkedett szérum amiloid A, PLA2, apolipoprotein CIII és albumintartalmat mutatott dializált betegek HDL részecskéiben. Ezenkívül a HDL részecskéknek az a képessége, hogy elfogadja a koleszterint a makrofágokból, csökkent, ami ennek következtében csökkent koleszterin kiáramlást eredményezett. Ribeiro és mtsai. [57] kimutatta az oxLDL jelentős felhalmozódását, különösen HD betegeknél. Úgy tűnik, hogy a vese diszlipidémia fő jellemzői alapvetően változatlanok maradnak a HD alatt, azonban a diszlipidémia mérsékelten csillapítható hosszú távú HD alatt [46].
2.3.2. Peritonealis dialízis (PD)
A PD betegeknél a HD betegekhez képest kifejezettebb az aterogén lipoproteinek növekedése [46].
2.4. Koleszterin zavarok transzplantált betegeknél
3. A rossz koleszterinprofilhoz kapcsolódó kockázat és a lipidszint csökkenésével járó előnyök CKD-s betegeknél
A kardiovaszkuláris kardiovaszkuláris betegek kardiovaszkuláris morbiditásának/mortalitásának növekedése összefügg az oxidatív stressz és a gyulladás jelenlétével [7,68]. Az első feltétel aktiválja a transzkripciós faktorokat, amelyek a proinflammatorikus citokinek felszabadulásához és a makrofágok aktivációjához vezetnek, míg az utóbbi a reaktív oxigénfajok (ROS) termeléséhez és az oxidatív stressz elősegítéséhez kapcsolódik a szövetekben [68]. A megnövekedett oxidatív stressz állapotában a CKD-s betegeknél feltételezhetően összefügg az urémiás toxinok magasabb koncentrációjával [68]. Ugyancsak kimutatták, hogy az antioxidáns enzimek, köztük a szuperoxid-diszmutáz, a kataláz és a glutation-peroxidáz szintje csökken a CKD-s betegeknél [68].
A megnövekedett kardiovaszkuláris CKD-kockázattal kapcsolatos másik mechanizmus a CKD káros hatása a HDL-mediált reverz koleszterinfelvétel sebességére a perifériás szövetekből és a koleszterin-rakomány kirakása a májba [34,74]. A HDL által közvetített reverz koleszterinfelvétel a lecitin-koleszterin-aciltranszferáz szabályozásának csökkenésével, az apolipoprotein A1 termelésének csökkenésével és fokozott katabolizmusával, valamint az acil-koenzim A-koleszterin-acil-transzferáz-1 szabályozásával jár együtt [75]. Ezenkívül az apolipoprotein A1 módosításai károsítják a HDL azon képességét, hogy kötődjön a koleszterin kiáramlását közvetítő géphez az ATP-kötő A1 és G1 kazetta transzporteren keresztül [34,76]. Ezek az apo-AI módosítások korlátozhatják a HDL kötődését a B1-es scavenger receptorhoz, ami ennek következtében a HDL-C rakomány hibás elhelyezéséhez vezet a májban [34,77].
3.1. Gyermekek/serdülők népessége
3.2. Felnőtt népesség
A TC és a mortalitás közötti összefüggést ábrázoló U-alakú görbe lineárisabbnak tűnt a szérumalbumin beállítása után [93,95,96]. A gyulladás és az alultápláltság dialízisben szenvedő betegek hatására vonatkozó tézist megerősítette egy nagy, 10 éves prospektív japán HD betegekkel végzett kutatás [93], amely független összefüggést mutatott ki az alacsony TC és a magasabb C-reaktív fehérje (CRP) és a betegek mortalitása között. alacsony albuminnal. A dializált betegek egy másik prospektív vizsgálatában a kiindulási TC 1 mmol/l növekedése a gyulladás/alultápláltság jelenlétében az összes okból bekövetkező halálozás csökkenésével járt [96].
Vizsgálatok szerint a megnövekedett LDL-C értékkel járó túlzott kockázat az eGFR csökkenésével együtt csökken [97]. Tonelli és mtsai. [98] kimutatta, hogy az incidens miokardiális infarktus (MI) kockázati aránya [HR] (95% konfidenciaintervallum [CI]) az LDL-C 44,9 mmol/L-hez kapcsolódott (szemben 2,6–3,39 mmol/L [100–131 mg/dl]) 3,01 (2,46–3,69), 2,30 (2,00–2,65) és 2,06 (1,59–2,67) azoknál a betegeknél, akiknek eGFR-értéke ≥90, 60–89,9, illetve 15–59,9 ml/perc/1,73 m 2 [97,98]. Az LDL-C és az MI kockázat közötti kapcsolat lineárisnak tűnik, ha az LDL-C értéke 2,6 mmol/l (100 mg/dl) felett van. Kísérleti vizsgálatok megerősítették, hogy a diszlipidémia fokozza a lipidperoxidációt és szabad gyökös reakciókat vált ki [3,4].
Asztal 1
Krónikus vesebetegségben (CKD) a lipid rendellenességekkel kapcsolatos vizsgálatok eredményeinek összefoglalása.
- Az eróziós gasztritiszben szenvedő betegek étrendje és megfelelő táplálkozása
- GIST diéta - megfelelő táplálék a GIST rákos betegek számára Az élet tutaj csoportja
- Táplálkozási gyakorlatok és táplálkozási szokások nem kritikusan beteg, posztoperatív felnőtt betegek körében An
- Az orvosokat nem tanították meg az étrend és a táplálkozás megbeszélésére a betegekkel - Chicago Tribune
- A Food Is Medicine sorozat A táplálkozás szerepe az életminőség javításában A táplálkozás palliatív módon