Leigh-kór: Kétéves, szubakut nekrotizáló encephalomyelopathiás gyermek akut klinikai lefolyása
1 Jogi Orvostudományi Intézet, Müncheni Egyetem, Nussbaumstraße 26, 80336 München, Németország
Absztrakt
Egy korábban egészséges, kétéves kislány tipikus klinikai lefolyásáról számolunk be, aki hirtelen és váratlanul halt meg hányás után. Az igazságügyi boncolás során más patológiás eredményeket nem lehetett diagnosztizálni, mint az agyszár, a mesencephalon és a pons több vöröses, süllyedt területét. Szövettanilag a neuropil spongiosis területeiként jelennek meg kiemelkedő endotheliális hiperpláziával és vaszkuláris proliferációval, míg az idegsejtek jól megőrződtek. A jellegzetes neuropatológiai leletek és a gyermek életkorának figyelembevételével figyelembe kellett vennünk, hogy a gyermek szokatlan, fulmináns klinikai lefolyása ellenére szubakut necrotizáló encephalomyelopathiában (Leigh-kór) halt meg.
1. Bemutatkozás
Rendszerint a szubakut nekrotizáló encephalomyelopathia legalább néhány hónapos klinikai lefolyással és lenyűgöző klinikai tünetekkel jár. De előfordulhatnak olyan dokumentálatlan, váratlan halálesetek, amelyeket szubakut necrotizáló encephalopathiaként diagnosztizálhattak csak a halál utáni vizsgálat során, ha atípusos progresszió következtében végeztek.
2. Esettanulmány
Egy korábban egészséges, 24 hónapos, strabismus concomitansos lány, nystagmussal társítva, gyermekgyógyászati kórházba került. Továbbá a lány anyja olyan nem specifikus tünetekről számolt be, mint a figyelemhiány, az éberség csökkenése, a fokozott idegesség és az „interakciós problémák”.
A vizsgálat során megállapították, hogy a lány általános egészségi állapota megfelelő táplálkozással történt. A fizikai és pszichomotoros fejlődés normálisnak bizonyult. A klinikai vizsgálatok, beleértve a laboratóriumi vizsgálatokat, valamint a mágneses rezonancia képalkotással (MRI) végzett neurológiai vizsgálatok, amelyeket elővigyázatosságból végeztek az intrakraniális betegség kizárására, normálisnak bizonyultak. Az elektroencefalográfia kismértékű csökkenést mutatott az éles hullámú és a theta ritmusú aktivitással összefüggő éberségben. Szemészetileg egy strabismus concomitans divergenciát diagnosztizáltak. A gyermek hazatérhetett, de szemészeti nyomon követést javasoltak.
Három hónappal később a gyermek otthon hányni kezdett. Végül hívták a mentőket, amikor a lány elveszítette az orrától a vérzéses nyálkát. Röviddel ezután elvesztette az eszméletét, és amikor a mentők megérkeztek, már klinikailag meghalt. Az újraélesztés sikertelen volt. A halált feltételezett epilepsziás roham során a aspirációnak tulajdonították.
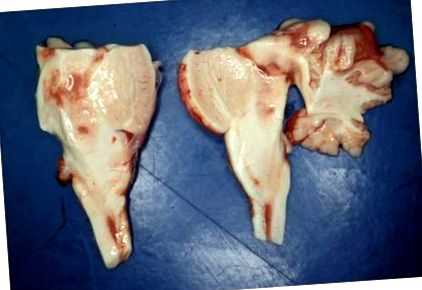
A lány törvényszéki postmortem vizsgálata kevés szabálytalanságot mutatott; különösen a szív és a tüdő mentes minden kóros lelettől. A glükóz metabolizmusának laboratóriumi vizsgálata, valamint kémiai-toxikológiai vizsgálatok normális eredményeket mutattak, kivéve a vér laktátkoncentrációjának növekedését (47,9 mmol/l; hivatkozás: 1. ábra
Rögzítés után az agy szövettani vizsgálata történt (hematoxilin és eozin, krezil-ibolya, Luxol-Fast-Blue, van-Gieson Elastica, PAS és Porosz kék).
m vastag szakaszokat immunfestettünk az ABC módszerrel. Az asztrociták jelölésére monoklonális antitestet használtunk a glia fibrilláris savas fehérje ellen (GFAP, hígítás 1: 100, DAKO, Németország); mikroglia esetében a HLA-DP, DQ, DR antigén elleni monoklonális antitestet (CR 3/43, hígítás 1: 100, DAKO, Németország, hangyasavval történő emésztés). Az antigéneket Histostain-Plus peroxidase készlettel (Zytomed, Németország) detektáltuk.
A szövettani vizsgálaton átfogó hipoxiás-ischaemiás idegsejt-károsodást észleltek a fő lebenyeken, a fogazati magban és a Purkinje sejtrétegben. A caudate magok, a thalamus, a hypothalamus, a mezencephalon, a pons és a medulla oblongata szakaszain a neuropil spongiosisának széles körű gócai voltak, kiemelkedő endotheliális hiperpláziával és vaszkuláris proliferációval. A hipoxiás-iszkémiás változások mellett az idegsejtek viszonylag jól megőrződtek (3. ábra). A GFAP immunfestése markáns asztrogliózist mutatott ki. Az agyféltekék fehérállománya, a hippocampus képződése, a medulla oblongata és a mamilláris testek nem voltak figyelemre méltók.
3. Megbeszélés
A ritka szubakut necrotizáló encephalomyelopathiát Leigh [1] írta le először klinikailag és etiológiailag nagyon változó, progresszív szindrómaként, különösen a gyermekpopulációban, bár néhány fiatalkorú és felnőtt eset ismert [2, 3].
A klinikai tünetek és a lefolyás nem specifikus, heterogén és nyilvánvalóan életkorfüggő változása a betegség különböző enzimhibáinak azonosításának tulajdonítható. Már mitokondriális, valamint nukleáris DNS enzimhibákat találtak [2, 4, 5], amelyek hasonló klinikai lefolyásokat határoznak meg, de különböző életkorban fordulnak elő. A klinikai tüneteket az is meghatározza, hogy az agy melyik területe érintett.
Az infantilis forma általában az élet első két évében kezdődik, nem specifikus tünetekkel és a pszichomotoros fejlődés lelassulásával. Egyéb tünetek a figyelemhiány, a végtag hipotóniája, a látási rendellenességek, beleértve a nystagmust, a gyenge erõsség, a hányás, az étkezési hajlandóság és a fogyás [2, 4, 6]. Gyakran kialakulnak olyan neurológiai tünetek, mint az ataxia, a piramiscsatorna hiányai, az apraxia és a myoclonus, majd az agytörés károsodásának jeleként oftalmoplegia és légzési nehézségek lépnek fel [2].
A veleszületett citokróm-c-oxidáz-hiány, piruvát-dehidrogenáz-hiány, valamint biotinidáz-hiány okozzák ezeket a klinikai tüneteket [4, 7, 8]. Ezeknek az állapotoknak valószínűleg autoszomális-recesszív öröklődésük van, bár a mitokondriális és az anyai öröklődésről tárgyalnak, és szórványos esetek ismertek [3, 4]. Genetikai szabálytalanságokat csak a betegek kb. 50% -ában találtak, ami azt mutatja, hogy sok más biokémiai szabálytalanság vezethet a Leigh-kór klinikai szindrómájához [8].
Specifikus biokémiai vizsgálatok még mindig hiányoznak, azonban a laktát-acidózis és a plazma és a CSF megnövekedett laktát-piruvát hányada szinte mindig megtalálható [4]. A mitokondriális DNS mutációk felkutatása, mint a Leigh-kór gyakori oka, és az izombiopsziák biokémiai vizsgálata továbbra is az arany színvonal a diagnózisban [9, 10].
Az agy neuropatológiai vizsgálata során az agytörzs, a putamen, a bazális ganglionok, a thalamus és a gerincvelő hátsó szarvának szimmetrikus, vörösbarna színű központi elváltozásai makroszkóposan azonosíthatók [6].
A korai stádiumban a neuropilt a spongiosis károsítja, amelyet kapilláris proliferáció, asztrogliózis és megnövekedett makrofágok követnek. A betegség során demielinizáció következik be, amely az idegsejteket és az axonokat szinte érintetlenül hagyja. Ez lehetővé teszi például az iszkémiás/hipoxiás elváltozásoktól való megkülönböztetést [1, 2, 6, 7]. Különösen a mesencephalon, a pons, a caudate, a medulla oblongata, a központi koponyaideg magja, az alsó oliva magja, a kisagy, a bazális ganglionok és a látóideg érintettek [6].
Az agyszövet megsemmisítése progresszív neurológiai diszfunkciókat okoz, amelyek a központi légzési bénulás következtében a diagnózis után körülbelül két évvel rendszeresen halállal végződnek. Jelenleg nincs gyógyító terápia [3, 4, 6].
Az MRI szimmetrikus, hypodense (T1) és hyperdens (T2) elváltozásokat mutat a bazális ganglionokban, különös tekintettel a caudate és a putamen területére. Hasonló elváltozások láthatók Wernicke encephalopathiájában, sclerosis multiplexében, Wilson-kórában, aminosav-karbamidban, mitokondriális encephalomyelopathiákban és a mérgezés különféle formáiban is [3]. Wernicke encephalopathiájától eltérően a mamilláris testeket megkímélik a kóros elváltozásoktól [3]. A vér laboratóriumi vizsgálata lehetővé teszi a Wilson-kór megkülönböztetését [4].
Jelenleg a legtöbb tüneti terápia megpróbálja javítani a mitokondrium oxidatív és bioenergetikus képességeit [6]. A Q10 koenzim, a tiamin és a karnitin alkalmazása néhány esetben a tünetek súlyosságának csökkenését okozhatja [6]. Cacic és mtsai. beszámol arról, hogy egy 19 éves férfi tüneteit legalább négy évig stabilan tartotta egy terápia, amely magában foglalta a levodopát, a karbidopát és a kreatinin-monohidrátot [8].
4. Következtetések
A bemutatott esetben a Leigh-kór diagnózisát csak a halálozás után sikerült elérni, bár a halál előtt három hónappal MRI-vizsgálatokat és laboratóriumi vizsgálatokat végeztek. Normális eredményeket mutattak, továbbá egyéb tipikus tüneteket - például a pszichomotoros fejlődés késését, gyengeséget, étkezési nehézséget vagy tipikus neurológiai tüneteket - nem figyeltek meg. A halál napi klinikai tünetei valószínűleg elsősorban akut agyi eredetűek voltak. A postmortem vizsgálat azonban kimutatta a gyermek agyának morfológiai leleteit, amelyek specifikusak a Leigh-kórra. A vér és a CSF megnövekedett laktátkoncentrációja postmortem vizsgálat során igazolható, amely jellemző a Leigh-kórra, de sok boncoláskor megfigyelhető az általános agonális sejtes hipoxémia miatt.
Feltételezzük, hogy ez az esettanulmány a normálisan szubakut necrotizáló encephalomyelopathia szokatlan, „akut” lefolyását írja le feltűnően rövid és többnyire észrevehetetlen klinikai lefolyással.
Köszönetnyilvánítás
A szerzők köszönetet mondanak A. Nerlich úrnak, a München-Bogenhauseni Kórház Patológiai Intézetének igazgatójának és W. Feiden úrnak, a Saarlandi Egyetemi Kórház Neuropatológiai Intézetének igazgatójának konzultációikért.
Hivatkozások
- D. Leigh: „Szubakut nekrotizáló encephalomyelopathie egy csecsemőben” Journal of Neurology, Neurosurgery & Psychiatry, köt. 14, 1951. 216–221. Megtekintés: Google Scholar
- R. J. Huntsman, D. B. Sinclair, R. Bhargava és A. Chan: „A leigh-szindróma atipikus bemutatása: esetsorozat és áttekintés” Gyermekneurológia, köt. 32. sz. 5, 334–340, 2005. Megtekintés: Publisher Site | Google ösztöndíjas
- M. Spranger, S. Schwab, M. Wiebel és C.-M. Becker, „Das adulte Leigh-szindróma” Nervenarzt, köt. 66. sz. 2, p. 144–149, 1995. Megtekintés: Google Scholar
- R. Tomczak, A. Rieber, H. Zeitler és H.-J. Brambs, „Neugeborenes mit zerebraler symptomatik” Radiologe, köt. 36. sz. 7, 591–592., 1996. Megtekintés: Google Scholar
- S. Savasta, G. P. Comi, M. P. Perini és munkatársai: „Leigh-kór: három új, citokróm c-oxidáz-hiányos eset klinikai, neuroradiológiai és biokémiai vizsgálata” Journal of Child Neurology, köt. 16. sz. 8, 608–613, 2001. Megtekintés: Google Scholar
- A. A. S. R. Mannan, M. C. Sharma, P. Shrivastava et al., „Leigh-szindróma” Indian Journal of Pediatrics, köt. 71. sz. 11, 1029–1033, 2004. Megtekintés: Google Scholar
- M. Crimi, A. Papadimitriou, S. Galbiati és mtsai. „Egy új mitokondriális DNS-mutáció az ND3 génben, súlyos Leigh-szindrómát okozva korai letalitással”. Gyermekgyógyászati kutatás, köt. 55. sz. 5, 2004. o. 842–846. Megtekintés: Publisher Site | Google ösztöndíjas
- M. Cacic, E. Wilichowski, V. Mejaski-Bosnjak et al., „Extrapiramidális szindrómaként megjelenő citokróm c-oxidáz parciális hiányhoz kapcsolódó leigh betegség” Journal of Child Neurology, köt. 16. sz. 8, 616–619, 2001. Megtekintés: Google Scholar
- E. Pronicka, D. Piekutowska-Abramczuk és M. Pronicki: „Metabolikus betegségek gyermekeknél, beleértve a Leigh-szindrómát - biokémiai és molekuláris háttér Postepy Biochemii, köt. 54. sz. 2, 161–168., 2008. Megtekintés: Google Scholar
- K. Naess, C. Freyer, H. Bruhn et al., "Az MtDNS mutációk a súlyos betegségfenotípusok gyakori okai a Leigh-szindrómás gyermekeknél". Biochimica et Biophysica Acta, köt. 1787. sz. 5, 2009. 484–490. Oldal. Megtekintés: Publisher Site | Google ösztöndíjas
- A túlsúly és az elhízás hatása a korai Parkinson-kór funkcionális és klinikai eredményeire
- Leigh-betegség vagy szindróma UMDF
- Hosszú távú eredmények az akut nekrotizáló hasnyálmirigy-gyulladás után Mi történik a hasnyálmirigy és a
- Leigh s Disease Information Page Országos Neurológiai Rendellenességek és Stroke Intézet
- Életmódbeli intézkedések a gastro-oesophagealis reflux betegség kezelésében klinikai és