Osteochondritis dissecans (OCD) lovakban - Patogenezisének molekuláris háttere és perspektívái az őssejt őssejt terápia szempontjából
Lynda Bourebaba
1 Kísérleti Biológia Tanszék, Biológiai és Állattudományi Kar, Wrocław Környezet- és Élettudományi Egyetem, Norwida 27B, 50-375 Wrocław, Lengyelország
Michael Röcken
2 Állatorvostudományi Kar, Lóklinika - Lovassebészet, Justus-Liebig-Egyetem, 35392 Gießen, Németország
Krzysztof Marycz
1 Kísérleti Biológia Tanszék, Biológiai és Állattudományi Kar, Wrocław Környezet- és Élettudományi Egyetem, Norwida 27B, 50-375 Wrocław, Lengyelország
2 Állatorvostudományi Kar, Lóklinika - Lovassebészet, Justus-Liebig-Egyetem, 35392 Gießen, Németország
Absztrakt
Bevezetés: Áttekintés
A lóváz fejlődési betegségei, amelyek magukban foglalnak minden olyan rendellenességet (öröklődő vagy szerzett), amely zavarhatja a csont normális fejlődését, modellezését vagy átalakítását, sokféle állapotot magában foglal, amelyek részleges vagy teljes kudarcként jelentkezhetnek a csontok korai szakaszában. vagy végtagok fejlődése, vagy kondrodiszpláziaként és osteodysplasiaként, amelyek az egész csontvázat érintik. A lóban elismert számos feltétel közül az osteochondrosis férfiasan összefügg a „fejlődési ortopédiai betegségek” komplexumával [1].
Az osteochondrosis (OC) egy multifokális patológia, amely mind az ízületi-epiphysealis porc komplexben (éretlen ízületi porc, amely a növekvő hosszú csontok végét borítja), mind a növekedési lemezen megy végbe számos emlősfajban. A rendellenességet az endokondrális csontosodás meghibásodása jellemzi, és a háziállatok degeneratív ízületi betegségének egyik leggyakoribb elsődleges okának tekintik [2, 3]. Az OC egyik leggyakoribb megnyilvánulása az osteochondrosis dissecans (OCD), amelyet a növekvő porc sejtdifferenciálódásának sikertelenségében vesznek részt, ami drámai megvastagodásához vagy retenciójához, repedések megjelenéséhez és a porcszárnyak fokális elvesztéséhez vezet. az ízületi üreg. A levált fragmensek felelősek lehetnek súlyos ízületi gyulladásért, ami a másodlagos osteoarthritis (OA) későbbi kialakulásához vezethet [4].
Kezdetben az „osteochondritis dissecans” kifejezést először Franz Konig (1832–1910) német sebész vezette be, amikor tanulmányt végzett az ízületek laza testéről; a betegség három lehetséges okát javasolta. Az első kettő traumás eredetű volt, beleértve a súlyos fragmentációt vagy a subchondralis csont nekrózist, ami közvetetten a fragmensek elvesztéséhez vezet. A harmadik kategóriájú elváltozásokról számoltak be, hogy számottevő trauma nélkül jelentek meg, és mintha más tényezőkhöz kapcsolódna [5]. Ezután 1947-ben az OCD-t ismét jelentették a lovaknál, mint az oldalsó trochlearis gerinc kopása laterális patellaris luxus mellett. Ezt követően hasonló elváltozásokat figyeltek meg, és osteochondralis törésekről és osteochondritis dissecansról számoltak be. 1968-ban a disztális sípcsont intracapsuláris csontos töredékeit több lónál diagnosztizálták, és később a tibiotarsalis ízület OCD-ként írták le, és a töredékek műtéti eltávolítása hasznos kezelésnek számított [6]. Később kutatások megállapították, hogy ez az elváltozás az endokondrális csontosodás folyamatának fokális zavara volt. Manapság ez utóbbi definíció széles körben elterjedt az állatorvosi szakirodalomban [5].
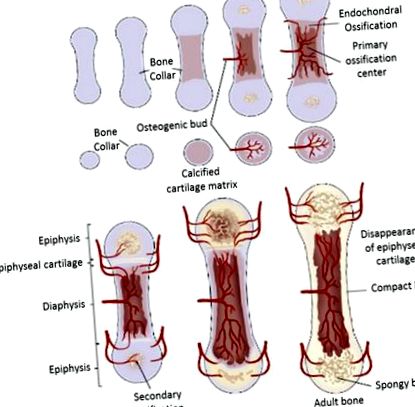
Endokondrális csontosodás az egészségügyben
Emlősök hosszú csontjának csontosodási folyamata [19]
Ha az ízületi porc degenerálódni kezd, és különben leválik a csontfelületről, oszteochondrosis dissecans (OCD) állapot rendeződik, és végül társult sántaság alakul ki. Számos zavaró és kiváltó tényező társult a dyschondroplasia kórokozó folyamatával; azonban az állapotra jellemző elsődleges elváltozások kialakulásához vezető első lépésekről jelenleg nagyon kevés információ áll rendelkezésre, az érintett állatok korai klinikai tüneteinek késői megjelenése miatt [20].
Etiológia
Az osteochondrosis (OC) a fejlődési betegség kezdeti folyamatának tekinthető, amely végső soron az osteochondralis fragmentációt és az OCD ebből következő fejlődését eredményezi. Amikor az OC korai elváltozásai megjelennek, hajlamosak vagy spontán gyógyulni, vagy előrehaladottabb szakaszba fejlődni, ami az OCD-re jellemző boncoló elváltozások megjelenését eredményezi [16].
Porc származtatott szár/őssejtek (CSPC-k)
A porc olyan szövet, amelynek károsodása esetén alacsony az önregenerációs potenciálja, mivel avaskuláris, aneurális és az ott keringő vér gyengén koncentrálódik különböző növekedési faktorokban, amelyek szükségesek a sejtek szaporodásához és regenerálódásához. [34]. Valóban, a porcszövetet egyszerűsített strukturálás jellemzi, amely csak egy sejttípust (kondrocitákat) és bőséges ECM-t tartalmaz, magas rosttartalmú fehérjék (főként II-es típusú kollagén) és vízkötő, többnyire szulfatált glikozaminoglikánok (sGAG) tartalmával [35]. . Az ízületi porc fejlődését azonban különféle növekedési faktorok által szabályozott molekuláris események kaszkádja szervezi, amelyek kölcsönhatásai lehetővé teszik egy jól megtervezett architektúra kialakítását [34].
Humán, ló és szarvasmarha ízületi porcból izolált CSPC-k jellemzése. a őssejtekkel kapcsolatos felületi markerek kifejezése; b A CSPC-k tulajdonságai és felhasználás az osteoarthritis (OA) kezelésére [41]
Amikor az OC (D) fejlődés porcelváltozások megjelenését váltja ki, az ízületi szövetekben (például a synoviumban) elhelyezkedő ős/progenitor sejtek aszimmetrikus osztódással kezdenek önmegújulni annak érdekében, hogy elindítsák a funkcionális funkcionális csoport kialakulását. sejtek, amelyek regenerálják és helyreállítják a sérült szöveteket [45]. A humán OC ízületi porc korábbi elemzése feltárta a CSPC sejtek jelenlétét, amelyek számos, a mezenhimális progenitor sejtekre specifikus markert expresszálnak, beleértve a Stro-1, VCAM (CD166) és Notch-1; érdekesebb, kísérleti módon azonos sejttípus detektálása egészséges porcokban negatívnak tűnt. Ezek a megfigyelések tehát azt sugallják, hogy ezek az őssejtek reagálhatnak a sérült porcok toborzási ingereire, beleértve az elhalt szöveti törmelékeket és a kromoszóma fehérjéket [46]. Ezt követően számos lehetséges MSC-szerű sejt forrását tárták fel, köztük főleg trabecularis csontot (epiphysis, metaphysis), csontvelőt, periosteumot, synoviumot, infrapatelláris zsírpárnát, synovialis folyadékot és vázizomokat a létfontosságú felnőtt mozgásszervi rendszerben; kisebb részben szalagok és inak [47].
Továbbá beszámoltak arról, hogy a 2-es transzkripciós faktor (Runx2), valamint a nemet meghatározó Y-box 9 (Sox9) régió kulcsfontosságú szerepet játszik a szabályozás és a CSPC-sejtek mobilizálásának folyamatában. Ezért a Sox9 faktor az egyik alapvető elem, amely szabályozza a porcos mátrix modellezésében, a kondrociták érésében és a kondrális csontosodás elnyomásában részt vevő kulcsfontosságú komponensek szintézisét. Másrészt úgy tűnik, hogy a Runx9 férfiasan részt vesz az oszteoblasztok fejlődésének szabályozásában, ezért elengedhetetlen a csontok fejlődéséhez [48].
Azon túl, hogy az MSC-k sztróma eredetű sejtek, utóbbiak erős képességet mutattak az ECM-et alkotó különböző fehérjék szintézisére és szabályozására, valamint a mátrix metotroproteinázokra. Ha ezek az őssejtek kondrogén környezetben fejlődnek, az utóbbiak differenciálódási folyamatot indítanak el, és a kondro-specifikus fehérjék, az aggrekán és a porc oligomer mátrix fehérje (COMP), a kollagén II és X expressziós szintje jelentősen megnő, ez a jelenség tehát arra utal, hogy előnyösebb lenne a már differenciált őssejteket használni a sejterápia hatékonyságának növelésére [49]. A regeneratív orvoslás legújabb fejleményei az MSC-sejteket tökéletes jelöltvé tették a porc- és csontbetegségek kezelésében. Tehát az immunológiailag ko-stimuláló sejtfelszíni fehérjék expressziójának hiánya és a fő hisztokompatibilitási komplex (MHC) II alacsony expressziója gyengén immunogénvé teszi ezeket a sejteket; és immunszuppresszív és immunmoduláló tulajdonságokat biztosítanak számukra, nagyszerű kilátásokat nyitva az allogén MSC transzplantációkban [35].
Az OCD fejlődésének alapjául szolgáló kórélettani mechanizmusok
Az epiphysealis és metaphysealis növekedési lemezek fejlődése során az OC az endokondrális csontosodás zavart okoz, és a porc érésének későbbi kudarcát okozza, amely a behatoló kapillárisok hiányából származik a hipertrófiás növekedési lemez zónájába. Ekkor az endokondrális csontosodás megszakad, ami megvastagodott porcréteg megtartásához vezet. A növekedési lemez porcos komplexusa gyengül az alaprétegek avaszkuláris nekrózisa és OCH esetén subchondralis törésekként, subchondralis cisztákként és a porcszárnyak töréseként jelentkező elváltozások megjelenése miatt, kötődve az ízületek porcfoszlányainak idővel történő lekapcsolásához (3. ábra) [56].
A vázlatos ábrázolás az osteochondrosis elváltozások komplexének kialakulásáról lovaknál és a kapcsolódó patogenezisben részt vevő tényezőktől [1]
Bár számos tényező bevonása az OCD kialakulásába ma már széles körben elfogadott; az utóbbi években a kutatások a lovak OC korai patogenezisére összpontosítottak, hogy további részleteket szolgáltassanak eredetéről és kiváltó tényezőiről. Így a legvalószínűbb okként a porcos csatornák meghibásodása, az oszteokondrális csomópont biomechanikai nyírása, az endokondrális csontosodás molekuláris változásai és a genetikai alapok jelentek meg [57].
Annak ellenére, hogy a betegség pontos eredete nagyon összetettnek tűnik, egyértelműen meg lehet különböztetni az OCD patofiziológiai fejlődésének négy fő szakaszának diagramját. Az első szakaszban az OCD elváltozások a subchondralis csont szintjén kezdenek kialakulni, ahol egy nagy subchondralis intraosseous osteopenia zajlik. Másodszor ezek az elváltozások gyorsan együtt járnak a subchondralis csont intraosseous ödémájával. Az első stádiumú trabekuláris mikrofaktúrák valószínűleg csontverésként nyilvánulnak meg, korrelálhatnak a csontvelő oedematous morfológiai aspektusával. Az így megsérült szövet röntgenvizsgálattal látható szklerotikus gyűrűvé fejlődik, körülhatárolva az egészséges csontszövet elváltozásait és hordozva az osteonecrosisra utaló elváltozások központját. Másrészt a porc ebben a szakaszban még épnek tűnik. A betegség evolúciója a porc mechanikai tulajdonságainak későbbi lágyulásához és megváltoztatásához vezet, amely egy oszteokondrális fragmens felszabadulását és egyetlen laza test kialakulását vagy több, az OCD-re jellemző fragmens leválását eredményezi [58].
Vaszkuláris események a korai osteochondrosisban
A porcmátrix változásai
Molekuláris események
Ha az ízületi porcban, a meniscusban, az ínszalagban vagy az ízületi membránban változások következnek be, egyes molekulák felszabadulhatnak az ízületi folyadékban, míg a csontszövet biomarkerei általában a vérbe kerülnek, ha az ízület mögöttes csontja érintett [12]. ]. Az OCD fejlődésének molekuláris bázisainak tisztázása érdekében számos vizsgálat az ízületi megbetegedések során megjelenő különböző biokémiai változások, valamint a fő mátrix molekulák (II. Típusú kollagén, porc oligomer mátrix fehérje, nagy aggregátumú proteoglikánok, fibronektin, porcmátrixfehérje és biglikán) az epiphysealis porc nekrózisát eredményező korai elváltozások kialakulását követően [4]. Ezenkívül jelentős változásokat mutattak ki a kollagén és a proteoglikán metabolizmusában részt vevő porcforgalmi markerekben a szinoviális folyadék vagy a csikó szérumának OCD-vel történő elemzése során [66, 72].
Mátrix metalloproteinázok (MMP)
Porc oligomer mátrix fehérje
II típusú kollagén α-helikális régiójának peptidje (Coll2–1)
A közelmúltban a kollagén lebomlásának egyes markereit, például a Coll2–1-et bevitték az emberi és lógyógyászatba az ízületi betegségek értékelésére [91]. A Coll2–1 egy peptid ([92] HRGYPGLDG [93]), amely a II-es típusú kollagén molekula hármas spiráljában helyezkedik el, és az ízületi betegségekre jellemző, mivel csak a kollagén alkotóeleme. Az ízületeket érintő különféle patológiákban, mint például az OC (D) vagy az OA, a II. Típusú kollagén, amely a porc fő strukturális fehérjéje, amely az extracelluláris porcmátrix körülbelül 50% -át teszi ki, enzimatikus és mechanikus hatások által általában lebomlik, ami töredékek az ízületi folyadékban, például Coll2–1 [94, 95]. Korábban elemezték az OCD-ben a Coll2–1 szinoviális szintjét és a lovak normál tarsokrurális ízületeit. Az OCD-vel rendelkező lovak Coll2–1 szinoviális szintje szignifikánsan magasabb volt az egészséges lovakhoz képest, ami jelzi a porc degradációs folyamatának előrehaladását ezekben a sérült ízületekben; ezért feltételezik, hogy a Coll2–1 lehet egy korábbi és érzékenyebb marker, mint a C2C, ez a marker, amelyet hagyományosan a lovak porc degeneratív elváltozásainak kimutatására használnak [96].
Osteokalcin
Az oszteokalcin vagy a csont-Gla-fehérje (BGP) az oszteoblasztok és az odontoblasztok által szintetizált kis fehérje, amely karboxi-glutaminos részeket tartalmaz, és a nem kollagén csontmátrix nagy részét alkotja. Számos tanulmány kimutatta, hogy a szérum oszteokalcin számos csontbetegség esetén a csontanyagcsere hasznos markere lehet [97]. Az ásványosítási folyamat során a kalcium-foszfátot először a hipertrófiás zónában diszpergált sejtekből származó mátrix vezikulákba rakják le, majd egymást követő hidroxi-apatittá alakítják. Ezenkívül a kristályproliferáció sebességét elősegíti a kalcium, a foszfát, a kollagén bősége, és késleltetik a proteoglikánok és a nem kollagén fehérjék, amelyek rögzítik a kalciumot, például az osteocalcin. Az ásványianyag-gátlók túltermelése és hiperaktivitása, amelyet főként az osteocalcin képvisel, hibás meszesedéshez és porcvisszatartáshoz vezet, ami OC (D) változásokat és károsodásokat eredményez [50]. Sőt, azt találták, hogy a szérum osteocalcin koncentrációja szignifikánsan korrelál a csikók osteochondrosisának súlyosságával a születést követő első évben [98].
Kondroitin-szulfát 846 (CS-846)
A kondroitin-szulfát a porc proteoglikánok egyik alkotóeleme. A kondroitin-szulfát 846 (CS846) epitóp a kondroitin-szulfát oldalláncokon helyezkedik el a G3 domén közelében, és mint ilyen újonnan szintetizált agresszán molekulákat képvisel; felszabadul az extracelluláris mátrixból a szinoviális folyadékba, miután lehasadt az aggrecan fehérjéről. Ezek az agrekán nagy magzati formái természetesen jelen vannak a fiatal állatokban, de az életkor előrehaladtával csökken a porc [12]. A kondroitin-szulfát 846 (CS846) elválaszthatatlan jelzője az ízületi sérülés mértékének a DOD számos esetben. A glikozaminoglikánnal (GAG) rendelkező CS846 a proteoglikán lebontásának közvetlen biomarkere a porcmátrixban. A szérumban és a szinoviális folyadékban talált, különösen magas CS-846 szint, amely lineárisan korrelál az osteochondralis elváltozások súlyossági fokával, azt jelzi, hogy ez az epitóp szorosan összefügg az OC (D) -vel, és arra utalnak, hogy a patofiziológiai fejlődés során fokozottabb szintézis lép fel a porcos agregekánban és a II-es prokollagénben. az állapot [99].
Az oxidatív stressz hatása az OCD-fejlődés során
A reaktív oxigénfajok (ROS) felelősek lehetnek az ízületi porc számos kulcsfontosságú összetevőjének, nevezetesen a kollagén, a proteoglikánok és a hialuronán lebomlásáért [100]. Ízületi trauma bekövetkezésekor a sejt zavarai és az azt követő fagocita aktiváció serkentik a ROS termelését, ami súlyosbítja a traumás szövetkárosodást [101]. Ennek eredményeként úgy tűnik, hogy a ROS széles körben részt vesz az ízületi betegségek patogenezisében az embereknél, de az atlétikai lovaknál is [102, 103].
Mitokondriális diszfunkció és endoplazmatikus retikulum stressz
A közelmúltban kimutatták a mély porcszövetek mitokondriumainak és endoplazmatikus retikulumának rendellenességeit. Feltételezték, hogy a mitokondriális funkció kulcsszabályozója, a Wnt jelátviteli útjának megzavarása, amely jellemzően az OC lóporcára jellemző, részben felelős lehet a mitokondriális diszfunkcióért [108].
Az OCD kezelése
Az ízület egy olyan szerv, amely rendszeresen különböző traumás elváltozásoknak van kitéve, ami a benne lévő porc drámai és végleges lebomlásához vezet. A synovitis és a capsulitis gyors kezelése elengedhetetlen lépés az orvosi megközelítésben a porcos mátrix további lebomlásának csökkentése vagy megakadályozása érdekében. Az ízületi traumás entitások kezelését azzal a céllal írják le, hogy először gyorsan és hatékonyan állítsák vissza az ízületet természetes állapotába, másodsorban pedig megakadályozzák olyan súlyosabb szövődmények előfordulását, amelyek az ízületi szövetek pusztulásához vezethetnek. OCD esetén az orvosi kezelés az osteochondralis chipek töredékeinek eltávolítására, az uralkodó intraartikuláris törések csökkentésére és a ligamentos és meniszkuláris elváltozások pontos diagnosztizálására összpontosít [118].
A lovak OCD kezelésének legszélesebb körben elfogadott kezelési stratégiája az osteochondralis elváltozások műtéti eltávolítása. Ha azonban a minimális elváltozások korai életkorban érintik a csikókat, és nem okoznak aggodalomra okot adó klinikai tüneteket, az elhúzódó pihenés és a radiográfia elegendő az állapot orvoslásához. Az artroszkópos műtét ezért továbbra is szükséges a legsúlyosabb esetekben, amikor az állat sántasága és az érintett terület túlnyomó duzzanata figyelhető meg. Az eljárás során az érintett ízületet részletesen feltárják az összes lehetséges elváltozás felderítése érdekében. Ezután a sérült ízületek minden részét eltávolítják (laza szövetek és testek). Az eltávolítást addig végezzük, amíg csak egészséges szövet marad. Különös figyelmet kell fordítani a fiatal csikók eltávolításakor, hogy elkerüljük a subchondralis csont károsodását, amely ebben a szakaszban még puha [119].
Következtetés
- Fizikoterápia Linwoodban térd - Osteochondritis Dissecans
- Osteochondritis Dissecans - Tünetek; Kezelési csont és gerinc
- Ortomolekuláris Orto Molekuláris Peter s Ígéret Peter Leeds; Betegség; Fogyás
- A nyár nem fogy le a csalogány tevékenységeiről, a nyárról, nincs fogyás, a csalogány háttér
- Osteochondrosis (OCD) a lovak VCA állatkórházában