Szarvasmarha papillomavírus
A szarvasmarha-papillomavírus (BPV) egy kis, kör alakú, kettős szálú DNS-genom vírus, amely a Papillomaviridae családba tartozik, és tropizmust mutat a hám- és nyálkahártya szövetek számára.
Kapcsolódó kifejezések:
- Nemzetség
- Fibroblast
- Pteridium aquilinum
- Virion
- Fehérjék
- DNS
- Bimbók
- Hólyag
- Szarvasmarha-papillomavírus 1
- Equus
Letöltés PDF formátumban
Erről az oldalról
Szinergikus asszociációk a szarvasmarha papillomavírus fertőzés és az alimentáris kofaktorok között
R. Franco de Carvalho,. R. de Cassia Stocco, az élelmiszer-tudomány referencia moduljában, 2016
A szarvasmarha papillomavírus
A szarvasmarha-papillomavírus (BPV) egy kicsi, körkörös kettős szálú DNS-genomvírus, amely a Papillomaviridae családba tartozik, és amely tropizmust mutat a hám- és nyálkahártya szövetek számára. A BPV genom három régióra oszlik: korai (E), késői (L) és hosszú kodon régió (LCR), átlagosan 8 kilobázissal. Az E régió kódolja a vírus replikációjához szükséges fehérjéket, beleértve az E5, E6 és E7 onkoproteineket. Az L régió kódolja az L1 és L2 kapszid fehérjéket. Az LCR, más néven non-kodon régió, nem kódol egyetlen fehérjét sem; de replikációs origóval (ori) rendelkezik. Az egyes BPV fehérjék működését az 1. táblázat mutatja .
Asztal 1 . A szarvasmarhafélék papillomavírusának korai (E) és késői (L) fehérje funkciói
Fő kapszid fehérje
Legkonzerváltabb vírusfehérje
Heparin-szulfát-kötéssel elősegíti a vírusfertőzést
Vírusgenom szegregáció
ATP-függő helikázként működik
Vírusgenom nukleáris import
Az epizód karbantartása
E6 és E7 transzkripció szabályozás
Vírus DNS-pakolás a virion összeállításakor
Elősegíti a keratin megszakadását
Felelős a vírusos citopátiás hatásért
Elősegíti a PDGFβR dimerizációt
Indukálja az MHC-I és II visszaszorítását (immuncsalás)
Elősegíti az aktin citoszkeleton megzavarását
DNS-szüneteket (klasztogenezist) és neózist vált ki
Elősegíti a p53 visszaszorítását
Elősegíti a p53 lebomlását
Elősegíti az anyagcsere deregulációját, ami oxidatív stresszt eredményez
Elősegíti a sejtek transzformációját
PRb foszforilációhoz vezet, mitózist indukál
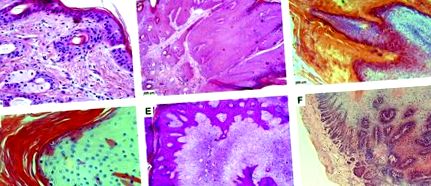
A BPV filogenetikai osztályozása az L1 DNS szekvencia homológián alapul, amelyet a genom leginkább konzervált nyitott olvasási keretének (ORF) tekintenek. E kritérium szerint már 15 BPV-t írnak le az irodalomban, amelyeket négy nemzetségbe sorolnak: Deltapapillomavírus (BPV-1, -2, -13 és -14), Epsilonpapillomavirus (BPV-5 és -9), Xipapillomavirus (BPV-3, -4, -6, -9, -10, -11, -12 és -15) és a Dyoxipapillomavírus (BPV-7). Ezek közül a BPV-1 és -2 a leggyakoribb vírustípus. A Deltapapillomavirus nemzetségbe tartozó BPV-1 és -2 mind a papillómákkal, mind a fibropapillomákkal együtt jár, a dermis érintettségével. Ezenkívül a húgyhólyagrákhoz kapcsolódnak, míg a BPV-4 a felső tápcsatorna papillóma és a karcinóma fertőző ágense. A jóindulatú (papilloma/fibropapilloma) és a rosszindulatú elváltozások különböző hisztopatológiai vonatkozásait az 1. ábra mutatja. .
1.ábra . Az (A) szarvasmarha-papillomavírus (BPV) által nem fertőzött normál bőr hisztopatológiai elemzése, amely morfológiai változás nélkül mutatja az epidermist és a dermist (5x objektív); (B) BPV-2-vel fertőzött bőrpapillóma, amely a szuprabazális réteg hiperproliferációját mutatja (acanthosis) (5x objektív); (C) a BPV-1-vel fertőzött bőr papilloma, amely ortokeratotikus hiperkeratózist mutat, a szaruhártyaréteg expresszív növekedésével és a hipergranulózissal igazolva, a szemcsés rétegben lévő kerato-hyalin szemcsék nagy mennyiségével igazolva (20 × objektív); (D) BPV-1-vel és -2-vel együtt fertőzött bőrpapillóma, amely szemcsés rétegben parakeratotikus és ortokeratotikus hiperkeratózist és koilocitákat mutat (objektív 40 ×); (E) BPV-1-vel és -2-vel együtt fertőzött fibropapilloma, amely fibroblasztikus proliferációt és reaktív stromát mutat (5x objektív); (F) szarvasmarha-nyelőcső carcinoma, amelyet BPV-1, -2 és -4 együttfertőztek, szövetdezorganizációt mutatva (5. célkitűzés).
A BPV-t nagyon érdekes modellnek írták le, mivel kölcsönhatásba lép a kofaktorokkal néhány onkogén betegség kialakulásában. Ezen interakciók közül a legjelentősebbet a szarvasmarha-hólyag és a nyelőcsőrák etiológiájában írták le. BPV-vel fertőzött és páfrányfenyőnek kitett állatokban, főként etetéssel, onkogén folyamatokat detektáltak. Érdekes módon a bracken hagyományosan szerepel Japán és Brazília egyes régióinak emberi étrendjében is, ahol tanulmányozták az onkogén potenciállal kapcsolatosan.
A cumik és a tőgy betegségei
Etiológia
A szarvasmarha-papillomavírusok (BPV) papillómákat (BPV6) vagy fibropapillómákat (BPV1 és BPV5) indukálhatnak. Noha ezek az altípusok a szarvasmarhák bimbó és tőgy szemölcsének klasszikus etiológiai leírását jelentik, a törpékön és a tőgyökön nemrégiben más törzseket (BPV 7, 8, 9 és 10, valamint feltételezett BVV4 és BAPV9 típusokat) találtak a közelmúltban. tejelő szarvasmarhák. A tejelő szarvasmarhák leggyakoribb elváltozása a BPV5 által okozott lapos „rizsszemű” fibropapilloma. A szálka alakú szemölcsöket, amelyeknek több hámnyúlványa van a bimbó vagy a tőgy bőrén, általában a BPV1 (cumik) vagy a BPV6 (tőgy) típusok okozzák. A lepke alakú típusok akkor a legproblémásabbak, ha a bimbóvégeken fordulnak elő. A szemölcsök fertőzőek, és elsősorban fejőgépek és fejő kezek terjesztik a vírust, amely aztán a bőrt megkopja a kopás területén. Egyre több bizonyíték van arra, hogy a BPV DNS még normális, egészséges szarvasmarha bőrében is megtalálható érzékenyebb, modern, molekuláris technikák alkalmazásával. Azok a vírusos és gazda-specifikus tényezők, amelyek meghatározzák, hogy az egyes szarvasmarháknak mikor és milyen mértékben alakulnak ki papillómák, még mindig bizonytalanok. Hasonlóképpen nem ismert például, hogy a BPV2 hogyan vesz részt például a hólyagfal tumorainak karcinogenezisében.
A cumik és a tőgy betegségei
Etiológia.
A szarvasmarha-papillomavírus (BPV) papillómákat (BPV6) vagy fibropapillómákat (BPV1 és BPV5) indukálhat. A tejelő szarvasmarhák leggyakoribb elváltozása a BPV5 által okozott lapos „rizsszemű” fibropapilloma. A bimbón vagy a tőgyön lévő szemcseméretű szemölcsöket általában a BPV1 vagy a BPV6 DNS-típus okozza, és úgy tűnik, hogy több hámnyúlványa van. Ez utóbbi típusok akkor a legproblémásabbak, ha a bimbó végén fordulnak elő. A szemölcsök fertőzőek, és elsősorban fejőgépek és fejők kezei terjesztik a vírust, amely aztán a bőrt megkopja a kopás területén. Egyre több bizonyíték van arra, hogy a BPV DNS még normális, egészséges szarvasmarha bőrében is megtalálható érzékenyebb, modern, molekuláris technikák alkalmazásával. Még mindig bizonytalanok azok a vírusos és gazda-specifikus tényezők, amelyek meghatározzák, hogy az egyes szarvasmarhákban mikor és milyen mértékben alakulnak ki papillómák, illetve hogyan és miért vesz részt a BPV2 a hólyagfal daganatok karcinogenezisében.
Neoplasia
Beth A. Valentine,. Emily E. Barrell, Farm Farm Surgery (második kiadás), 2017
Orális lágy szöveti daganatok
A szarvasmarha papillomavírusa által okozott papillóma előfordulhat a borjak szájnyálkahártyájában, beleértve az ajkakat is. Exofita polipoid és ülő növekedés látható, és a daganatok multicentrikusak lehetnek. A nyelv papillomatosisa Kínában a malacokban gyakori veleszületett elváltozás. A szájüregi papillómákkal szemben az orális laphámrák idősebb állatoknál fordul elő, és invazív destruktív daganat. A szájüreget érintő pikkelyes sejtes karcinóma gyakori a brazil szarvasmarháknál, és feltételezik, hogy a bracken páfrány lenyelése okozza. A bendő és a nyelőcső, valamint a szájüreg bevonása gyakori a brazil szarvasmarháknál. Az orális laphámsejtes metasztázis jellemző volt ezeken a szarvasmarhákon, és nem volt összefüggésben az elsődleges tumor megjelenésével. Az orális laphámsejtes karcinóma, amely metasztázisba léphet a helyi nyirokcsomókba és a tüdőbe, idős pocakos sertésekben fordul elő. A más helyeken található laphámsejtekhez hasonlóan az orális laphámrák a szilárd, fehér szövet fekélyes infiltratív növekedése. A klinikai tünetek a fogyás és a dysphagia. A fogíny és a nyelv érdaganatai fiatal borjaknál fordulnak elő, és születésükkor jelen lehetnek. Leggyakrabban ezek egyetlen húsos tömegek, amelyek felületesen fekélyesedhetnek.
A szövettani vizsgálat meg fogja különböztetni a papilloma viszonylag rendezett hámproliferációját a laphámsejt pleomorf és invazív hámjától. Az érdaganatokat jól differenciált kapilláris típusú erek csoportjai jellemzik egy rostos stromában. Nem világos, hogy ezek a daganatok jóindulatú neopláziát (hemangioma) vagy vaszkuláris hamartómákat képviselnek-e. Születésükkor való jelenlétük arra utal, hogy ez utóbbi a legvalószínűbb. A szájüregi daganatok ritkábban fordulnak elő kecskéknél és juhoknál. A kecskéknél jelentett orális daganatok amiloidtermelő odontogén tumor, limfóma, rhabdomyosarcoma és osztályozatlan szarkóma.
A vírusos papillómák jóindulatú elváltozások, amelyek leggyakrabban spontán visszafejlődnek. Ezen tömegek sebészeti kimetszése is gyógyító jellegű. A pikkelyes sejtes karcinóma a haszonállat-fajokban valószínűleg nem ismerhető fel egészen viszonylag késői fejlődési szakaszban, amikor a széles műtéti kivágás nehéz vagy lehetetlen. Az érdaganatok gyakran bizonyos fokú helyi beszűrődést mutatnak, és az állat növekedésével lassan megnagyobbodnak. A gyógyuláshoz gyakran széles sebészeti kimetszésre van szükség, és a krioterápia hatékony kezelésnek számolt be. Az íny odontogén daganatait széles kivágással gyógyítják. A szarkómák általában lokálisan invazívak; túl kevés információ áll rendelkezésre a metasztatikus potenciál leírására.
Szarkoidok
Derek C. Knottenbelt OBE BVM & S DVM & S Dip ECEIM MRCVS,. Katie L. Snalune BSc MA VetMB Cert EM (Int.Med.) Cert ES (lágy szövet) MRCVS, a lovak klinikai onkológiájában, 2015
A BPV átterjedhet-e a lovak között?
Sok kutató úgy véli, hogy a lóféléknél a BPV-fertőzés nem produktív, mert az intakt virionokat még soha nem sikerült detektálni a szarkoidokban elektronmikroszkóppal vagy immunjelöléssel; a szükséges sejtkörnyezet csak a szarvasmarhák jól differenciált keratinocitáiban létezhet. 34,45,101 A ló-ló és a szamár-szamár közötti átvitel látszólag zárt lóállományban történt (lásd 27.7. Ábra). 20,79,98 Ilyen körülmények között azonban a marháknak és a látens bőrfertőzésnek való korábbi kitettség nem zárható ki teljesen. Közvetlenebb bizonyítékot nyertek egy tanulmányban, ahol két BPV-1-asszociált szarkoidot tartalmazó szamarat párosítottak fertőzésmentes szamárral; ez utóbbi állatok szarkaidákat fejlesztettek ki, amelyek azonos genetikai szekvenciákat tartalmaztak a társukban talált vírussal (ez különbözött a párok között). 61
A szarvasmarha-papillomavírus -1 LI fő kapszid fehérje transzkriptumát a 20 szarkoid 50% -ában (19 szamárból) mutatták ki egy brit vizsgálatban. Egy újabb, Ausztriában végzett elemzés során a 21 szarkoid minta 58% -a pozitív volt a BPV-1 DNS-re, amelyet L1 fő kapszid fehérjékkel komplexáltak. Az említett neoplazmák közül kettőben a komplex DNS teljes hosszúságú, kör alakú BPV genom volt. 31 E vizsgálat eredményei nem jelezték, hogy ezek pre-vírusos struktúrák vagy teljesen összeállított virionok-e; azonban ismét felvetették annak lehetőségét, hogy ép virionok lehetnek a ló szarkoidjaiban. Korábban feltételezték, hogy ép virionok vannak jelen, de csak nagyon kis számban, vagy csak a neoplazma bizonyos fejlődési szakaszaiban korlátozódnak. 31,64 A nem produktív fertőzés sok esetben megmagyarázhatja egyes, ló-ló átterjedési vizsgálatok sikertelenségét szarkoid kivonat felhasználásával. 13,93
A legfrissebb kutatási eredmények alapján ezért lehetségesnek kell tekinteni a BPV átadását a lovak között, és megfelelő higiéniai intézkedéseket kell hozni, ha szarkoidos állatok vannak jelen. Az ilyen terjedés valószínűleg alacsonyabb mértékben fordul elő, mint a szarvasmarhák és a lovak között. 98
A tejelő bikákra jellemző vagy azokban előforduló betegségek
Etiológia
A pénisz fibropapillómákat a szarvasmarha papillomavírusai okozzák, és multinoduláris szemölcsökként jelentkeznek a fiatal bikák hüvelyi péniszén (10.15. Ábra és 9.20 A&B. Ábra). Úgy gondolják, hogy a pénisz szemölcsök a preputialis és a pénisz hám kopásainak vírusfertőzéséből származnak a szerelési és párzási viselkedés eredményeként. A pénisz fibropapillómák jelentősége az AIC-ben a pénisz kiterjedt traumájának lehetőségében mutatkozik meg a gyűjtés során, a spermaminta vérszennyeződésében a traumától a tömegig, valamint a pénisz külsején kívüli behelyezésének és a gyűjtőfelületnek a pénisz kényelmetlensége miatt való vonakodása szemölcs.
Szembetegségek
Etiológia és jelek
A szarvasmarha papillomavírusai által okozott fibropapillómák, „szemölcsök”, „szarvak” és más proliferatív hámelváltozások a leggyakoribb daganatok, amelyek borjak és fiatal szarvasmarhák szemhéját érintik. A legtöbb esetben a daganatok megemelkedtek, szilárd tömegűek, szürke kérges burkolatokkal (14.22. Ábra) (lásd még: 7.1, 7.2 és 7.3. Ábra 7.1. Ábra 7.2. Ábra, 7.3. Ábra). A probléma a legtöbb esetben önkorlátozó.
A limfoszarkóma ritkán beszivárog a szemhéjakba, de amikor mégis bekövetkezik, akkor diffúz szemhéjduzzanatként jelentkezik kötőhártya kemózissal (14.23. Ábra).
A pikkelyes sejtes karcinóma a leggyakoribb daganat, amely a felnőtt szarvasmarhák egyikének vagy mindkét szemének a szemhéját és a niktáló membránt (nictitans vagy harmadik szemhéj) érinti (14.24. És 14.25. Ábra), de a szarvasmarhák szemhéjában alkalmanként más neopláziákat is észlelnek. A fehérarcú húsmarhák és a holsteinek, amelyek többnyire fehérek, vagy nem pigmentált szemhéjperemek vagy niktitánok vannak veszélyben, de az SCC bármely fajtánál megfigyelhető. A túlnyomórészt tejipari gyakorlatban az SCC-ben („rákos szem”) szenvedő szarvasmarha-betegek többsége holstein. A daganatok klasszikusan rózsaszínűek, felemelkedtek vagy fekélyesek, macskakő megjelenésűek, és leggyakrabban középkorú (5–10 éves) teheneknél jelentkeznek. A pikkelysmr krónikus szemhéj fekélyként is jelentkezhet; lapos, scablike elváltozások; nem gyógyuló sebek vagy fekélyek; vagy szemhéjszerű kinövések a szemhéjon vagy a szemhéj szélén (hámsejtek, keratómák, keratoacanthomák, papillómák, in situ carcinoma) (14.26. ábra A). A diagnózis megerősítéséhez hisztopatológia ajánlott; citológia alkalmazható, de nem végleges, mert a reaktív, gyulladt hámsejtek egyes esetekben összetéveszthetők a neoplasztikus sejtekkel.
A reproduktív traktus rendellenességei
Fertőző körülmények
A mének hímvesszőit érintő leggyakoribb fertőzések a habronemiasis, az EHV-3 és a szarvasmarha-papillomavírus (BPV). A Habronema spp. Másodlagos bőrgyógyászati elváltozásai és az Onchocerca cervicalis mikrofilária jellegzetes elváltozásokat eredményez, amelyeket általában „nyári sebeknek” neveznek. A habronemiasis diagnosztizálása általában egyszerű azáltal, hogy megfigyeli a húgycső folyamatának, hüvelyének és hüvelyének jellegzetes elváltozásait. Az ivermektinnel végzett enterális és lokális terápia gyakran hasznos. Az érintett lovak hajlamosak a kiújulásra, és a súlyosan érintett lovak számára előnyös lehet a kortikoszteroidokkal történő kezelés. Míg a habronemiasis előfordulása az avermektin féreghajtók megjelenésével és mindenütt történő használatával gyengült, ez a betegség az utóbbi években enyhe újbóli kialakulást mutatott, amelyet legalább részben a szervezetek közönséges féregtelenítőkkel szembeni lehetséges ellenállásának tulajdonítottak.
Az EHV-3 által okozott coitalis exanthema fertőző nemi betegség, amely méneket és tenyészkancákat érint. Jellegzetes elváltozásokat okoz, és mind a lovak, mind a fomitesek könnyen átvihetik. Az EHV-3 és más nemi betegségeket külön szakasz tárgyalja.
A BPV-vel való fertőzés érdekes fogalom, mert szerepet játszik a ló szarkoidjainak megjelenésében. 1029 Következésképpen a helyi vírusellenes szerekkel (pl. Aciklovirral) történő kezelés előnyös lehet a növekedés megállításában és akár a növekedés csökkentésében.
- Brood Cells - áttekintő ScienceDirect témák
- Hajdina liszt - áttekintés a ScienceDirect témákról
- Anorexigenikus szer - áttekintés a ScienceDirect témákról
- Vízi terápia - áttekintés a ScienceDirect témákról
- Aphthous Stomatitis - áttekintés a ScienceDirect témákról