Széklettranszplantációk: Mi kerül átadásra?
Diana P. Bojanova
1 Biológiai Tudományok Tanszék, Vanderbilt Egyetem, Nashville, Tennessee, Amerikai Egyesült Államok
Seth R. Bordenstein
1 Biológiai Tudományok Tanszék, Vanderbilt Egyetem, Nashville, Tennessee, Amerikai Egyesült Államok
2 Patológiai, Mikrobiológiai és Immunológiai Tanszék, Vanderbilt Egyetem, Nashville, Tennessee, Amerikai Egyesült Államok
Absztrakt
A széklettranszplantációkat egyre inkább alkalmazzák az emberi bélben visszatérő fertőzések (azaz a Clostridium difficile) kezelésére, valamint állati modellekben a funkciónyereség-kísérletek (azaz a székletpelletek záporozásának) általános kutatási eszközeként. A recipiens biológiájában megfigyelt változásokat rutinszerűen a donor ürülékében található baktériumsejteknek tulajdonítják (
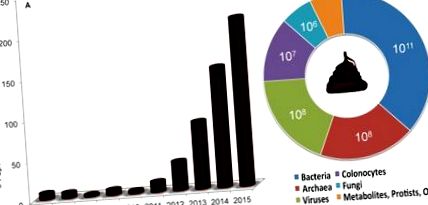
10 11/gramm emberi nedves széklet). Itt megvizsgáljuk az irodalmat és összefoglaljuk a székletanyag összetételére vonatkozó megállapításokat annak érdekében, hogy óvatosan felhívjuk a figyelmet a többrészes jellegére. Az életképes baktériumok mellett, amelyek a teljes ürülék kis részét tehetik ki, a feldolgozatlan emberi ürülék egyéb komponensei közé tartoznak a vastagbélsejtek (
Nedves széklet grammonként 10 7), archeák (
Nedves széklet grammonként 10 8), vírusok (
Nedves széklet grammonként 10 8), gombák (
10 6/gramm nedves széklet), protiszták és metabolitok. Így bár ezen a ponton spekulatívak, és függenek a transzplantációs eljárástól és a vizsgálati rendszertől, a nem baktériumellenes anyagok hozzájárulhatnak a befogadó biológiájának változásához. Óvatosan szükség van a folyamatos redukcionizmusra az egyes komponensek hatásainak és kölcsönhatásainak elkülönítése érdekében.
Bevezetés
A széklettranszplantáció - a széklet vagy a széklet egy-egy szervezetből a másik gyomor-bélrendszerébe történő átvitele - gyorsan figyelmet kap az emberi bélfertőzések kezelésére és az állati mikrobiota funkcionális "beütési" vizsgálatának eszközeként. modellek. Embereknél az eljárást széklet mikrobiota transzplantációnak nevezik, mivel a mikrobiális komponensek jellemzően gazdagodnak, és állatmodellekben a feldolgozatlan széklet transzferjét általában a széklet anyagának etetésével vagy szájon át történő szoptatásával érik el. Ennek az esszének a célja az, hogy a „székletátültetések” mindenre kiterjedő kifejezést használjuk minden típusú eljárásra. Az 1. ábra a kifejezés legutóbbi növekedését mutatja be a PubMed referenciákban, humán és modellrendszeri vizsgálatokkal együtt.
A diagramok mutatják (A) a székletátültetésekkel kapcsolatos publikációk gyors növekedését a Nemzeti Orvostudományi Könyvtár keresőszolgálatában (PubMed), különösen 2012 és 2015 között, és (B) a biológiai entitás becsült felső koncentrációját egy feldolgozatlan emberi ürülék grammonként., ahogyan azt a szöveg idézi. A becslések nem feltétlenül tükrözik a biológiai entitás életképes számát, és az archeák koncentrációját egy metanogén légzési teszt alapján becsüljük meg, amely nem kizárólag az archeák jelenlétén alapul. A metabolitok, a protiszták és más entitások koncentrációját nem sikerült azonosítani.
Számos elemzés a Clostridium difficile fertőzés (CDI) klinikai megoldásáról számol be [1–5], bár a transzplantációk hosszú távú hatásai nem ismertek [6]. Az előzetes eredmények az inzulinérzékenység [7], a sclerosis multiplex [8] és a Crohn-betegség [9] tekintetében is pozitív eredményeket mutatnak be. Az ezeket a feltételeket összekötő feltételezett elem a bél baktériumközössége, és így a kezelés sikere lelkesen a bélbaktériumok körül forog, amelyekről feltételezik, hogy többnyire életképesek a székletben. Néhány tanulmány egereken és embereken igazolja a tenyésztett baktériumok CDI-re [10,11] és a nyálkahártya-gátló funkcióra gyakorolt pozitív hatásait [12]. Ezenkívül az emberi széklet mikrobiális része mikroszűréssel [13,14], spórafrakcionálással [15] és sűrűséggradienssel [16] erősen dúsítható más székletanyagból.
Itt kísérletileg hangsúlyozzuk, hogy az életképes baktériumok nem lehetnek az egyetlen szereplői a donor ürülékének, amely befolyásolja a befogadó biológiáját, ezt a tényt a szakértők is nagyra értékelik. A feldolgozatlan ürülékben potenciálisan előfordulhatnak olyan vírusok, archeák, gombák, állati kolonociták, protisták és számos metabolit, amelyet a kommenzális baktériumok előállítanak vagy attól függenek. Itt hangsúlyozzuk a széklet összetételének elemzésében és különféle kísérletekben látható mintákat, amelyek megvilágítják a széklet egyes komponenseinek funkcionális hatásait. Kiemelünk olyan fontos és kezelhető kérdéseket is, amelyek esetében a további redukcionizmus hozzájárulhat a székletanyag alkotóelemeinek előnyeinek dekonstrukciójához.
Széklet összetétele
Az emberi széklet összetételét nem vizsgálták intenzíven. Az összetételt vizsgáló tanulmányok többnyire az 1970-es és 1980-as évekből származnak, és eltérő eredményeket közölnek, talán az étrend és az egészség változása miatt. A felnőttek székletének átlagosan 75% -a víz és 25% -a szilárd anyag [17]. A szilárd anyag túlnyomó része szerves anyag, amelynek felépítése 25% –54% mikrobiális sejtből áll (kis része valószínűleg vírusokból áll), amelyek lehetnek életben vagy elhaltak [18]. Mivel a mikrobiális számlálás fénymikroszkópián és a Gram-festés módosításán alapult, feltételezzük, hogy a mikrobasejtek többnyire baktériumok [18], de minőségi bizonyítékok hiányoznak. Számos egyéb komponens található meg jelentős koncentrációban, köztük archeák, gombák és mikrobiális eukarióták. A csecsemőkön, felnőtteken és időseken átívelő betegek 95,7% -ánál kimutattak egy metanoarchaeon-fajt, a Methanobrevibacter smithii-t [19], és ez az összes széklet-anaerob akár 10% -át is magába foglalhatja [20]. Az életképes vastagbélsejteket szintén könnyen izolálják az újszülött és felnőtt székletből [21–23]. A széklettranszplantációk sikeréhez való lehetséges hozzájárulásukról nem számoltak be. Ezen becslések független validálására van szükség, különösen olyan mérésekre, amelyek egyszerre veszik figyelembe az összes entitást.
Míg a transzplantáció bizonyos esetekben rendkívül hatékony kezelés lehet, továbbra is aggodalmak vannak a patogén mikrobák hipotetikus együtttranszferjével kapcsolatban [24]. A környezeti mikrobák által okozott szennyeződés szintén kockázatot jelent a donor székletének gyűjtése, tárolása és kezelése során, amint az a transzfúziós vérraktározás korai szakaszában látható [25,26]. A laboratóriumi protokollok egységesítése és a székletanyag stabilitásának fokozása érdekében az egyik lehetőség a szigorúan átvilágított önkéntesek fagyasztott donoranyagának felhasználása. Számos tanulmány összehasonlította a fagyasztott és a friss széklet hatékonyságát a visszatérő vagy refrakter CDI-vel, és alig vagy egyáltalán nem számoltak be különbségről [14,27,28]. A székletadományozók kiterjedt longitudinális szűrése elengedhetetlen a kezelés hosszú távú sikerének nyomon követéséhez, és az átadott székletanyag további metagenomikai vizsgálata és a befogadók számára való jártasság igazolása szükséges.
Baktériumok
Más tanulmányok azt sugallják, hogy a gazda genotípusa és a mikrobiota közötti kölcsönhatások potenciálisan befolyásolhatják a transzplantációs eredményeket. Tanulmányok gyűjteményében a rokon donoroktól származó emberi széklet adományai valamivel nagyobb felbontást mutattak a CDI-esetekben (93%), mint a rokon donoroké (84%) [34]. Ez a megfigyelés figyelemre méltó annak a közelmúltbeli megállapításnak a fényében, miszerint az emberi genetikai variáció szignifikánsan korrelál a baktériumközösség összetételének változásával [35,36]. Egy nemrégiben készült metaanalízis azonban nem mutatott szignifikáns különbséget a hatékonyságban a rokon és a rokon donorok között [37]. Ezenkívül egy placebo-kontrollos vizsgálat eredményét kilenc ember közül héten sikeresen kezelték, akik egyetlen, független donortól kaptak transzplantációt [38]. Így az eddigi bizonyítékok arra utalnak, hogy a rokonság vagy alig vagy egyáltalán nem befolyásolja a CDI kezelését.
Annak bizonyítására, hogy a baktériumok közvetlenül hozzájárulnak a betegség feloldásához, több kutatócsoport tesztelte, hogy a székletanyag dúsított baktériumrészei hatékonyak-e a CDI kezelésében egerekben és emberekben. Egy hatfajta koktélterápia elnyomta az ismétlődő CDI-t az egerek 92% -ánál [10], amikor baktériumfajonként körülbelül 1010 sejtet vezettek be a befogadókhoz. Egy másik egérvizsgálat során egyetlen baktérium izolátum, a Lachnospiraceae D4 108 telepképző egysége 10-szeres csökkenést okozott a C. difficile kolóniaképző egységek számában a székletüreg grammonként [39]. A nontoxigén C. difficile spórák koktélját szintén sikeresen alkalmazták a CDI megismétlődésének elnyomásában egy emberi kísérletben [40]. A kezelés 26. hetében a különböző kezelési csoportokból származó betegek csak 0–5% -ánál maradt toxigén C. difficile a székletben. Ezek a vizsgálatok azt mutatják, hogy a tenyésztett baktériumok bizonyos esetekben hatékonyan hozzájárulhatnak a CDI-betegség feloldásához.
Vírusok
Az eukariótákból, baktériumokból és archeákból származó vírusok a bél mikrobiotájának kevésbé vizsgált komponensei, mint a baktériumok. Öt székletminta alapján a becslések azt mutatják, hogy a vírusbőség 10 8-10 109 vírus között mozog székletben (nedves tömeg), és az átlagos vírus-baktérium arány 0,13 [41]. Ezek a becslések összehasonlíthatóan alacsonyak azokhoz, amelyeket más olyan környezetekben jelentettek, ahol a vírus/mikrobiális sejt aránya 1,4 és 160 között mozog [42], ami alátámasztja azt a kialakuló nézetet, hogy a vírusok mérsékeltebb életmódot mutatnak a bélben [43,44]. Ezenkívül egy nemrégiben végzett metagenomikai vizsgálat kimutatta, hogy a széklettranszplantációk során számos mérsékelt éghajlatú fág kerül átvitelre [24]. A prófágák gyakran segítenek a behatoló kórokozók visszaszorításában, a közösség szerkezetének modulálásában és a bél homeosztázisának fenntartásában [44]. A mérsékelt égövi vírusok dominanciája azonban az egészséges kontroll székletre jellemző, mivel a bélbetegségekben szenvedő betegeknél nagyobb mennyiségű virulens fág lehet [45]. Az egyik legelterjedtebb, konzerváltabb és legelterjedtebb bakteriofág az emberi bélben a crAssphage [46], amely megállapítás azt sugallja, hogy egyes fágok erősen konzerválódhatnak az emberi populációban.
Aktívan mérlegelik a bakteriofágok emberi egészségre gyakorolt hatását. A fágterápia magában foglalja egy adott baktériumot megcélzó fágok (vagy azok antibakteriális enzimjeinek) izolálását és beoltását. Noha nem minden fágkezelés hatékony [47], számos in vitro és in vivo kísérlet sikeres volt. A CDI kezeléseként 108 plakkképző egységet/ml specifikus fágot viszünk be egy emberi vastagbél-modellbe. 35 napos időszak alatt a kezelés a vegetatív C. difficile sejtek jelentős csökkenését okozta (bár a C. difficile spórák növekedése volt megfigyelhető), valamint a toxintermelést a vizsgálat kimutatási küszöbértéke alatti szintre [48]. A kontroll replikátumok mind vegetatív sejteket, mind toxint tartalmaztak magas koncentrációban. A CDI fágterápiája egy hörcsögmodellben szintén jelentősen késleltette a baktériumok kolonizációját és a tünetek megjelenését [49]. A specifikus fág-koktélok elméletileg lehetővé tehetik a C. difficile-val versengő kommenzális baktériumok számára a bélben való visszatáplálást [50]. Míg a C. difficile fágok végül terápiás ágensekké fejleszthetők, még nincs bizonyíték arra, hogy a C. difficile-re jellemző fágok átkerülnének a széklettranszplantációkba.
A fágterápia biztonságosságával kapcsolatban számos aggály merült fel. A félelem enyhítésére egy nemrégiben végzett humán klinikai vizsgálat orálisan oltott be egy 15 alanyból álló csoportot 17 fágcsoport nagy dózisával, amelyek az Escherichia coli és a Proteus fertőzést célozták meg, és nem találtak káros hatásokat [51]. A fágterápiás koktélok folyamatosan bizonyították a specifikus virulens baktériumok megcélzását és eltávolítását, miközben elkerülik az antibiotikumokra jellemző káros hatásokat (pl. Rezisztencia, hasmenés stb.) [52–54]. A potenciális hátrány azonban a baktériumok fágokkal szembeni rezisztenciájának kialakulásának kockázata [55,56], bár a fágok potenciálisan ellensúlyozó mechanizmusokat képesek kifejleszteni. Ezenkívül a fágterápiával végzett humán vizsgálatok eddig viszonylag kicsiek. Nagyobb betegcsoportokra és további vizsgálatokra van szükség a fágdózisok, a fág-gazdatartomány alakulása és a baktériumok rezisztenciája [56], valamint a fágalapú gyógyszerek stabilitása szempontjából.
Archaea és gombák
Humán kolonociták
Érdekes módon a vastagbél életképes hámsejtjeit vagy vastagbélsejtjeit legfeljebb 10 7/g nedves székletanyag koncentrációban lehet izolálni [23]. Az életképes vastagbélsejteket hatékonyan izolálták újszülött székletmintákból (életképes> 80%) [21] és vastagbél kriptákból származó biopsziás mintákat (> 98% életképes) [22]. Az izolálás a kolonociták rugalmas képességének köszönhető, hogy gömb alakúvá válnak és túlélik, miután hámlik a székletáramba [69]. Így életképességük és részleges funkcionalitásuk valószínűleg megmarad egyes transzplantációs kezelések során, különösen olyan állatmodellekben, amelyek székletanyag etetését vagy szájon át történő szoptatását alkalmazzák.
Azáltal, hogy fizikai gátként hatnak a baktériumok és a gazda belső szövetei és szervei között, a vastagbélsejtek lehetővé teszik a gazda toleranciáját a bél mikrobiotájában [70]. Magas vastagbélhalál esetén a közvetítő szerepük felbomlik a megnövekedett béláteresztő képesség miatt [71]. Valójában a bél fő kóros állapotai összefüggenek a vastagbél hám növekedésének és funkcióinak változásával [22,72], hasonlóan a mikrobiota vizsgálatokban gyakran megfigyelt változásokhoz. Helyreállításuk kulcsfontosságú az ilyen körülmények közötti sikeres felépülésben. Egy nemrégiben készült tanulmány egészséges életképes vastagbél őssejteket ültetett át felületi vastagbélkárosodással rendelkező immunhiányos egérmodellbe, és megállapította, hogy a sejtek könnyen integrálódtak, és az epithelium egyetlen rétege teljesen beborította a vastagbélsejtek hiányát [73]. A vastagbél őssejtjeinek jelenlétét a székletben még nem kell rögzíteni, bár az egyik tanulmány kinyerte az őssejteket a vastagbél hámjából, amely gyakran a székletáramba hullott [74]. Ha vastagbél őssejteket azonosítanak az ürülékben ember- vagy állatmodellekben, azok befolyásolhatják a transzplantációk sikerét, ha befogadhatnak befogadóba.
A vastagbélsejtek mellett olyan molekulák, mint az immunglobulin A (IgA), működhetnek a bélhám első védelmi vonalaként [75]. Az IgA megerősíti a bélgátat, és megvédi a gazdasejteket a bélben található kórokozóktól és bélben oldódó toxinoktól [75]. Például az IgA szignifikánsan gátolta a C. difficile toxin kötődését a hörcsög bél kefe határhártyáin a kontrollhoz képest [76]. Hasonlóképpen, az emberi hámsejtvonalak, amelyek felületére IgA-t adtak, a C. difficile-hoz társuló patológia csökkenését mutatták az IgA-hiányos sejtekhez képest [77]. Még várat magára, hogy előnyös-e az IgA közvetlen bevezetése emberi alanyokba.
Metabolitok
Köztudott, hogy a rostot a bélbaktériumok metabolizálják rövid láncú zsírsavak (SCFA) előállítására, amelyek kiemelkedő gyulladáscsökkentő és T-sejt-indukáló tulajdonságokkal rendelkeznek a vastagbélben [78–80]. A rost erősen hozzájárul a széklet tömegéhez, és az alacsony rosttartalmú étrend egereknél visszafordíthatatlan veszteséget okozhat a baktériumok sokféleségében [81]. Míg a hiányzó rostok közvetlen visszahelyezése ebben a vizsgálatban nem állította helyre a sokféleséget, a magas rosttartalmú étrendű egerekből származó transzplantációk igen. Ezenkívül az alacsony rosttartalmú étrend „mikrobiális éhezéshez” vezet, amikor az egyszer kommenzális baktériumok megtámadják a bélbélést [82]. A C. difficile-fertőzött hörcsögökkel végzett vizsgálatban használt rost-kiegészítőknek azonban sikerült jelentősen módosítaniuk a szisztémás tünetek megjelenési idejét [83]. A rostbevitel összefüggésben van a megnövekedett mikrobiális sokféleséggel és az emberek csökkent elhízásával is [84,85].
Összegzés
Itt óvatosan megjegyezzük, hogy a baktériumok, akár életképesek, akár életképtelenek az átvitt székletanyagban, nem biztos, hogy a donor székletében az egyetlen olyan játékos játszik szerepet, amely befolyásolja a befogadó biológiáját. Egyrészt a baktériumok CDI-re vagy olyan állatmodell-tulajdonságokra gyakorolt hatása, mint az elhízás [100] és a toxintolerancia [101], eddig jól megalapozottnak tűnik. Másrészről, egy tágabb összefüggésben, ahol a széklettranszplantációkat kizárólag állatmodell-vizsgálatokban és más emberi betegségekben hasznosítják, az ésszerű redukcionizmus indokoltnak tűnik a széklet bonyolult természetének korlátozott megértése fényében. A székletanyag alkotórészeinek előnyeinek és kölcsönhatásainak dekonstrukciója tisztázni fogja ezen komponensek relatív jelentőségét és okozati összefüggését, valamint a specifikus terápiák lehetséges fejlesztését.
Főbb pontok és jövőbeli irányok
Néhány tanulmány baktériumok koktéljaival állatmodellekben és emberekben a CDI elnyomását mutatja. Ezek a tanulmányok azonban előzetesek és korlátozottak.
Bakteriális célzás révén a fágterápia potenciálisan kiküszöböli a virulens baktériumokat a megbetegedett bélben, és lehetővé teszi a kommenzális baktériumok számára, hogy felújítsák.
A vastagbélsejtek megakadályozzák a baktériumok belső szövetekbe és szervekbe történő transzlokációját; az egészséges életképes vastagbél őssejtek egérmodellbe történő transzplantációja a felületi vastagbélkárosodás helyrehozását eredményezi.
A metabolitok táplálják a kolonocita gátat és a bélbaktériumokat. A metabolitok orális beadása enyhítheti a gyulladást, a nyálkahártya károsodását és a sclerosis multiplex tüneteit. Becslések szerint azonban a disztális vastagbélben termelődő SCFA-k csak 5% -a ürül ki az ürülékbe [102]. Ennélfogva a metabolitkoncentrációk valószínűleg sokkal alacsonyabbak, mint az orális beadási vizsgálatokban alkalmazott koncentrációk.
Az archeák és a gombák gyakoriak a székletben. Habár a bél archeák és bizonyos gombák magas koncentrációi összefüggésben vannak mind a bél, mind az autoimmun betegségekkel, okokozó hatásuk nem ismert.
Az emberi genetikai rokonság alig vagy egyáltalán nem befolyásolja az emberi ürüléktranszplantációk hatékonyságát, bár a genetikai tényezők alakítják a baktériumok közösségének összetételét.
A székletanyag egyes komponensei egészségügyi előnyökkel járhatnak, és szinergikusan működhetnek a homeosztázis helyreállításában. Óvatosan szükség van a folyamatos redukcionizmusra, hogy megértsük a különféle székletkomponensek pontos előnyét és kölcsönhatásait.
Köszönetnyilvánítás
Köszönjük Sean Daviesnek, Ken Lau-nak, Vincent Young-nak, Kevin Kohl-nak, Mike Sadowskinak és Joseph Zackular-nak, hogy hasznos visszajelzéseket nyújtottak a kézirattal kapcsolatban.
Rövidítések
| CDI | Clostridium difficile fertőzés |
| IgA | immunglobulin A |
| SCFA | rövid láncú zsírsavak |
Finanszírozási nyilatkozat
Ezt a munkát a National Science Foundation Awards DEB 1046149 és az IOS 1456778 támogatta. A finanszírozóknak nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a közzétételre vonatkozó döntésben vagy a kézirat elkészítésében.
- Széklettranszplantációk, probiotikumok és mikrobióm Mit kell tudni - ABC News
- A széklet mikrobiom transzplantációja korlátozza a súly visszanyerését - ISRAEL21c
- Tényellenőrzés az orosz elnök lányának COVID-19 miatt beoltott videójáról. Nem, ez nem az
- Evés és megevés A békák ökológiai szerepe HowStuffWorks
- A vegetáriánus lét hátrányai LoveToKnow