Vessen egy pillantást a legújabb cikkekre
Zsírmáj és n-3 zsírsavak lenyelése: Új mechanizmusok és perspektívák a preklinikai állatmodellekből
Amanda Marreiro Barbosa
Többközpontú élettudományi diplomás program, Biológiai Tudományok Központja, Santa Catarina Szövetségi Egyetem (UFSC), Florianópolis, Brazília
Thayz Rodrigues Chagas
2Tanulmányi diploma, Egészségtudományi Központ, Santa Catarina Szövetségi Egyetem (UFSC), Florianópolis, Brazília
Everson Araújo Nunes
Többközpontú élettudományi diplomás program, Biológiai Tudományok Központ, Santa Catarina Szövetségi Egyetem (UFSC), Florianópolis, Brazília
2Tanulmányi diploma, Egészségtudományi Központ, Santa Catarina Szövetségi Egyetem (UFSC), Florianópolis, Brazília
Absztrakt
Az alkoholmentes zsírmájbetegséget (NAFLD) a lipidek felhalmozódása jellemzi, amelyet a szintézis, a lenyelés, az oxidáció és az exportáló zsírsavak egyensúlyhiánya okoz. A magas lipid- vagy szénhidráttartalmú étrendet és túlzott glükokortikoidokkal történő kezelést alkalmazó állatmodellek utánozták a máj steatosisának változásait. Az n-3 többszörösen telítetlen zsírsavak (EPA-eikozapentaénsav és DHA-dokozahexaénsav) alkalmazásával végzett táplálkozási beavatkozások kimutatták, hogy képesek csökkenteni a máj steatosisát, különösen a lipogén enzimek aktivitásának csökkentésével és a-oxidációs fluxus növelésével. Ezen a területen új mechanizmusokat, például az oxidatív enzimek aktivitását és az endokannabinoid rendszer tónusának változását vizsgálták e hatások tisztázása érdekében. Ezenkívül új tanulmányok tárgyalták az új EPA és DHA specifikus molekuláris célok vizsgálatát.
Kulcsszavak
máj steatosis, máj, anyagcsere, n-3 zsírsavak, preklinikai modellek
Bevezetés
Az alkoholmentes zsírmájbetegség (NAFLD) a fejlett országokban a krónikus májbetegségek egyik leggyakoribb formája, amely az általános népesség 20-30% -át érinti [1-3]. Ezt a betegséget a túlzott zsír patológiás felhalmozódása határozza meg a májban alkoholfogyasztás nélkül, mint például a zsír trigliceridek (TG) felhalmozódása a zsírsavak kiegyensúlyozatlan felvétele, szintézise, exportálása és oxidációja miatt [4,5]. Ezt az állapotot máj steatosis, májsejtek sérülése és lobularis hepatitis jellemzi [4].
Az elhízás fontos kockázati tényező a NAFLD kialakulásában, főleg a zsigeri zsír felhalmozódásában, ezért az inzulinrezisztencia felelős lehet a NAFLD kialakulásáért még nem elhízott és sovány egyéneknél is [6-8]. A NAFLD patogenezise azonban nem teljesen világos. Számos mechanizmusról van szó, mint például az aberrált lipid-anyagcsere, a szabályozatlan citokintermelés, az oxidatív stressz és a májsejtek gyulladása [9-12].
A máj lipidtartalmában szerepet játszó egyéb tényezők közé tartozik az étrend, a de novo máj lipidszintézise és a genetikai tényezők [13-16]. Ilyen gondolkodásmódot követve a májbetegség etiológiájának, fejlődésének, előrehaladásának és kimenetelének reprodukálásához általában állat alapú kísérleti modelleket alkalmaznak, például magas kalóriatartalmú étrend-bevitel (túltáplálás), magas zsírbevitel (különösen telített zsírsavak), magas egyszerű cukrok bevitele és cafeteria diéta [17-21]. Ezenkívül egyes farmakológiai beavatkozások szintén okozhatják a NAFLD-t. A szintetikus glükokortikoidok (GC) olyan anyagok, amelyek utánozzák az endogén szteroid hormonokat, amelyeket a mellékvesekéreg szekretál a hipotalamusz-agyalapi mirigy-mellékvese (HPA) tengely aktiválásakor. Hozzájárulhatnak a metabolikus szindróma kialakulásához. A szintetikus GC-ket általában gyulladáscsökkentőként alkalmazzák. Hosszabb ideig vagy nagy dózisban történő alkalmazása azonban olyan mellékhatásokat okozhat, mint a súlygyarapodás, az inzulinrezisztencia, a hipertrigliceridémia, a hyperphagia és a központi elhízás [22-26].
Bár az étrend vagy a szintetikus glükóz-bélfogyasztás által okozott máj lipid felhalmozódásában szerepet játszó kórokozó mechanizmusok nem teljesen ismertek, néhány tanulmányt végeztek olyan adjuváns stratégiák felkutatására, amelyek csillapítják az ebben az anyagcserezavarban bizonyított változásokat, mivel a többszörösen telítetlen zsírsavak (PUFA-k) bevitele [27-30].
A zsírsavak számos sejt tulajdonságát befolyásolhatják, megváltozott anyagcserét, génexpressziót, módosított reakciót a hormonokra és a biológiailag aktív anyagok termelési szokásait. Ezért a zsírsavak módosíthatják a fiziológiai funkciókat, és potenciálisan hasznosak lehetnek az egészség és a jólét elősegítésére [31].
Ezenkívül egyes bizonyítékok arra utalnak, hogy a PUFA omega-3 (főleg eikozapentaénsav (EPA) és a dokozahexaénsav (DHA) hozzájárulhat számos anyagcsere-diszfunkció javításához (pl. Növeli a glükóz toleranciát, az inzulinérzékenységet és csökkenti a kockázatokat krónikus nem fertőző betegségek és metabolikus szindróma tényezői [32-39].
Ezenkívül egy nemrégiben készült tanulmány kimutatta, hogy a tisztított EPA-nak és a DHA-nak különböző hatása van az étrend okozta betegség aterogén, magas zsírtartalmú (AHF) NAFLD-jének fejlődésére egerekben. Az EPA és a DHA csökkentette az SREBP-1 fehérjét és a lipogén gének expresszióját. Az EPA azonban a DHA-nál hatékonyabban csökkentette a FAS, (ELOVL családtag 6) Elovl6 és glicerin-3-foszfát-aciltranszferáz (GPAT-1) mRNS-expresszióját. A szerzők azt is kimutatták, hogy a DFFA-t, például effektor c-t (CIDEC), a zsírmájképződésben kulcsszerepet játszó lipidcseppekben elhelyezkedő fehérje sejt expressziós halált szignifikánsan elnyomta az AHF + EPA, de az AHF + DHA csoportban nem [ 52]. Ezért fontos figyelembe venni, hogy ezek a PUFA-k (EPA és DHA) specifikus célokkal rendelkeznek, de együtt hozzájárulhatnak a zsírsavak májban történő felhalmozódásának csillapításához.
További mechanizmusokat vizsgáltak az EPA és a DHA máj lipid metabolizmusra gyakorolt hatásának további tisztázása érdekében. A tőkehalat tartalmazó WD-vel etetett egerek (az EPA és DHA halforrása) az EPA és a DHA koncentrációjának jelentős növekedését és a máj zsírfelhalmozódásának gyengülését mutatták, az endokannabinoid rendszer tónusának változásával együtt. Az EPA és a DHA magasabb koncentrációinak jelenléte az arachidonsavhoz viszonyítva a 2-arachidonoil-glicerin (2-AG), az N-arachidonoil-etanol-amin (AEA) szintézisének csökkenéséhez vezet, és növeli a szubsztrát rendelkezésre állását az endokannabinoid képződéséhez. az EPA és a DHA származékai (pl. eikozapentaenoil-etanol-amid (EPEA) és dokozahexaenoil-etanol-amid (DHEA)). Ez a mechanizmus részben megmagyarázhatja a máj lipidjeinek növekedésének gyengülését, valamint az elhízás kialakulását WD és tőkehal táplált egerekben [54].
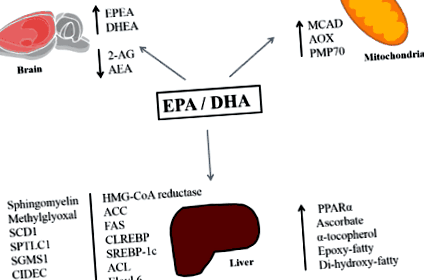
Így a legfrissebb szakirodalom azt mutatja, hogy az EPA és a DHA (a halolajban és az olajos halakban jelen lévő n-3 PUFA-k) a preklinikai modellekben csökkenthetik a májban a lipidek felhalmozódását. Ilyen hatások nemcsak az lipogenezisben és a-oxidációban szerepet játszó fehérjék aktivitását befolyásoló n-3 zsírsavakkal, hanem metabolikus oxidatív enzimekkel és az endokannabinoid rendszer tónusának változásával is összefüggenek (1. ábra). További kutatásoknak meg kell vizsgálniuk ezeket a mechanizmusokat, különös tekintettel az egyes EPA és DHA specifikus molekuláris célpontokra gyakorolt hatásaira. Ez a hatékony terápiás megközelítések következő generációjához vezethet.
1.ábra. A máj lipid felhalmozódásának csökkenésével kapcsolatos EPA és DHA molekuláris hatások összefoglalása. Rövidítések: EPA: eikozapentaénsav, DHA: dokozahexaénsav, EPEA: eikozapentaenoil-etanolamid, DHEA: dokozahexaenoil-etanol-amid, 2-AG: 2-arachidonoil-glicerin, AEA: N-arachidonoil-etanol-amin, MCAD: közepes láncú acil-acil-karbamid: A CoA-oxidáz, PMP70: peroxiszomális membránfehérje 70, SCD1: sztearoil-CoA-deszaturáz-1, SPTLC1: szerin-palmitoil-transzferáz hosszú láncú alaphelyzet-1, SGMS1: foszfatidilkolin: ceramid-kolin-foszfotranszferáz 1, CIDEC: halált kiváltó DFFA, mint effektor c, GPAT-1: glicerin-3-foszfát-aciltranszferáz, ACC: acetil-CoA karboxiláz, FAS: zsírsavszintáz, SREBP-1c: szterin szabályozó elemet megkötő fehérje 1c, ACL, Elovl 6: ELOVL családtag 6, PPAR ?: peroxisome proliferátor által aktivált receptor- a, ChREBP: szénhidrátra reagáló elemkötő fehérje
Összeférhetetlenség
A szerzők megerősítik, hogy nincs összeférhetetlenség.
Szerzőségi hozzájárulások
A szerzők együtt járultak hozzá a cikk tervezéséhez, a cikk szellemi tartalmának megírásához és kritikai áttekintéséhez, valamint a végleges változat jóváhagyásához.
Hivatkozások
Főszerkesztő
Cikk típusa
Publikációs előzmények
Átvétel dátuma: 2016. november 2
Elfogadott dátum: 2016. december 14
Megjelenés dátuma: 2016. december 19
Idézet
Barbosa AM, Chagas TR, Nunes EA (2016) Zsírmáj és n-3 zsírsavak lenyelése: Új mechanizmusok és perspektívák a preklinikai állatmodellekből. Liver Pancreat Sci 1: DOI: 10,15761/LPS.1000104.
Levelezési cím
Everson Araújo Nunes
Élettani Tudományok Tanszék, Biológiai Tudományok Központ, Santa Catarina Szövetségi Egyetem (UFSC) 88040-900, Florianópolis, Brazília
1.ábra. A máj lipid felhalmozódásának csökkenésével kapcsolatos EPA és DHA molekuláris hatások összefoglalása. Rövidítések: EPA: eikozapentaénsav, DHA: dokozahexaénsav, EPEA: eikozapentaenoil-etanolamid, DHEA: dokozahexaenoil-etanol-amid, 2-AG: 2-arachidonoil-glicerin, AEA: N-arachidonoil-etanol-amin, MCAD: közepes láncú acil-acil-karbamid: A CoA-oxidáz, PMP70: peroxiszomális membránfehérje 70, SCD1: sztearoil-CoA-deszaturáz-1, SPTLC1: szerin-palmitoil-transzferáz hosszú láncú alaphelyzet-1, SGMS1: foszfatidilkolin: ceramid-kolin-foszfotranszferáz 1, CIDEC: halált kiváltó DFFA, mint effektor c, GPAT-1: glicerin-3-foszfát-aciltranszferáz, ACC: acetil-CoA karboxiláz, FAS: zsírsavszintáz, SREBP-1c: szterin szabályozó elemet megkötő fehérje 1c, ACL, Elovl 6: ELOVL családtag 6, PPAR ?: peroxisome proliferátor által aktivált receptor- a, ChREBP: szénhidrátra reagáló elemkötő fehérje
- Rendkívül elhízott arcok A zsíros májbetegségek legnagyobb kockázata MedPage Today
- Diéta zsírmájért LoveToKnow
- Az étrendi kapszaicin és az antibiotikumok szinergikusan hatnak az alkoholmentes zsírmájbetegségek csökkentésére
- Diétás zsírsavak ideje-e megváltoztatni az ajánlásokat FullText - Annals of Nutrition and
- Diétás zsírsavak kalapács táplálkozás