A daganatok metabolikus fordulatot alkalmaznak a lipidek előállításához
Marteinn Thor Snaebjornsson &
A szerző keresése itt:
Almut Schulze
A szerző keresése itt:
A kóros sejtszintű anyagcsere a rákos sejtek jellemzője, a glükózt használó utak változásától kezdve a lipid anyagcsere rendellenes aktiválásáig. A lipidek egy nagyon bonyolult molekulacsoport, számos sejtfunkcióval 1, amelyek közül az egyik legfontosabb az, hogy biztosítsák a sejtes lipidmembránok szintézisének építőköveit. A felnőtt test legtöbb szövete az étrendből származó lipidekre vagy a májban termeltekre támaszkodik, de sok rákos sejt ehelyett aktiválja a lipidszintézis útjait, hogy támogassa azok gyors szaporodását 2. Ez a különbség a normál és a rákos sejtek között lehetséges tumor-sejt sérülékenységre utal, amelyet terápiás úton is ki lehet használni. A zsírsavak (a lipidek építőkövei) szintézisének vagy módosulásának megakadályozása valóban csökkentheti a tumor növekedését a rák számos állatmodelljében, bár ez a megközelítés a klinikán még nem volt sikeres. Írás Természet, Vriens et al. 3 olyan eredmények jelentése, amelyek utat jelezhetnek.
Az egyik oka annak, hogy a lipidanyagcserét célzó rákellenes stratégiák hatástalanok voltak a klinikán, az lehet, hogy alternatív utak kompenzálják azt az utat, amelyet egy adott gyógyszer blokkol. Vriens és munkatársai azonosítottak egy ilyen kompenzációs utat a rákos sejtekben, amely lehetővé teszi a sejtek számára, hogy egyszeresen telítetlen zsírsavakat állítsanak elő, ha az általuk használt útvonal blokkolva van. Ez az alternatív út köztudottan az emberi szőrtüszők olajtermelő faggyúmirigyében hat, és a szerzők felfedezése feltárta, hogy a rákos sejtek ezt az utat is felhasználhatják anyagcsere-igényeik kielégítésére.
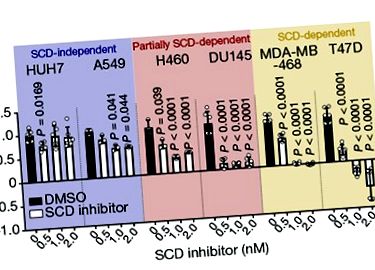
A sztearoil-CoA deszaturáz (SCD) enzim katalizálja a specifikus kettős kötés kialakulását a palmitátban, egy telített zsírsavban (kettős kötés nélküli zsírsav), és ilyen típusú deszaturációs reakcióra van szükség az egyszeresen telítetlen zsírsavat előállító úton. savak palmitoleate és oleate. Ezek a zsírsavak kulcsfontosságú építőelemek a sejtmembránok alkotó foszfolipidek számára. A szerzők egy SCD inhibitor hatását vizsgálták a humán rákos sejtekre in vitro. Megállapították, hogy a vizsgált ráksejtek némelyike nagyon érzékeny volt az SCD gátlására, és vagy abbahagyta az osztódást, vagy elhunyt, míg mások érzéketlenek voltak, és tovább osztódtak. Ez váratlan volt, mert az SCD gátlásának várható eredménye telített zsírsavak felhalmozódása lenne, amelyek nagy koncentrációban mérgezőek a sejtekre 4 .
Vriens et al. megállapította, hogy az SCD gátlására érzéketlen rákos sejtek magas szintű szapienátot tartalmaznak, egy egyszeresen telítetlen zsírsavat, amely általában a faggyúmirigyben termelődik. A szapienátot 5 a palmitátból állítják elő egy FADS2 nevű enzim segítségével (1. ábra). A FADS2-re emlőszövetekben is szükség van 6 az étrendből nyert omega-3 és omega-6 esszenciális zsírsavak feldolgozásához.
A szerzők arról számolnak be, hogy a normál szövetben való expressziójához viszonyítva az emberi máj- és tüdődaganatokból származó mintákban a FADS2 expresszió megemelkedik. Megjegyzik, hogy a sapienát kimutatható a májrák egér modelljeiből származó daganatokban, és hogy ezekben a daganatokban a FADS2 expresszió korrelál a rákos sejtek SCD gátlással szembeni rezisztenciájával. Érdekes módon, hasonló módon, ahogy az oleate képződik a palmitoleaát, az egyszeresen telítetlen zsírsav megnyúlásából cisz-A 8-oktadekanoát a szapienát megnyúlásából képződik. A szerzők megállapították, hogy mind a szappanosodás, mind a cisz-A 8-oktadekanoát beépül a rákos sejtek membrán lipidjeibe.
Vriens és munkatársai ezután azt vizsgálták, hogy az egyszeresen telítetlen zsírsavak szintézisének FADS2-függő útja képes-e kompenzálni ezen vegyületek hiányát, amely általában akkor fordul elő, amikor az SCD gátolt. Valójában azt találták, hogy vagy az emberi rákos sejtek megtervezése a FADS2 expresszálására, vagy a sapienát hozzáadása a sejtekhez lehetővé tette a rákos sejtek túlélését in vitro ez általában meghal, ha az SCD-t gátolják. Azonban emberi rákos sejtek nőttek in vitro azokat, akik érzéketlenek voltak az SCD gátlásra, az SCD gátlás és a FADS2 kimerülése kombinációjával megölték. A szerzők által tesztelt egér májrák-modellben mind az SCD, mind a FADS2 gátlása mérsékelt csökkenést okozott a tumor növekedésében azokhoz az állatokhoz képest, amelyekben egyik enzimet sem gátolták.
Növelt emberi sejtek felhasználásával végzett kísérletek in vitro jelezte, hogy az SCD és a FADS2 tevékenységei egymástól függenek. A SCD gátlása esetén a FADS2 által termelt szapienát termelése megnőtt. Ezzel ellentétben, amikor a FADS2 aktivitást blokkolták, a palmitoleate SCD szintézise fokozódott. A lipidtermelő utaknak ez a rugalmassága rendkívül előnyös azoknak a ráksejteknek a gyorsan osztódása szempontjából, amelyekhez egyszeresen telítetlen zsírsavakra van szükség. A szerzők azonban megfigyelték, hogy a FADS2 kimerülése SCD gátlás hiányában növelte a rákos sejtek szaporodását, jelezve, hogy bár a FADS2 kínálhat egyszeresen telítetlen zsírsavak előállítására, a sejtek proliferációs képességét tekintve költséges.
A palmitát felhalmozódása elmozdíthatja a FADS2 aktivitását a palmitát szubsztrátjának előnyben részesítése felé, és ezáltal elősegítheti a szappanáttermelést 7. Ez tehát hibamentes mechanizmust biztosíthat az egyszeresen telítetlen zsírsavak előállításához, ha az SCD blokkolva van. Valóban, cisz-A 8-oktadekanoát nem volt kimutatható a rákos sejtek foszfolipidjeinek mintáiban SCD gátlás hiányában, ami arra utal, hogy legfeljebb alacsony szappienát-szint keletkezik azokban a sejtekben, amelyekben az SCD aktív.
Vriens és kollégái munkája számos kérdést felvet. Például mely mechanizmusok szabályozzák a FADS2 expressziójának szintjét a rákos sejtekben? Figyelembe véve, hogy a FADS2-függő szapienát-termelés csak SCD hiányában releváns, valószínűtlennek tűnik, hogy a szapienát-termelés az oka a magas FADS2-expressziónak az emberi rákban. Valószínű, hogy a FADS2 fő funkciója az ilyen sejtekben az, hogy az omega-3 és omega-6 zsírsavak feldolgozásában a szokásos szerepét töltse be olyan lipid-jelátviteli molekulák előállítására, amelyek részt vesznek olyan funkciókban, mint az immuncsalás 8. Az SCD gátlásakor a szappanáttermelésre való áttérés megakadályozhatja, hogy a FADS2 a szokásos szerepét töltse be, és blokkolhatja ezen jelátviteli molekulák termelését.
Nem ismert, hogy a FADS2 által termelt egyszeresen telítetlen zsírsavak funkcionálisan helyettesítik-e az SCD által termelteket. Szappienát és cisz-A 8-oktadekanoát membrán lipidekké eredményezheti a membrán folyékonyságának, görbületének vagy a membránfehérjék társulásának különbségeit, összehasonlítva a palmitoleaáttal és az oleáttal készített membrán lipidek megfelelő jellemzőivel.
A tanulmány egy másik kérdése az, hogy a tumor mikrokörnyezet befolyásolja-e a rákos sejtek SCD-től és FADS2-től való függését. A sejtek egyszeresen telítetlen zsírsavakat is nyerhetnek egy olyan lizoszfoszfolipidnek nevezett foszfolipid 9 felvételével. Ennélfogva az ilyen molekulák szintje a tumor mikrokörnyezetében meghatározhatja, hogy az SCD és a FADS2 gátlása hatékony módszer lenne-e a rákos sejtek elpusztítására. Vriens et al. megállapította, hogy az SCD-gátlóval kezelt egerek májába beültetett emberi májrák sejtek felveszik a szupienátumot a tumor mikrokörnyezetéből. Ez azt sugallja, hogy a tumorban a FADS2 által végzett szapienát szintézis nem elegendő ahhoz, hogy kielégítse az egyszeresen telítetlen zsírsavak iránti igényét. Sőt, ezzel a lehetőséggel összhangban a SCD és a FADS2 együttes kimerülése után megfigyelt tumor növekedés gátlása csak mérsékelt volt. Talán a zsírsav felvételének gátlása a tumor mikrokörnyezetéből segíthet blokkolni a tumor növekedését, amikor az SCD és a FADS2 gátolt.
Vriens et al. adjon elgondolkodtató példát arra, hogy a rákos sejtek hogyan fejlődnek anyagcsere-szükségleteik kielégítésére. Az érintett mechanizmusok összetettségének kezelése továbbra is kihívást jelent a lipid-anyagcsere hatékony kezelésére a rákterápiában.
Természet 566, 333-334 (2019)
- Miért lehet az ételzsaruk randevújával hízni
- Miért nincs értelme a méregtelenítő diétáknak?
- Az ökotárius forradalom Hogyan készítsünk otthont; Diet More Green NESSE
- A gluténmentes étrend hatása a metabolikus szindróma összetevőire Randomizált klinikai vizsgálat
- Miért büdös a spiccem a spárga fogyasztásától?