A DNS-metiláció epigenetikus modulálása táplálkozással és mechanizmusai állatokban
Absztrakt
Köztudott, hogy az állatok fenotípusát táplálkozási modulációkkal módosíthatják epigenetikus mechanizmusok révén. Az epigenetikus hálózat kulcsfontosságú és központi elemeként a DNS-metiláció labilis a táplálkozási hatásokra reagálva. A DNS-metilációs profilok megváltoztatása változásokhoz vezethet a génexpresszióban, ami különböző fenotípusokat eredményezhet, amelyek csökkent növekedési és egészségügyi lehetőségekkel járhatnak. Itt áttekintettem a DNS metilezésének biológiai folyamatát, amely metilcsoportok hozzáadását eredményezi a DNS-hez; a metódonorok, a DNS-metiltranszferáz (DNMT) aktivitás és más kofaktorok lehetséges módjai, a kritikus periódusok, beleértve a prenatális, posztnatális és étrendi átmeneti periódusokat, valamint a DNS metilációjának táplálkozással történő epigenetikai modulációjához tartozó szöveti specifikus szövetek és állatok mechanizmusai.
1. Bemutatkozás
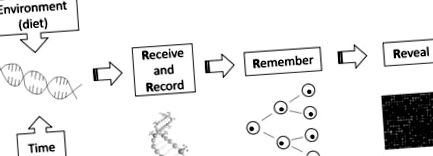
Köztudott, hogy sok organizmus reagálhat a különböző környezeti/táplálkozási tényezőkre fenotípusos plaszticitással. Az egyik példakép, hogy a méhek királynőként vagy munkásokká nőnek, attól függően, hogy méhpempővel vagy méhkenyérrel etetik őket (Kucharski et al., 2008). Egy másik paradigmatikus példa az Agouti egér modellje, ahol az anyai metil táplálék tartalma befolyásolja a rágcsáló utódok szőrzetének színét (Wolff és mtsai., 1998, Waterland és Jirtle, 2003, Dolinoy és mtsai., 2006). Ezek a megfigyelések azt mutatják, hogy az állatok fenotípusát táplálkozási modulációk módosíthatják epigenetikus mechanizmusok révén, vagyis az étrendi expozíció hosszú távú következményekkel járhat a növekedés és az egészség szempontjából (McKay és Mathers, 2011). Mathers (2008) négy R modellt dolgozott ki a táplálkozási epigenomika mechanizmusának magyarázatára (1. ábra).
A táplálkozási epigenomika négy R koncepciójának modellje. A környezeti (táplálkozási) expozícióból eredő megváltozott epigenomikai jelölések befogadva, rögzítve, emlékezve és feltárva (Mathers, 2008).
Az elmúlt években egyre több bizonyíték áll rendelkezésre arról, hogy a környezeti (táplálkozási) ingerek módosíthatják a DNS metilációját, és ezért befolyásolhatják a gének fenotípusos expresszióját (Lillycrop és mtsai, 2005, van Straten és mtsai, 2010, Farias és mtsai, 2015, Farkas et al., 2015, Day et al., 2015). Ezeket a munkákat vagy empirikusan - az epigenetikai jelek lehetséges változásait vizsgálták a diéta tényezőre reagálva, vagy elméleti - feltételezett mechanizmusokat kutattak, amelyek révén a tápanyagok befolyásolhatják az epigenetikai jelöléseket. A DNS-metiláció az epigenetikus hálózat kulcsfontosságú eleme (Kucharski et al., 2008), és régóta központi jelentőségűnek tekintik az epigenetika területén. A DNS-metilezési folyamat járult hozzá az "epigenetika" "epi" előtagjának legjelentősebb jelentőségéhez. Ezért itt áttekintettük a DNS-metiláció táplálkozási modulációjának mechanizmusait, kritikus periódusait és szövetspecifikus tulajdonságait.
2. DNS-metilezés
A citozint in vivo metilálják a DNS-metiltranszferáz (DNMT) segítségével, amely S-adenozil-metionint (SAM) használ elektrofil metilforrásként, 5-metil-citozin (mC) előállítására a citoszin-foszfát-guanin (CpG) helyeken a kettős szálú DNS-ben. Karbantartó A DNMT ezután metilezheti a komplett citozint, hogy kettős szálú CpG-metilezést hozzon létre. Egyébként stabil epigenetikai jel, az mC oxidálható az a-ketoglutarát (a-KG) -függő tíz-tizenegy transzlokáció (Tet) dioxigenáz-családdal, így 5-hidroxi-metil-citozint (hmC) kapunk, ami az első lépés a metil-csoport eltávolításában. mint epigenetikus jel (Day et al., 2015).
Mindazonáltal az mC-t az a-KG-függő Tet-dioxigenáz-családokkal oxidálhatjuk, így 5-hidroxi-metil-citozint (hmC) nyerhetünk (2. ábra) (Tahiliani et al., 2009, Day et al., 2015). Maga a hidroxi-metil-jel stabil és viszonylag magas szinten van az agyban. Azonban ez az aktív demetilezés első lépése is, és vagy a Tet-fehérjecsalád aldehid- vagy karboxiláttermékekké történő túloxidációja, vagy dezaminálási mechanizmusok, amelyeket bázis excíziós javítás követ, majd törli a citozin alkilezését (Ito et al., 2011, Song et et. al., 2013).
3. A DNS-metiláció táplálkozási modulációjának mechanizmusai
Ma már egyre több bizonyíték támasztja alá, hogy a tápanyagok módosíthatják a DNS-metiláció mintázatát, akár globálisan, akár a lokusz-specifikus helyeken (Vucetic et al., 2010, Bogdarina et al., 2010, Jousse et al., 2011, Dudley és mtsai, 2011, Altmann és mtsai, 2012). Három lehetséges módja van annak, hogy a táplálkozás befolyásolja a DNS-metiláció mintázatát (3. ábra): először is, a megfelelő DNS-metilezéshez szubsztrátok biztosítása szükséges; másodszor a DNMT enzimatikus aktivitását moduláló kofaktorok biztosítása; harmadszor, az egy szénatomot szabályozó enzimek megváltozó aktivitása. Fontos, hogy mindhárom mechanizmus kölcsönösen kompatibilis, és időben működhet együtt.
A táplálkozás lehetséges módjai a DNS-metiláció mintázatának befolyásolására (Felülvizsgált McKay és Mathers, 2011). MAT = metionin-adenozil-transzferáz; SAM = S-adenozil-metionin; SHMT = szerin-hidroxi-metil-transzferáz; THF = tetrahidrofolát; DNMT = DNS-metil-transzferáz; MTR = 5-metil-tetragydrofolát-homocisztein-metil-transzferáz; MTHFR = metil-tetrahidrofolát-reduktáz; Hcy = homocisztein; SAH = S-adenozil-homocisztein; mDNS = metilezett DNS.
3.1. Diétából származó metil donorok
A DNS és a fehérje metiltranszferázok univerzális metil-donorjaként (Loenen, 2006) az S-adenozil-metionint (SAM) a metionin-ciklusban szintetizálják az étrendben jelen lévő számos prekurzorból (McKay és Mathers, 2011, Feil és Fraga, 2012). Mindezek a prekurzorok, beleértve a metionint, a folátot, a kolint, a betaint és a B2, B6 és B12 vitaminokat, a metionin útvonalának különböző helyein lépnek be, és hozzájárulnak a SAM nettó szintéziséhez. Ezért a metildonorok alacsonyabb hozzáférhetőségének alacsony SAM szintézist és globális DNS hipometilációt kell eredményeznie, és fordítva.
Valójában számos információ áll rendelkezésre a metildonorok DNS metilációra gyakorolt hatásairól az állatmodellekkel végzett vizsgálatokból (Pogribny et al., 2008, Cordero et al., 2013, Cordero et al., 2014, Amarasekera et al., 2014, Llanos et al., 2015, Farkas et al., 2015). Ennek megfelelően a metildonorokban hiányos étrend globális DNS hipometilációt eredményez rágcsálókban (Pogribny et al., 2008, Pogribny et al., 2009, Mehedint et al., 2010, Craciunescu et al., 2010). Ezzel szemben a metildonorokkal kiegészített anyai étrend növeli a DNS metilációját a specifikus lokuszokban (Waterland, 2006, Waterland et al., 2008, de Vogel et al., 2011, Li et al., 2015, Farias et al., 2015).
Noha a metildonorok megváltoztathatják a DNS metilációs mintáit, a szükséges dózisokról és az étrendi expozíció vagy a kimerülés pontos időtartamáról keveset tudunk, ami hozzájárul az epigenetikai jelek változásához. Túl sok a bizonytalanság a különböző dózisok és az étrendi expozíció időtartamának a DNS-metilációra gyakorolt hatásaival kapcsolatban (Cravo et al., 1994, Cravo et al., 1998). Ezért szisztematikusabb tanulmányokat érdemel, hogy egyértelműbb eredményeket nyújtsanak be.
Emellett más tanulmányok összetettebb forgatókönyvet mutattak be. Alacsony fehérjetartalom vagy 50% -os globális alultápláltság az egerek terhessége alatt mind hiper-, mind hipo-metilációhoz vezetett az utódok specifikus helyein (van Straten et al., 2010). Hasonlóképpen, a méhen belüli alultápláltság emberben különböző specifikus lokuszok hipo- és hiper-metilációját is eredményezte (Heijmans et al., 2008, Tobi et al., 2009, Waterland et al., 2010). Nem számoltak be arról, hogy ezekben a specifikus vizsgálatokban csökkent-e a metil-donorok mennyisége, de általánosan elfogadott, hogy az alultápláltság korrelál a csökkent metil-donorok rendelkezésre állásával. Ezért nincs egyszerű összefüggés a metil donor koncentráció és a DNS metiláció között. Más mechanizmusok hozzájárulhatnak a DNS-metiláció kialakulásához a sejtekben.
3.2. DNS-metil-transzferáz aktivitás
Köztudott, hogy a DNMT teljes aktiválásához a SAM-ra kofaktorként van szükség. Az étrendből származó metil donorok hozzájárulhatnak a DNMT aktivitásának modulálásához az SAM intracelluláris koncentrációjának megváltoztatásával. A DNS-metilációs minták SAM-poolok modulálásával történő közvetett szabályozása mellett számos vegyület közvetlenül befolyásolhatja a DNMT expresszióját vagy aktivitását is (Mukherjee et al., 2015). A (-) - epigallocatechin-3-gallát (EGCG), a zöld teában lévő polifenol vagy a szójababban lévő genistein esetében bizonyított a DNMT aktivitás kompetitív gátlása (Fang et al., 2007, Vanhees et al., (Xie és mtsai., 2014, Zampieri és mtsai., 2015). A miricetin az SssI DNMT gátlásával csökkentheti a DNS-metilációt is (Lee és mtsai, 2005).
3.3. A metionin ciklusból származó enzimek aktivitása
A B2, B6 és B12 vitamin olyan kofaktor, amely részt vesz a folátciklusból származó enzimek katalitikus aktivitásának szabályozásában, és ezáltal meghatározza a SAM biohasznosulását. Pontosabban, a B6-vitamin a szerin-hidroxi-metil-transzferáz (SHMT) kofaktora a tetrahidrofolát (THF) 5,10-metilén-THF-vé történő átalakításakor. A B2-vitamin a FAD előfutára, amely az 5,10-metilén-THF 5-metil-THF-vé történő átalakításakor a metilenetetrahirofolát-reduktáz (MTHFR) kofaktora. A B12-vitamin az 5-metiltetrahidrofolát-homocisztein-metil-transzferáz (MTR) kofaktora, amely katalizálja a homocisztein (Hcy) átalakulását metioninná, a SAM közvetlen prekurzorává. Ezért ezen kofaktorok biohasznosulása befolyásolhatja a DNS-metilációt az egy szénatomot tartalmazó ciklus aktivitásának és a SAM termelésének módosításával (Feil és Fraga, 2012).
Így elképzelhető, hogy az étrend kiegészítése ezekkel a vitaminokkal hozzájárul a DNS-metilnyomok fenntartásához vagy létrehozásához. Farias és mtsai. (2015) először mutatta ki, hogy a megfelelő folát nélkül nevelkedett HCT116, LS174T és SW480 sejtek jelentősen rontották a kolonoszféra képző képességét. Ezeket a különbségeket a DNS metiltranszferáz (DNMT) enzim expressziójának és a DNS metilációs szintjének egyidejű változása kísérte. Li és mtsai. (2015) arról számolt be, hogy a folsav a PP2A demetilezési reakcióinak gátlásával képes csökkenteni a tau fehérje foszforilációját. A magas folsavkoncentráció (20 és 40 µmol/l) növelte a SAM és a SAH arányát és a sejtek életképességét.
4. A DNS-metiláció táplálkozási modulációjának kritikus periódusai
4.1. Szülés előtti időszak
Az emlősök korai embriogenezise a legkritikusabb időszak az epigenom létrejöttéhez. E programok időben történő elmulasztása visszafordíthatatlan lehet, és a génexpresszió maradandó diszregulációjához vezethet (Lumey és mtsai., 1993, Gallou-Kabani és Junien, 2005). Fontos, hogy ez egy olyan időszak, amely különösen kiszolgáltatott a környezeti jelzéseknek, például a táplálkozásnak, amely megzavarhatja az epigenetikus jelek helyes létrehozását, amelyek létrehozása után nagyon stabilak maradnak (Burdge és Lillycrop, 2010). Ez az oka annak, hogy a táplálkozási kihívások a fejlesztés korai szakaszában ilyen hosszú távú hatásokkal járhatnak.
Nagyobb bizonyíték van az anyai táplálkozás epigenetikai jelekre gyakorolt hatásáról az utódokban (Dominguez-Salas et al., 2014, Cannon et al., 2014, Mozhui et al., 2015). A fehérje korlátozása gyakran alkalmazott modell az anya alultápláltságához. Például a vemhes patkányok alacsony fehérjetartalmú étrendjének etetése globális vagy lokuszspecifikus változásokat eredményezett a DNS-metilációban (Rees és mtsai, 2000, Altmann és mtsai, 2013). A fehérje alultápláltsága által érintett gének (vagy lokuszok) közé tartozik a glükokortikoid receptor (GR), a peroxiszóma proliferátor által aktivált alfa (PPARa) és a máj X receptor-alfa (Lxra) a májban (Lillycrop és mtsai, 2007, Lillycrop és mtsai., 2008, van Straten és mtsai, 2010, van Straten és mtsai, 2012, Altmann és mtsai, 2013); a hepatocita nukleáris faktor-4-alfa (Hnf4a) a szigeti sejtekben (Sandovici és mtsai, 2011); az AT (1b) angiotenzin receptor a mellékvesében (Bogdarina et al., 2007, Bogdarina et al., 2010); az orexigén/anorexigén gének neuropeptid Y (Npy) és proopiomelanocortin C (Pomc) a hipotalamuszban (Coupé és mtsai, 2010); és a leptin gén (Lep) a zsírszövetben (Jousse et al., 2011).
Fontos, hogy a DNS-metiláció változásai korrelálnak a megváltozott génexpresszióval. Ezért a DNS-metilációban bekövetkező ilyen táplálkozás által kiváltott változások legalább részben megmagyarázhatják a felnőttek metabolikus rendellenességeit. ma már elegendő bizonyíték áll rendelkezésre annak alátámasztására, hogy az anya alultápláltsága epigenetikus módosításokkal állandó változásokat indukálhat a génexpresszióban.
4.2. Szülés utáni időszak
4.3. Diétás átmeneti időszak
Az epigenetikus variációk nem korlátozódnak a születés előtti vagy a posztnatális periódusra, hanem az egész élet folyamán előfordulhatnak (Grayson et al., 2014). Az epigenetikus kutatások, amelyekben egynemű ikrek vesznek részt, akik azonos genomokkal születnek, de az életük későbbi szakaszában különböző fenotípusokat mutatnak be, kiváló példa arra, hogy a környezeti tényezők milyen hatással lehetnek az organizmusok fejlődési plaszticitására. Az ilyen epigenetikai variációk hosszú időn keresztül felhalmozódnak, és végső soron befolyásolhatják a fenotípusos eredményeket (növekedés és egészség). A felnőttek étrendi beavatkozásait és az epigenetikus módosításokat összekapcsoló adatok mennyisége azonban sokkal korlátozottabb, mint a pre- és post-natal fejlődés alatti étrendi beavatkozásoké. Mindazonáltal a táplálkozásnak továbbra is hosszú távú hatása lehet, különösen a hosszú távú "étrendi átmenetek" alatt (Jiménez-Chillarón et al., 2012), amelyet úgy határozhatunk meg, mint olyan időszakot, amelyben az állatokat hosszabb időn keresztül (kb. állatok heteitől hónapokig) az alultápláltsággal jellemzett étrendig. Ez a fajta átmenet finom, hosszan tartó (vagy tartós) változásokat okozhat a génexpresszióban. E gén expressziók epigenetikailag társított változásai, bár potenciálisan reverzibilisek, általában stabilak és hozzájárulnak a növekedés és az egészség életkorfüggő csökkenéséhez (Li et al., 2011a, Chalkiadaki és Guarente, 2012, Jiménez-Chillarón et al., 2012 ).
Például az egerek krónikus, magas zsírtartalmú etetése (az elválasztástól a> 15 hétig) megváltoztatta a DNS-metiláció mintázatát a mu-opioid receptor promoter régióiban az agy VTA-jában és NAc-jében egyaránt (Vucetic et al., 2011, Pitman és Borgland, 2015). Hasonlóképpen, az elválasztás utáni étrend (magas zsír- és szénhidráttartalom) befolyásolja a máj intraciszternális A részecske (IAP) metilációs mintázatát egerekben (Warzak és mtsai, 2015). Továbbá a magas zsírtartalmú étrend utáni elhízás hajlamosítja az egér utódokat elhízásra, és a hipotalamuszban a proopiomelanocortin (POMC) promóter hipometilezése történt (Zheng et al., 2015). Hasonlóképpen, az alacsony fehérjetartalmú étrendet tápláló hím egerek az elválasztástól a 9-12 éves korig számos változást váltottak ki a DNS-metilációban, mikroszkópos elemzéssel értékelve, az utódok májjában. A pozitív lokuszok között a lipid szabályozó fehérje, a PPARa fokozóját azonosították (Carone és mtsai, 2010). Ismételten az isogén egerek epigénjének tartós étrendi változása metil-kiegészített étrend mellett 6 generáción át fokozta a máj metilációs variációját (Li et al., 2011b), ami arra utal, hogy az indukált változások egy része örökletes. Ezenkívül a kalória-korlátozás befolyásolja az életkorral összefüggő betegségekhez és az öregedéshez kapcsolódó specifikus gének expresszióját azáltal, hogy modulálja a HDAC1 dúsulási kötődését a promoter régióikhoz (Ferguson-Smith és Patti, 2011, Li et al., 2011b).
5. A DNS-metiláció táplálkozási modulációjának szövetspecifikus
6. A DNS-metiláció táplálkozási modulációjának kilátása
Köszönetnyilvánítás
Ezt a munkát a Közérdekű Agrártudományi Kutatások Különleges Alapja (201303143) és a kínai ösztöndíj-tanács (201403250010) támogatta.
Lábjegyzetek
Szakértői értékelés a Kínai Állattudományi és Állatorvostudományi Szövetség felelősségi körében.
- Az étrendi irányelvek előnyösek a táplálkozás, a környezet és az állatok szempontjából
- Ünnepeljük a nemzeti táplálkozási hónapot
- Főzés Superfoods receptekkel a kínai káposzta táplálékához
- Pooja Makhija, a híresség táplálkozási szakértője megdönti a diéta legnagyobb mítoszait; Táplálkozás - NDTV Food
- Az evolúció nem a forradalom Táplálkozás és elhízás