A lépéscsökkentés hatása az izom egészségére az öregedésben: A fehérje és a testmozgás mint ellenintézkedés
Absztrakt
Az erő és az izomműködés csökkenése az életkor előrehaladtával - szarkopénia - számos negatív kimenetelhez járul hozzá, beleértve az alábbiak megnövekedett kockázatát: esések, törések, kórházi ápolás és az idősebb emberek csökkent mozgásképessége. A 60 éves kor után bekövetkező izomvesztés populációalapú becslései azt mutatják, hogy
Évi 1%, miközben az erőveszteség gyorsabb
Fizikai aktivitás és öregedés
Az egyének 85% -a nem felel meg a fizikai aktivitásra vonatkozó irányelveknek (1). Ez rávilágít a javulás lehetőségére, amelyet el lehet érni, tekintettel a megnövekedett fizikai aktivitásra, amely csökkenti számos betegség kockázatát és a minden okból eredő halálozást (2, 3). Az idősebb felnőttek általában kevesebb fizikai tevékenységet folytatnak, mint a fiatalabbak (4), a szabadidős fizikai aktivitás szintje jelentősen csökken az idősebb felnőtteknél (5–7). Érdekes módon az idős emberek társadalmi elszigeteltsége számos tényező következménye lehet: a rossz mobilitás, a közlekedés hiánya vagy a kedvezőtlen időjárási viszonyok miatt képtelen elhagyni a házat, az egyén vagy társadalmi körük betegsége, amelyek mind rámutatnak a az idősödő felnőttek beavatkozási képessége.
Az idős felnőttek szokásos fizikai aktivitásának súlyosbodása az aktivitás hirtelen és hirtelen csökkenése, ami az izmok alacsonyabb mechanikai terhelését eredményezi. Az izmok kirakodását eredményező akut inaktivitási rohamok különféle körülmények (betegség, sérülés, rossz időjárási körülmények) miatt nyilvánulnak meg, és egyértelműen eltérnek a szokásos ülő viselkedéstől. Bár ezek az akut aktivitási zavarok látszólag jóindulatúak lehetnek, feltételezzük, hogy a fizikailag inaktív populációra ráhúzódó markáns inaktivitási rohamok jelentős kockázatot jelentenek a negatív fiziológiai egészségi kimenetelre, és felgyorsíthatják az öregedéssel járó szarkopéniát és krónikus kardiometabolikus állapotok kialakulását.
Szarkopénia és fizikai inaktivitás
A kifejezett inaktivitás ciklikus rohama, még viszonylag egészséges embereknél is, jelentős káros fiziológiai hatásokkal járhat, különösen az életkor előrehaladtával (8). Pontosabban, a fizikai inaktivitás akut periódusai (9–14) a csontvázizom méretének és erejének csökkenéséhez vezetnek, amely átmenetileg felgyorsítja a szarkopénia következtében fellépő szokásos csökkenést (15). A szarkopénia populációalapú becslései szerint az izomvesztés mértéke kb
Évente 1% az izomerő és az erő veszteségével, gyorsabb sebességgel
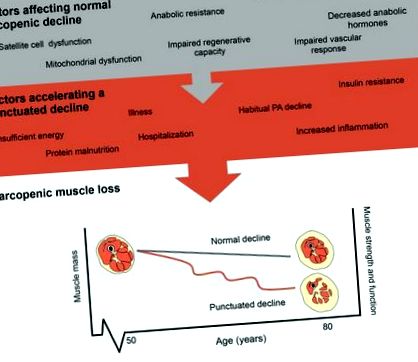
Évi 8%, (16, 17). Bár a szarkopénia progresszióját az öregedés normális következményének tekintik, az inaktivitás miatt felgyorsulhat, ami átmenetileg felgyorsítja az izomvesztést (15). Valójában számos tényező befolyásolhatja a szarkopénikus izomvesztés előrehaladását inaktivitási eseményekkel, ami tovább gyorsíthatja az izomvesztést, amint az az 1. ábrán látható. Az életmódbeli tényezők, például a testmozgás és a táplálkozás, az életkor előrehaladtával mérsékelhetik a normális izomvesztés előrehaladását. Különösen a fizikai aktivitás csökkenése, az elégtelen vagy túlzott energiafogyasztás és a fehérje alultápláltság szinergikusan felgyorsíthatja a szarkopénikus csökkenést, és ezáltal növelheti a későbbi kórházi ápolás vagy használhatatlanság kockázatát, amely gyorsított izomvesztést eredményez (18). Minden egyes használaton kívüli eseménynél az izomtömeg-csökkenés csökken, és az izom keresztmetszeti területe drasztikusan csökken az intramuszkuláris zsírtartalom növekedésével (19). A fizikai aktivitás erősen szabályozza az öregedéssel és a vázizmok egészségével járó tényezőket [inaktivitás és gyulladás (14), reaktív oxigénfajok, glikémiás kontroll (20), motoros idegsejtek elvesztése (21)] és megfelelő táplálkozással kombinálva (megfelelő fehérje bevitel) az izomcsökkenés ütemének csillapítására szolgálhat.
A szarkopénia progresszióját befolyásoló tényezők. A normális szarkopéniás izomvesztés és a felgyorsult izomvesztés ábrázolása, amelyet egy pontozott csökkenés mutat.
Lépéscsökkentés mint az időszakos inaktivitás modellje
A vizsgálatokban alkalmazott 750 lépés/d) összhangban áll az akut kórházi tartózkodás alatt álló betegek által végrehajtott lépésekkel (34). Riasztó módon a kórházi betegek napi lépései (a vizsgált 708 napból) csak az idő 50% -ában haladták meg a napi 300 lépést; betegenként azonban átlagosan napi lépések voltak
740 (34). Az SR-vel végzett fizikai aktivitás ezen alacsony szintre történő csökkentése nyilvánvalóan nem jelent teljes izomhasználatot, de mély fiziológiai következményekkel jár. Fontos, hogy az SR hasonló egész test szisztémás hatásokkal rendelkezik, de nyilvánvalóan kisebb mértékben, mint az ágynyugalom, összehasonlítva a végtagok egyoldalú immobilizációjával, amely nagyrészt a perifériás szöveteket célozza meg (3. ábra). Ezenkívül az ágynyugalmi epizódok (általában a kórházi bebocsátás miatt) vitathatatlanul ritkábban fordulnak elő, mint az inaktivitás epizódjai, amelyek időjárás vagy betegség, például influenza miatt időszakonként előfordulnak, és valószínűleg a lakosság nagyobb részét érintik, mint amelyet a teljes ágynyugalom befolyásol. Így ennek a felülvizsgálatnak az a célja, hogy rávilágítson a fiatalabb és idősebb felnőttek célzott csökkentett napi lépéseinek fiziológiai következményeire, betekintést nyújtva az SR-t használó közelmúltbeli tanulmányokba, valamint a testmozgás és a táplálkozás lehetőségeibe a diszkusszió atrófia leküzdésében ebben a modellben.
Izomfehérje szintézis (MPS) és izomfehérje lebontás (MPB) válaszként gramm fehérjére étkezésenként. A folytonos vonalak az MPS-t, a szaggatott vonalak az MPB-t jelzik. A kék hash területek pozitív fehérje egyensúlyt, míg a piros pontozott területek negatív fehérje egyensúlyt jeleznek. A kék hash és a piros pontozott területek megegyeznek a görbe alatti területtel, jelezve a nettó fehérjeegyensúlyt.
Az esszenciális aminosav-leucin az mTOR és egyben az MPS (76) erős stimulátora, ezért a magas leucin-tartalmú kiegészítőket általában anabolikus potenciáljuk és izommegtakarító hatásuk miatt használják fel a használaton kívüli atrófiában. A mai napig azonban az eredmények nem egyeztek az ágynyugalmi modellekben. Ferrando és mtsai. megállapította, hogy a napi háromszor 15 g esszenciális aminosavval (5,3 g leucin) történő kiegészítés 10 napos ágynyugalom alatt nem enyhítette az LBM veszteséget egészséges, idősebb felnőttekben a kontroll csoporthoz képest (51). Hasonlóképpen, angol et al. megállapította, hogy az étkezési idő kiegészítése 4,5 g leucin dózisával csak részben védte meg az LBM veszteséget 7 napos ágynyugalom után, de nem védte szignifikánsan az LBM-et 14 napos ágynyugalom mellett pótlással fiatalabb felnőtteknél (40). Paddon-Jones és mtsai. 16,5 g EAA (3,1 g leucin) védőhatást mutatott naponta háromszor, 28 napos ágynyugalom alatt a teljes LBM-en fiatal felnőtteknél (72). Tekintettel arra, hogy az aminosav-kiegészítés hatékonyságáról az LBM megkímélésében nincs egyetértés fiatal és idősebb felnőtteknél sem az ágy pihenése alatt, sokkal több kutatásra van szükség annak végleges megállapításához, hogy valóban van-e előnye az EAA és a leucin kiegészítésnek ágynyugalom alatt.
Érdekes módon úgy tűnik, hogy az energiaegyensúly jelentős szerepet játszik az LBM veszteségében az ágynyugalom során. Amint várható volt, a hipokalorikus étrend fogyasztása az LBM veszteség gyorsított ütemét eredményezi az ágynyugalom során, nagyrészt az MPS elnyomásával (42). Biolo és mtsai. kimutatta, hogy a 14 napos ágynyugalom 20% kalóriahiánnyal kombinálva az LBM nagyobb mértékű elpazarlásához vezetett, összehasonlítva azokkal a résztvevőkkel, akik eukalorikus étrendet fogyasztottak egy keresztirányú vizsgálat során (68). Egy későbbi tanulmányban azonban Biolo és mtsai. szintén megvizsgálta a pozitív energiamérleg hatásait az ágynyugalom során a negatív energiamérleghez képest. Ezek a szerzők azt találták, hogy 35 napos ágynyugalom alatt a pozitív energiamérlegben résztvevők 1,5 kg-kal több LBM-t vesztettek, mint a negatív energiamérlegben résztvevők, és azt találták, hogy a szerzők a gyulladásos utak aktiválódásának tulajdonították a zsírtömeg növekedésével járó gyulladásos utak aktiválását. pozitív energiával kiegyensúlyozott állapot. Ezért a tápanyag-kiegészítés mellett fontolóra kell venni az energiaegyensúly fenntartását a nem használt időszakokban az optimális táplálkozás érdekében a vázizomveszteség csillapítására.
Kevesebb tanulmány vizsgálta a táplálkozási beavatkozások hatásait az egy végtag immobilizációja során az embereknél. Két tanulmány vegyes eredménnyel vizsgálta a kreatinpótlás hatásait. Hespel és mtsai. 20 g kreatin-monohidráttal vagy placebokontrollal végzett napi kiegészítés hatásait vizsgálta fiatal felnőttek 2 hétig tartó egyoldalú alsó végtagi (térd) immobilizációjában. Ezek a szerzők jelentős veszteséget találtak a quadriceps izom CSA-jában, nincs különbség a kiegészítő csoportok között (77). Fordítva, Johnston et al. fiatal felnőtt résztvevőknek placebokontrollt és ezt követően 20 g kreatint biztosított a felső végtag (könyökízület) immobilizálása során egy keresztezett tervezési vizsgálat során 7 napon keresztül, és a kreatin jobban megtartotta a sovány szövetek tömegét a placebóhoz képest, miközben megtartotta a különféle funkcionális paraméterek (78). Noha sok különbség van a két fent említett vizsgálat között (immobilizációs idő, izomtömeg mérése), az immobilizált végtagok közötti különbség (súlyhordozás és súlynélküliség) megnehezíti a két vizsgálat összehasonlítását és ezáltal a kreatin hatását. az LBM retenciójának immobilizációval történő kiegészítése további vizsgálatot igényel.
A fehérje és az aminosav pótlását az irodalomban nem vizsgálták széles körben az immobilizáció során bekövetkező izomvesztés ellensúlyozására. Dirks és mtsai. kimutatta, hogy az öntött immobilizáció öt napját követően a quadriceps CSA értéke 1,5% -kal csökkent a kontrollokban, és 2% -kal az egészséges, idősebb férfiaknál, akik placebót, vagy napi kétszer 20,7 g fehérje-kiegészítőt fogyasztottak (12). Érdekes, hogy a vizsgálat résztvevői olyan fehérje-kiegészítővel látták el, amely valószínűleg az optimális küszöbérték alatt volt [0,4 g/kg/adag (79)], mivel az átlagos tömeg alapján a 30 g-hoz közelebb eső fehérje-dózis hatékonyabb lehetett a veszteség csillapítására LBM térd öntött rögzítéssel (79).
Nemrégiben McGlory et al. megvizsgálta a halolaj-kiegészítés hatását az LBM retenciójára az egészséges fiatal nőknél két hétig tartó egyoldalú térdmegerősítés során. A résztvevők napi 5 g n-3 zsírsavat vagy kontrollolajat (napraforgóolajat) kaptak 28 napig, 14 napos egyoldalú térd immobilizáció előtt. Az immobilizálást követően az n-3 zsírsavakkal történő kiegészítés 6% -kal csillapította a quadriceps izomtérfogat csökkenését (14, illetve 8% a kontroll, illetve a kiegészítő csoportban), és elősegítette az MPS emelkedését a kontroll csoport sebessége felett. az összes mért időpont (70). Így az n-3 zsírsav-kiegészítés hozzáadása a megfelelő fehérje-dózis és az energiaegyensúly mellett az LBM csökkenésének csillapítására szolgálhat a végtagok egyoldalú immobilizációja és ágynyugalma során.
A mai napig egyetlen tanulmány sem vizsgálta az étrendi manipulációk SR-re gyakorolt hatását kiegészítéssel vagy az energiafogyasztás változásával. Tekintettel arra, hogy a fehérje, nevezetesen a nagy mennyiségű (magas EAA-tartalmú) fehérje nagy mennyiségben erős anabolikus hatást gyakorol az idősebb vázizomzatra, nemrégiben arra törekedtünk, hogy megvizsgáljuk a magas fehérjetartalmú étrend hatásait a vázizomvesztés és az egészséges MPS csökkenésének mérséklésére. idősebb felnőttek az SR alatt. Az idősebb felnőttek SR-periódusához (azaz kórházi kezeléshez) kapcsolódó körülmények összefoglalása céljából a résztvevők magas fehérjetartalmú (1,6 g/kg/nap) ellátást kaptak, kiegészítve akár napi 60 g-os tejsavófehérjével vagy kollagén-peptidekkel, és korlátozott energiájú étrend (–500 kcal, az SR által elszámolt energiafogyasztás csökkenés mellett) egy 2 hetes SR időszakban. Tejsavófehérjével történő kiegészítés vagy egy izonitrogén mennyiségű hidrolizált kollagén peptid kiegészítés lehetővé tette a kiegészítés összehasonlítását a magas és alacsony minőségű, magas fehérjetartalmú LBM változásokkal az SR-vel (14). Egy hét energia korlátozás önmagában nem volt jelentős veszteség az LBM-ben, azonban az MPS jelentősen csökkent
16% mindkét csoportban [hasonló megállapítások a korábbi vizsgálatokhoz hasonlóan az SR-ben (20)]. Érdekes módon az energia korlátozás és az SR mellett az MPS további csökkenése nem történt, jelezve azt a potenciális védőmechanizmust, amellyel az egészséges, idősebb felnőttek képesek enyhíteni az additív katabolikus ingereket. Azonban egy hetes gyógyulást követően, amely visszatér a normál napi lépésekhez, amelynek során a résztvevők fenntartották a pótlást, a tejsavófehérje jobbnak bizonyult az SR periódus feletti MPS stimuláló arányában, a kollagén peptid kiegészítésének nincs hatása (14). Az MPS arányának helyreállításának hiánya a kollagénnel kiegészített csoportban a normál aktivitás visszatérése után hasonló a laboratóriumunk korábbi megállapításaihoz, amelyben a résztvevők az SR után folytatták szokásos étrendjük fogyasztását (20). Ezek az adatok kiemelik azt az ígéretes megfigyelést, miszerint a magas színvonalú fehérje-kiegészítés javíthatja a vázizomzat egészségi állapotát az idős felnőttek fizikai aktivitásának növekedésével együtt a lábadozás után. Ezeket az eredményeket még jobban javíthatják, ha strukturált ellenállást gyakorló edzéssel kombinálják.
Következtetés
Szerző közreműködései
SO elkészítette a kézirat eredeti tervezetét. SO, TH és SP hozzájárultak a végleges kézirat szerkesztéséhez és elkészítéséhez.
Összeférhetetlenségi nyilatkozat
SP kijelenti, hogy versenyképes támogatási támogatást, honoráriumot és utazási költségeket kapott az Egyesült Államok Nemzeti Tejterméktanácsától és a kanadai tejtermelőktől. A többi szerző kijelenti, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
Köszönetnyilvánítás
A SO-t az Ontario Graduate Scholarship támogatta. Az SP-t a Kanadai Egészségkutatási Intézetek, a Nemzeti Tudományos és Mérnöki Kutatási Tanács, a McMaster Öregedéskutató Intézet és a Kanadai Kutatószékek programjainak támogatásai támogatják, és hálásan elismeri ezeket a finanszírozási forrásokat.
- Ezek a testmozgási és diétás hibák megölik a fogyás erőfeszítéseit - Stormont Vail Health
- Fogyás Gyakorolja a fogyást Hány kalóriát égethet el egy ugrókötél Egészség
- Ezek a fehérjetartalommal kapcsolatos hibák szabotálhatják a nők súlycsökkentő erőfeszítéseit; s Egészség
- A pillangó hatása A pajzsmirigy túlméretezett hatása az egészségére, Marina Tarasova figyelemre méltó -
- A fitt lány; s Útmutató a fehérje izomzatához; Fitness