A metoximorfolinil doxorubicin daganatellenes aktivitásának potencírozása P450 3A4 géntranszfer
Absztrakt
Bevezetés
A metoxi-morfolinil-doxorubicin (MMDX; nemorubicin) a doxorubicin olyan származéka, amely fokozott citotoxicitást mutat az emberi tumorsejtekkel és a hematopoietikus progenitorokkal szemben, ha májmikroszómákkal inkubálják, amelyek magas P450 anyagcsere-aktivitás. 20, 21 Az MMDX aktivitás erősödése a májban expresszált CYP3A enzimek általi metabolikus aktivációnak köszönhető. 22, 23, 24 A PA közelmúltban azonosították az MMDX 450 által generált aktív metabolitját, és kimutatták, hogy a meztelen egerekben sokkal nagyobb hatékonyságú a tenyésztett sejtekkel szemben, és figyelemre méltó hatékonyságú a tumor xenograftokkal szemben, mint az MMDX-ben. 25 Az aktivált MMDX megtartja aktivitását a klasszikus rákellenes szerekkel szembeni ellenálló képességgel rendelkező tumorsejtekkel szemben, beleértve magát az MMDX-t is. 26, 27 A troleandomycin, egy CYP3A enzimszelektív inhibitor, blokkolja a máj MMDX aktiválódását, ezáltal csökkentve a daganatellenes aktivitást és a csontvelő toxicitását, bizonyítva, hogy az aktivált MMDX hozzájárul mind a daganatellenes aktivitáshoz, mind a gazda toxicitáshoz in vivo. 28 Következésképpen stratégiákat kell kidolgozni a szisztémás MMDX expozíció csökkentésére ezen új antraciklin prodrug terápiás indexének optimalizálása érdekében.
Egy korábbi vizsgálatban kimutatták, hogy a CYP3A4 az MMDX aktiváció legaktívabb katalizátora patkány és humán CYP3A enzimek paneljén. Jelenleg értékeljük a bevezetés terápiás hatását CYP3A4 MMDX kezeléssel kombinálva a tumorsejtekbe in vitro és in vivo. Ezenkívül alkalmazunk egy replikációs hibás adenovírust a megkönnyítés érdekében CYP3A4 géntranszfer az emberi tumorsejtekbe. A replikáció-feltételes adenovírus potenciális haszna a fokozás érdekében CYP3A4 génszállítást is vizsgáltak. Megállapításaink a CYP3A4 MMDX kezeléssel kombinálva feltűnő terápiás potenciálját mutatják be, továbbá azt sugallják, hogy a CYP3A4 endogén tumorsejt-expressziója az egyes betegeknél fontos meghatározó tényező lehet az MMDX-re való válaszkészségben. in vivo.
Anyagok és metódusok
Kiegészítő anyagok és módszerek
A Western-blotoláshoz használt anyagok és módszerek, P450 reduktáz vizsgálat, kvantitatív valós idejű PCR elemzés, CYP3A4 adenovírus előkészítés és adenovírus által közvetített RNS transzkripció, fehérje expresszió és enzimaktivitás érhető el on-line kiegészítő információként.
Sejtvonalak
A CHO/HR, CHO/3A4 és a CHO/3A4/HR sejteket 29 Dr. Thomas Friedbergtől (Biomedical Research Center, Dundee Egyetem, Egyesült Királyság) szereztük be, és a-MEM táptalajban tenyésztettük, amely 10% dializált szarvasmarha-magzati szérumot (FBS) tartalmaz. ) (CHO/3A4 és CHO/3A4/HR sejtek) vagy Dulbecco által módosított Eagle táptalajban (DMEM), amely 10% FBS-t, 10 m M hipoxantint és 1,6 m M timidint tartalmaz (Invitrogen, Carlsbad, Kalifornia). 9L és 9L/3A4 sejteket (lásd alább) DMEM + 10% FBS-ben tenyésztettünk. Az U251 (agydaganat) és az A549 (tüdőrák) humán tumorsejteket Dr. Dominic Scudiero-tól (NCI, Bethesda, MD) szereztük be.
9L/3A4 sejtek generálása retrovírusos fertőzéssel
Sejtnövekedés gátlási vizsgálat
9L- és CHO-sejteket egy 96-lyukú lemez három lyukába szélesztettünk 3000 sejt/üreg sebességgel 24 órával a gyógyszeres kezelés előtt. A sejteket különböző koncentrációjú MMDX vagy IFA-val kezeltük 4 napig. A sejteket ezután kristály ibolyával (A595) festettük, és kiszámítottuk a sejtek relatív túlélését. 27 IC50-értéket az adatpontok szemilogaritmikus grafikonjáról határoztak meg a Prism 4 (Graphpad Software Inc., San Diego, CA) alkalmazásával.
A 4-OH-IFA termelés és az aktív MMDX képződés mennyiségi meghatározása a CYP3A4-et expresszáló tumorsejtek által
A 9L/3A4 sejteket 12 lyukú tenyésztőlemezekre helyeztük 1,5x105 sejt/üreg 1,5 ml tenyésztőközegben. Huszonnégy órával később különböző koncentrációjú IFA-t adtunk a sejtekhez 5 mM szemikarbaziddal együtt a 4-OH-IFA metabolit csapdázására és stabilizálására. 4 órás kezelés után egy aliquot táptalajt (0,5 ml) eltávolítottunk minden egyes üregből, és -80 ° C-on tároltuk, amíg készen állt a 4-OH-IFA elemzésre. A lemezen maradt sejteket foszfáttal pufferolt sóoldattal mossuk, és kristálylilával festjük. C18 nagyteljesítményű folyadékkromatográfiás vizsgálatot alkalmaztunk a 4-OH-IFA kvantifikálására fluoreszcenciával, miután melléktermékéből az akrolein 7-hidroxi-kinolinná alakult. 32 standard görbét állítottunk elő a 4-OH-CPA számára sejttenyésztő tápközegben (0–40 μM) oldott 4-OOH-CPA felhasználásával. 32 A sejtes IFA 4-hidroxiláz aktivitást a Millennium 32 szoftver által meghatározott integrált csúcsterületekből számoltuk.
A táptalajba felszabaduló CYP3A4-aktivált MMDX metabolitot az alábbiak szerint vizsgáltuk. A CYP3A4-et expresszáló 9L- és CHO-sejteket, valamint a CYP3A4-hiányos kontrollsejteket 12 lyukú lemezekre szélesztettük, lyukanként 1,5 × 105 sejt. Huszonnégy órával később különböző koncentrációjú MMDX-et adtunk a sejtekhez 1,5 ml tápközegben 2 órán át, ekkor a tenyészet felülúszójának 0,5 ml-ét eltávolítottuk a 9L és 9L/3A4 sejttenyészetekből, és összekevertük 0,5 ml oldattal. friss α-MEM + 10% dializált FBS. Ezzel párhuzamosan 0,5 ml tenyészet felülúszót eltávolítottunk az MMDX-vel kezelt CHO sejtvonalakból, és összekevertük 0,5 ml friss DMEM + 10% FBS-sel. Mindegyik mintából 0,2 ml-es alikvot részt adtunk a 9L-sejtek háromszoros lyukaiba, amelyeket 24 órával korábban 3000 sejt/lyuk maggal oltottunk 96-lyukú lemezeken („9L-indikátorsejtek”). A 9L indikátor sejteket 4 napig tenyésztettük 0,2 ml MMDX metabolitokat tartalmazó táptalajban, majd kristály ibolyával festettük, hogy meghatározzuk a relatív sejtszámot az egyes sejtvonalak által az aktív 2 órás MMDX inkubáció során képződött aktív MMDX metabolit szintjének indexeként. időszak.
Humán tumorsejtek adenovírusfertőzése és MMDX citotoxicitási vizsgálatok
Az A549 és U251 sejteket 24 lyukú lemezekre szélesztettük 14 000 sejt/lyuk koncentrációban, és 24 órával később Adeno-3A4-gyel (fertőzés sokasága (MOI) 0–400) fertőztük, akár önmagukban, akár Onyx-017-gyel kombinálva (MOI-k 0, 0,7 és 2). A sejteket 4 órán keresztül inkubáltuk a vírusokkal, lyukanként 0,2 ml tápközegben, majd 0,8 ml friss táptalajt adtunk mindegyik üreghez. A vírust 24 óra elteltével eltávolítottuk, és 1 ml MMDX-t (0–8 nM) tartalmazó friss táptalajt adtunk a sejtekhez. 2 napos MMDX kezelés után a táptalajt további 4 napig 1 ml friss MMDX tartalmú táptalajjal helyettesítjük. A túlélő sejteket ibolya színnel festettük.
Daganatnövekedési késleltetési vizsgálat
Eredmények
A humán CYP3A4 retrovírusos expressziója kemoszenzibilizálja a 9L gliosarcoma sejteket MMDX és IFA hatására
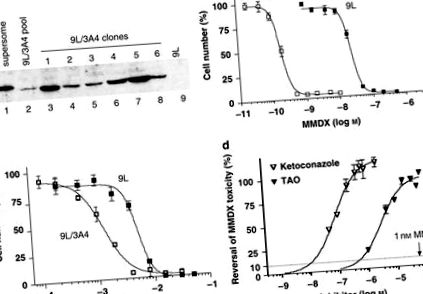
A CYP3A4 cDNS-t kódoló retrovírust használták 9L tumorsejtek megfertőzéséhez, amelyeket a puromicinnel szemben megszerzett rezisztenciájuk alapján választottak ki. A kapott puromicin-rezisztens sejtkészletben CYP3A4 fehérjét detektáltunk, amint azt a Western blot (1a. Ábra) mutatja. Az MMDX iránti fokozott érzékenységet mutató sejtek szelektálása megnövekedett CYP3A4 fehérjeszintű klónokat eredményezett. A 9L/3A4 5-ös klónban volt a legmagasabb a CYP3A4 fehérjetartalom, 15,3 pmol CYP3A4/mg összes sejtfehérje, és minden későbbi kísérletben felhasználták. Az MMDX IC50 értéke a 9L/3A4 sejtekhez viszonyítva (0,2 n M) 120-szor alacsonyabb volt, mint a P450 hiányos 9L sejtek (IC50 = 23,9 n M) (1b. Ábra és 1. táblázat). Az aktivált MMDX ezen erős citotoxicitása ellentétben áll az IFA CYP3A4 prodrugéval, amely millimoláris koncentrációra volt szükség a 9L/3A4 sejtek elpusztításához (1c. Ábra és 1. táblázat). A CYP3A4 metabolizmus szerepének igazolására az MMDX citotoxikus metabolitokká történő aktiválásában a 9L/3A4 sejteket MMDX-sel (1 n M) kezeltük, emellett a CYP3A4 inhibitorok ketokonazol és troleandomicin növekvő koncentrációival. Az MMDX citotoxicitást a ketokonazol (0,5 μM) és a troleandomycin (20 μM) teljesen blokkolta (1d. Ábra).
PA 450 reduktáz túlzott expresszió fokozza az MMDX és az IFA citotoxicitását
Humán tumorsejtek Adeno-3A4 fertőzése
Az Adeno-3A4-et, egy teljes hosszúságú CYP3A4 cDNS-t kódoló E1 és E3 régióból deletált, replikációs hibás adenovírust alkalmaztuk a CYP3A4 expressziójának előidézésére két humán tumor sejtvonalban, az A549 tüdő és az U251 agyrák sejtekben. Az U251 sejtek érzékenyebbek az adenovírusfertőzésre, mint az A549 sejtek, a bakteriális β-galaktozidázt kódoló adenovírus alkalmazásával meghatározva, amelyet a fertőzött sejtek X-gal kromoforikus szubsztráttal történő festésével vizualizálunk (az adatokat nem mutatjuk be). 150 Adeno-3A4 MOI mellett a CYP3A4 RNS ∼ 6000-szeresére nőtt mindkét sejtvonalban, a kvantitatív valós idejű PCR-rel meghatározva (S1A kiegészítő ábra). A CYP3A4 RNS szintje az Adeno-3A4-fertőzött sejtekben (MOI 75) hasonló volt a 9L/3A4 sejtekben található szintekhez. Az Adeno-3A4 dózisfüggő növekedést indukált a CYP3A4 fehérjében (S1B és S2 kiegészítő ábra) és metabolikus aktivitásában is, amelyet 4-OH-IFA képződésével és felszabadulásával vizsgáltunk az IFA-val inkubált sejtek táptalajába (S1C. Kiegészítő ábra). . Összességében a 4-OH-IFA termelése/pmol CYP3A4 fehérje kétszer-négyszerese volt a 9L/3A4 sejtekben, mint az Adeno-3A4-fertőzött A549 és U251 sejtekben.
Az Adeno-3A4 fertőzés dózisfüggő növekedést okozott az MMDX toxicitásban az U251 sejtek felé (IC50 = 1,4 n M 100 MOI-n Adeno-3A4; 3a. Ábra). Az MMDX citotoxikus volt az Adeno-3A4-fertőzött A549 sejtekkel szemben, de csak magas vírusdózisok mellett (IC50 = 4,7 n M 200 MOI mellett; 3b. Ábra) (vö. IC50 (MMDX) = 24 n M az A549 kontrollokban 27). Annak érdekében, hogy a sejteket alacsonyabb Adeno-3A4 MOI-k mellett MMDX-re szenzibilizálják, a sejteket Onyx-017-gyel, E1B-55kd-törléssel eltávolított onkolitikus adenovírussal együtt fertőzték, amely szelektíven replikálódik p53-hiányos tumorsejtekben, és segítő vírusként használható a 2B6 és 2B11 CYP-kat kódoló replikáció-hiányos vírus expressziójának és sejttovábbításának együttesítése és növelése. 6, 34 Az A549 vagy U251 tumorsejtek koinfektálása Adeno-3A4 + Onyx-017-gyel a CYP3A4 RNS 50-60-szoros növekedését eredményezte, összehasonlítva a kizárólag Adeno-3A4-gyel történő fertőzéssel (S3A kiegészítő ábra), amelyhez nagy növekedés társult az Onyx-017-ből származó adenovirális E3 RNS-ben (S3B kiegészítő ábra). A CYP3A4 fehérje azonban csak szerény növekedést ért el, bár a nagyobb molekulatömegű CYP3A4 immunreaktív fehérje fokozott expresszióját mindkét vírussal fertőzött sejtekben is megfigyelték (S2. Kiegészítő ábra). Az Onyx-017 fokozta az Adeno-3A4-függő CYP3A4 metabolikus aktivitást (S3C kiegészítő ábra) és a CYP3A4-függő MMDX citotoxicitást (3c. Ábra), bár sokkal kisebb mértékben, mint a CYP3A4 RNS növekedése (S3A kiegészítő ábra).
Az MMDX citotoxicitása az Adeno-3A4-fertőzött U251-re (a) és az A549 sejtek (b és c), nélkül (a és b) vagy (c) Onyx-017 koinfekció. Az egy éjszakán át 24 üreges lemezekre (14 000 sejt/lyuk) beoltott sejteket önmagukban 24 órán keresztül Adeno-3A4 vagy Adeno-βgal fertõzte meg a megjelölt MOI-n (a és b) vagy Onyx-017 ((c); MOI-n 0,7 és 2). A sejteket MMDX-sel kezeltük friss tenyésztő táptalajban, a megadott koncentrációban, 24 órával a fertőzés után. A táptalajt 2 nappal később friss MMDX-t tartalmazó táptalajra cseréltük, hogy minimalizáljuk a vírus belső toxicitását, és az inkubálást további 5 napig folytattuk (összesen 7 napos MMDX kezelés). Az adatokat a sejtek túlélésének százalékában fejezzük ki a megfelelő gyógyszermentes kontrollokkal összehasonlítva, kristálylila festéssel meghatározva, átlag ± s.d. (n= 3). MMDX hiányában az Adeno-3A4 mérsékelten toxikus volt az U251 sejtekre (⩽ 30% sejtpusztulás 50 és 100 MOI-n), de az A549 sejtekre nem (M 8 MOI-n Adeno-3A4 + 2 MOI Onyx-017 A459 sejtek csak 8 MOI Adeno-3A4-gyel fertőzöttek: MMDX, metoxi-morfolinil-doxorubicin; MOI, a fertőzés sokasága.
A CYP3A4 hatása az MMDX daganatellenes aktivitásra in vivo
Külön kísérletekben a 9L/3A4 tumorokat hordozó egereket MMDX-vel kezeltük i.p. injekció 6 naponta, akár öt injekció sorozataként, 40 μg/testtömeg-kilogramm, vagy négy injekció sorozataként, 60 μg/testtömeg-kilogrammonként. Az i.p.-vel nem tapasztaltunk daganatellenes aktivitást és gazdatoxicitást. az MMDX beadásának módja (2. táblázat). Ezzel szemben az i.v. Az MMDX kezelés erős szisztémás toxicitást váltott ki, négy egérből négy halt el 7 napon belül (9L daganatok), és négy egérből három halt meg 10 napon belül (9L/3A4 daganatok) az első MMDX kezelési ciklus befejezése után (4a. Ábra és 2. táblázat ). Ez a toxicitás a 9–7 és a 9L/3A4 daganatos egerek 3–7 g-os testsúlycsökkenéséből is kiderült, iv. MMDX injekció (4b. Ábra). Bár a 9L/3A4 daganatos egerekben 2–4 g testtömeg-csökkenést figyeltek meg a 10. és 17. napon az első iv. MMDX injekció, a testtömeg helyreállt, és nem történt gyógyszer okozta haláleset (4b. Ábra). Bizonyos toxicitást figyeltek meg az iv. Második ciklusa után. MMDX kezelés, két egér pusztul el a harmadik MMDX injekció után. Így az MMDX közvetlen i.t. a bejuttatás hatékony a CYP3A4-et expresszáló 9L daganatok visszafejlesztésében, drasztikusan csökkent gazda toxicitással az iv. gyógyszeres kezelés.
Vita
Az aktivált MMDX toxicitása nanomoláris előgyógyszer-koncentrációknál nyilvánul meg, ami lehetővé tette számunkra, hogy ezeket a vizsgálatokat olyan MMDX-koncentrációknál végezzük, amelyek> 10 000-szer alacsonyabbak, mint az Km MMDX esetén, 16 μM. 25 Mindazonáltal az MMDX nagyon alacsony koncentrációja ellenére az aktív MMDX metabolit elegendő mértékben képződik ahhoz, hogy befolyásolja a tumorsejtek elpusztulását. Az MMDX magas hatékonysága megmaradt in vivo, ahol az alacsony gyógyszerdózisok (60 μg/testtömeg-kg) jelentős daganatellenes választ váltottak ki, annak ellenére, hogy a keringő MMDX koncentrációja tipikusan M volt a bolus MMDX beadását követően, 51, vagyis> 1000-szer alacsonyabb, mint a Km (MMDX) a CYP3A4 anyagcseréhez. Ezzel szemben az IFA citotoxicitásához a prodrug millimoláris koncentrációjára volt szükség, összhangban az Km (IFA) ∼ 1 m M, amelyet a CYP3A4 mutat. 32
Az Adeno-3A4-gyel fertőzött humán tumorsejtek szerény növekedést mutattak az MMDX érzékenységében, összehasonlítva a retrovírussal fertőzött 9L sejtek esetében tapasztaltakkal. A daganatsejtek további kemoszenzitizálására irányuló erőfeszítések a tumorsejt-replikáló Onyx-017 adenovírus alkalmazásával a replikáció elősegítése és a replikáció-hibás adenovírus expressziójának növelése érdekében P450 vektor 6, 34 csak részben volt sikeres. Noha a daganatos sejtek Onyx-017 + Adeno-3A4-sel történő együttes fertőzése a CYP3A4 RNS 50-60-szoros növekedését eredményezte a kizárólag Adeno-3A4 fertőzéshez képest, a CYP3A4 fehérje és aktivitása csak mérsékelten növekedett. További tanulmányokra lesz szükség az i.t. CYP3A4 fehérje és aktivitása in vivo, Például az NFκB nemrégiben leírt stabilizáló hatásának kihasználásával a CYP3A4 fehérjére, 52 mielőtt ezt a CYP3A4 génterápiát megvalósíthatnánk a klinikán. Mindazonáltal ez a tanulmány bizonyítja a koncepció lehetőségeit CYP3A4 prodrug-aktiváláson alapuló génterápiára a máj CYP3A-aktivitásának magas hátterében.
Összefoglalva, a jelen koncepciókontroll vizsgálatok megalapozzák az MMDX kezelés terápiás hatékonyságát a CYP3A4 géntranszferrel kombinálva, és bemutatják ennek az új gén-prodrug kombinációnak a rákellenes potenciálját. A stratégia klinikai megvalósításához azonban javítani kell a tumorsejtekben a CYP3A4 fehérje expressziójának hatékonyságát. Ezek a tanulmányok a tumorsejtek expressziójának fontosságát is kiemelik, nem pedig a máj CYP3A4 expressziójának szintjét az MMDX elleni hatékony kemoterápiás válaszokhoz génterápiás hiányában, és azt javasolják, hogy a beteg tumorbiopsziákat át kell szűrni a CYP3A4 fehérjeszintekre, hogy azonosítsák. olyan személyek, akik a legnagyobb valószínűséggel részesülnek az MMDX és talán más CYP3A4 prodrugok kezelésében.
- Fizikai aktivitás és a rákos beteg
- Erős csontok a rákkezelés alatt és után
- Reddit - lostit - SV NSV 2 hónap múlva és lefogytam 13 kg-ot ÉS legyőztem a rákot o_O
- A hasnyálmirigyrák elhízási kockázati tényezője; Hasnyálmirigyrák akció
- STS-K001 Beszédátviteli rendszer és hallási hurok