A PIAS1 döntő tényező a prosztatarák sejtjeinek túlélése szempontjából, és érvényes célpont a docetaxel-rezisztens sejtekben
Martin Puhr
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Julia Hoefer
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Hannes Neuwirt
2 IV. Belgyógyászati Klinika (Nefrológia és Hipertónia), Innsbruck Orvostudományi Egyetem, Innsbruck, Ausztria
Iris E. Eder
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Johann Kern
3 Oncotyrol Tumorbiológiai és Angiogenezis Laboratórium, Innsbruck, Ausztria
Georg Schäfer
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Stephan Geley
4 Molekuláris Patofiziológiai Osztály, Innsbruck Biocenter, Innsbruck Orvostudományi Egyetem, Innsbruck, Ausztria
Isabel Heidegger
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Helmut Klocker
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Zoran Culig
1 Kísérleti urológia, Innsbrucki Orvostudományi Egyetem Urológiai Tanszéke, Innsbruck, Ausztria
Társított adatok
Absztrakt
BEVEZETÉS
A kasztrációval szemben rezisztens prosztatarák (CRPC) kezelésére az elmúlt években szisztémás kemoterápiát fejlesztettek ki [1–3]. A kemoterápiás gyógyszer docetaxelt (Taxotere®) az androgén-deprivációs terápia (ADT) sikertelensége után kapják a betegek, a jobb teljes túlélés, a fájdalomcsökkentés, a prosztata-specifikus antigén-válasz és az életminőség alapján [3]. Sok esetben azonban alkalmazása korlátozott a benne rejlő vagy megszerzett docetaxel-rezisztencia miatt [4]. A CRPC-betegek túlélési előnye szerény, csupán néhány hónap [5].
A 4 multifunkcionális tagból álló, PIAS1-től 4-ig terjedő családot tartalmazó aktivált jelátalakító és a transzkripciós faktorok (STAS) (STAS) fehérjéinek gátlói ismertek szerepet játszanak a citokin-jelátvitel modulálásában azáltal, hogy gátolják a STAT-ok aktivitását. [23–25]. A PIAS1-et és a PIAS3-at különösen az interleukin-6 (IL-6) indukálja, amiről már beszámoltak, hogy hatással van a kemoterápiás rezisztenciára [26, 27]. A konzervált SAP domén által közvetített DNS és fehérje megkötő képesség mellett a PIAS fehérjék RING ujjszerű cinkkötő domént (RLD), valamint SUMO interakciós motívumot (SIM) is tartalmaznak, így SUMO-E3 néven működnek. ligázok. Nemrégiben bebizonyosodott, hogy a PIAS1 által közvetített SUMOylation elengedhetetlen a DNS helyrehozásához [28, 29]. Ezenkívül a PIAS1 fontos sejtciklus-szabályozó, amely elősegíti a sejtek proliferációját a p73 és p53 SUMOylation által kiváltott gátlásával [30–32]. Mivel a docetaxel-rezisztens sejtek fő jellemzői az erősen proliferatív viselkedés és az apoptotikus ingerek elnyomása, a fent említett megfigyelések a PIAS1-et érdekes célfehérjévé teszik a további vizsgálatokhoz.
Annak a kérdésnek a megválaszolása érdekében, hogy a PIAS1 célzás alkalmazható-e egy jobb PCa terápiában, elemeztük a PIAS1 expressziót minden stádiumú primer daganatokban, metasztatikus elváltozásokban, docetaxellel végzett kemoterápiát követő betegek szövetében és docetaxel rezisztens sejtvonalakban. Beteg adatainkat funkcionális kísérletek egészítették ki tranziens és stabil PIAS1 in vitro leütés után, valamint csaj chorioallantoic membrán (CAM) vizsgálatokkal és egér xenograft kísérletek in vivo.
Ebben a tanulmányban megerősítjük a megemelkedett PIAS1 expressziót a PCa-ban, és először bizonyítjuk, hogy a PIAS1 emellett szignifikánsan indukálódik a docetaxel-kezelés után a betegeknél, valamint a docetaxel-rezisztens sejtekben in vitro. Ezenkívül a PIAS1 leütése a p21 sejtciklus inhibitor fokozott expressziójához és a Mcl1 szint csökkenéséhez vezet, ezáltal a szülői és docetaxel rezisztens tumorsejtek indukált apoptózisát eredményezi.
EREDMÉNYEK
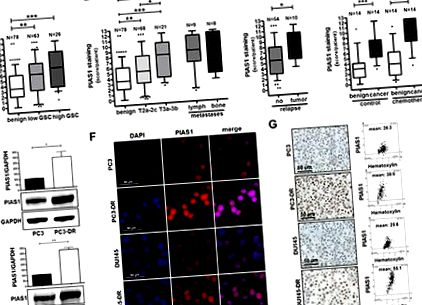
A PIAS1 expresszió megemelkedik primer tumorokban, metasztatikus elváltozásokban és PCa betegeknél docetaxel kemoterápia után
A PIAS1 expresszióját PCa szövetmintákban immunhisztokémiával elemeztük. Statisztikai elemzést mutatunk be a PIAS1 expressziójára 78 jóindulatú és 89 tumormintában radikális prosztatektómia mintákból (A – C), valamint 17 metasztatikus elváltozásban (B), valamint jóindulatú és daganatos szövetmintákban 14 betegből, akik radikális prosztatektómia előtt kemoterápiában részesültek, szemben 14 egyeztetett kontroll pácienssel előzetes kemoterápia nélkül (D). A Box-Whiskers ábrák a medián értékeket képviselik, 10–90 percentilisek (*, p (1E ábra). 1E). Az immunfluoreszcencia és az immunhisztokémiai festés megerősítette a Western blot eredményeket (1F. Ábra, G). Úgy tűnik, hogy a docetaxellel kezelt sejtekben a PIAS1 felfelé történő szabályozása a rezisztencia kialakulására korlátozódik. A nem rezisztens sejtek rövid távú kezelése docetaxellel gátló hatást váltott ki a PIAS1 expresszióban (S2A kiegészítő ábra). Tekintettel arra, hogy maga a PIAS1 szabályozható a sejtciklus progresszióján keresztül [31], a megfigyelt hatás oka lehet a szülői sejtek proliferatív leállása a gyógyszeres kezelés hatására. A PIAS1 rezisztens sejtekben történő szabályozása tehát hosszú távú hatás. Következésképpen az docensxel-rezisztens DU145-ben az NFκB-p100 és két STAT-családtag, nevezetesen a STAT3 és a STAT5 (kiegészítő ábra S2B) szintjét figyeltük meg szülői társaikkal összehasonlítva, rámutatva a STAT jelátvitel egyik kapcsolójára is. Összességében ezekből a megállapításokból arra következtetünk, hogy i) a PIAS1 túlzottan expresszálódik helyi és metasztatikus PCa-ban; ii) a PIAS1 expressziója tovább indukálódik a prosztatarákban docetaxellel végzett kemoterápiás kezelés után; és iii) a docetaxel-kezelést túlélő PCa-sejtek in vitro jelentősen megemelték a PIAS1 szintet, ami a PIAS1 alapvető szerepére utal a PCa progressziója és a terápiás rezisztencia során.
A PIAS1 leütése a p21 felfelé történő szabályozásával csökkent sejtszaporodáshoz vezet
(A) Az apoptotikus sejtek arányát 6 nap után mértük áramlási citometriával PI-festés után. Az adatok 3 független kísérlet átlagát + SEM-et mutatják (*, p (3C ábra). 3C). A PIAS1 leütése szintén csökkentette a Mcl1 anti-apoptotikus fehérje expresszióját (Mcl1 ábra (3C ábra). 3C). A PIAS1 és Mcl1 közötti hierarchikus kapcsolat feltárására siRNS leütést és az azt követő Western blot-ot végeztünk mindkét fehérje esetében. Megfigyeltük, hogy a PIAS1 leütése befolyásolja a Mcl1 expresszióját; A Mcl1 kimerülés viszont nem volt hatással a PIAS1 szintre a docetaxel-rezisztens sejtekben, ami azt jelzi, hogy a PIAS1 a Mcl1-től felfelé helyezkedik el (ábra (3D ábra). 3D). Azt is megkérdeztük, hogy a PIAS1 downreguláció befolyásolja-e a Bcl-2 család többi tagjának expresszióját, és megállapítottuk, hogy sem a Bcl-2, sem a Bcl-xL expressziója mindkét sejtvonalban folyamatosan változik a PIAS1 leütést követően (S2C. Kiegészítő ábra). Annak tesztelésére, hogy a PIAS1 kimerülése után a csökkent Mcl1 szint valóban elegendő lehet-e az apoptózis kiváltásához, megmértük a sub-G1 sejtek százalékos arányát a Mcl1 leütés után. A Mcl1 kimerülés az apoptózis szignifikáns növekedését okozta, amely hasonló volt a szülői és a rezisztens sejtekben, azonban a hatás a PIAS1 visszaszorítása után volt még hangsúlyosabb (S3A-C kiegészítő ábra).
Ezek az adatok együttesen azt sugallják, hogy a PIAS1 expresszió döntő fontosságú a szülői és docetaxel rezisztens sejtek túlélése szempontjából, mivel a PIAS1 leütése csökkent sejtproliferációt és megnövekedett apoptózist eredményez.
A Mcl1 fehérje expressziója megemelkedik docetaxel-rezisztens sejtvonalakban, primer PCa-daganatokban, metasztatikus elváltozásokban és docetaxel kemoterápiát követő betegeknél
Figyelembe véve a PIAS1 és Mcl1 közötti megfigyelt kapcsolatot, amint azt a 3. ábra 3. ábrán leírjuk, és a Mcl1 ismert szerepét a PCa progressziójában annak anti-apoptotikus hatása miatt, a Mcl1 expressziót docetaxel-rezisztens sejtekben és docetaxellel kezelt betegek szövetében vizsgáltuk. A Western blot elemzés szignifikánsan megemelkedett Mcl1 expressziót mutatott ki a PC3-DR és a DU145-DR sejtekben (átlagosan 2,5-szeres növekedés) a szülői társaikhoz képest (ábra (4A ábra). 4A). Az összes átvilágított sejtvonal immunfluoreszcenciája és immunhisztokémiai festése megerősítette Western blot eredményeinket (4B. Ábra, C). Ezenkívül a PC3 és PC3-DR sejtek citoplazmatikus és magfrakcióinak szétválasztása fokozott Mcl1 expressziót mutatott ki a PC3-DR sejtek mindkét sejtrészében (ábra (4D ábra 4D).
(A) A Mcl1 fehérje expressziója megnő a PC3-DR és a DU145-DR sejtekben, összehasonlítva a szülő társaikkal. Az adatok 3 független kísérlet átlagának + SD-jének felelnek meg (*, p (4E ábra). 4E). Továbbá a Mcl1 expresszió szignifikánsan megemelkedett a daganatok rosszindulatú területein, amelyeket a műtét előtt docetaxellel kezelt betegeknél kaptak, a megfelelő jóindulatú szövetekhez képest. A docetaxel-kezelés nem befolyásolta a jóindulatú minták Mcl1-expresszióját. Feltűnő, hogy a kemoterápiás csoport rosszindulatú területein a Mcl1 fehérje szignifikánsan indukálódott a kontroll csoporthoz képest (4E. Ábra, F). Végül a nyirokcsomó és a csont áttétek immunhisztokémiai elemzése jelentősen megnövelte a Mcl1 festést metasztatikus elváltozásokban a jóindulatú mintákhoz képest (4E. Ábra, F). Ezért arra a következtetésre jutunk, hogy a PIAS1-hez hasonló Mcl1 fehérje túlzott mértékben expresszálódik primer és metasztatikus PCa-ban, és a docetaxel-kezelés után is tovább emelkedik.
A PIAS1 leütés befolyásolja a PC3 és PC3-DR CAM onplantátumok tumor növekedését
Miután megmutattuk, hogy a PIAS1 leütés in vitro fokozott apoptózist eredményez, a továbbiakban arra törekedtünk, hogy megerősítsük eredményeinket in vivo. Ezért megvizsgáltuk a PIAS1 down-szabályozásának következményeit a PC3 és PC3-DR tumor növekedésére egy CAM assay-ben. Erre a célra hoztunk létre PC3 és PC3-DR alvonalakat, amelyek tartalmazzák a PIAS1-re (shPIAS1-1, shPIAS1-3) célzó doxiciklin által indukálható GFP-jelölt shRNS-vektort vagy a luciferáz elleni shRNS-t tartalmazó kontrollvektort (shLuc) tartalmazó alvonalakat. A kontroll kísérletek során kizárták a doxiciklin lehetséges toxikus mellékhatásait. A doxiciklin 4 μg/ml koncentrációig in vitro nem befolyásolta a sejtproliferációt a PC3shLuc és PC3-DRshLuc sejtekben (S4. Kiegészítő ábra). Mindkét PIAS1 shRNS szekvencia szignifikánsan csökkentette a PIAS1 fehérje expresszióját a PC3 és a PC3-DR alsejtvonalakban, ami csökkent sejtproliferációt eredményezett. Az shPIAS1-3 szekvenciának azonban kifejezettebb anti-proliferatív hatása volt mindkét tesztelt sejtvonalban. Az indukálható rendszer 1 μg/ml doxiciklinnel történő aktiválása elegendő volt a PIAS1 expresszió és ennek következtében a proliferáció csökkentéséhez (S5A-D kiegészítő ábra).
Meglepő módon a PIAS1 6 napos leütése az shPIAS1-3 szekvencia és 1 μg/ml doxiciklin alkalmazásával a PC3 (5A, C ábra) és a PC3-DR (5B, D ábra) sejtproliferációjának és tumormennyiségének jelentős csökkenését eredményezte. onplantátumok a CAM kísérletben. Ezeket a megállapításokat megerősítette a szignifikánsan csökkent Ki67 pozitív sejtek száma az összes shPIAS1-3 onplantátumban, valamint a csökkent PIAS1, Ki67 és Mcl1 immunreaktivitás PC3-ban, valamint a specifikus shPIAS1-3 kezelési csoport PC3-DR sejtjeiben (1. ábra). 5A, B).
(A – B) Reprezentatív fénymező- és fluoreszcencia képek teljes daganatokról, valamint reprezentatív képek, amelyeket a tumor keresztmetszetének immunhisztokémiai Ki67, PIAS1 és Mcl1 festése után készítettek. (C, D) A PC3 és a PC3-DR daganatok daganatterületének és Ki67 pozitív sejtjeinek (sejtek/cm 2 tumor keresztmetszete) statisztikai elemzése. Az adatok 5 önnövény átlagát + SD/kezelést jelentik 2 független kísérletben (***, p 6A, B). Sőt, a PC3 xenograft 7 egéréből 3 és a PC3-DR xenograft 7 egéréből 5 nem volt kimutatható tumortömeg a vizsgálat végén, ami a tumor teljes regresszióját mutatta a PIAS1 leütés után. A daganat térfogatának és tömegének meghatározása a kísérlet végén mindkét paraméter szignifikáns csökkenését mutatta ki azokban a daganatokban, amelyek a PIAS1 kimerült sejtjeiből származnak (6C. A daganatok ezt követő immunhisztokémiai festése megerősítette a PIAS1 leütését a specifikus kezelési csoportban, és emellett csökkent Mcl1, Ki67 és megemelkedett p21 expressziót mutatott ki a kontroll csoport daganataihoz képest (6E, F ábra; S6 kiegészítő ábra).
A specifikus PIAS1 leütés a doxiklin által indukálható rendszer aktiválásával a tumor térfogatának jelentős csökkenéséhez vezet (A, B) és a tumor súlya (C, D) az shPIAS1-3 + dox kezelési csoportban a kontroll csoportokhoz képest (*, p 2 első szál kit (Qiagen). qRT-PCR-t máshol leírtak szerint végeztünk [48]. A TATA-Box kötő fehérjét (TBP) választottuk endogén expressziós standard (előremenő 5′-CACGAACCACGGCACTGATT-3 ′; fordított 5′-TTTTCTGCTGCCAGTCTGGAC-3 ′; szonda 5′-FAM-TCTTCACTCTTGGCTCCTGTGCACA-TAMRA-3 ′). PIAS1, assay, p21 az Applied Biosystems cégtől, a gyártó protokolljának megfelelően használtuk.
Western blot
Western-blotot a korábban leírtak szerint hajtottunk végre [48]. A következő antitesteket használtuk: anti-GAPDH (1: 100000; Chemicon, Bécs), anti-Mcl1 (1: 500; Santa Cruz), anti-cPARP (1: 1000; Promega, Madison, WI), anti-PIAS1 ( 1: 500; Cell Signaling, Danvers, MA), anti-p21 CIP1/WAF1 (1: 500; Cell Signaling), anti-p100 (1: 500; Cell Signaling), anti-STAT3 (1: 1000; Santa Cruz), anti-STAT5, (1: 1000; Santa Cruz), anti-Bcl-2 (1: 500; Sejtjelzés) és anti-Bcl-xL (1: 500; Sejtjelzés).
[3H] timidin beépülése, WST assay és apoptózis mérés
A [3H] timidin beépüléséhez és a WST-vizsgálatokhoz a sejteket 2,5 × 103/üreg sűrűségben, három ismétlésben, külön 96 lyukú lemezekre oltottuk. Az apoptózis mérésére a sejteket 1,5 × 105/mélyedés sűrűségben oltottuk 6-lyukú lemezekre. A sejteket kétszer transzfektáltuk 6 nap alatt. A doxiciklinnel indukálható alsejtvonalakat tenyésztettük doxiciklin jelenlétében vagy hiányában. A timidin beépülését a korábban leírtak szerint mértük [48]. A sejtproliferáció és életképesség indexeként WST-vizsgálatot (Roche) hajtottak végre a gyártó protokollja szerint. Az apoptotikus sejtek százalékos arányát a korábban leírtak szerint értékeltük [33].
A doxiciklin által indukálható shRNS konstrukciók létrehozása
PC3 és PC3-DR sejteket stabilan fertőzött doxiciklin-indukálható shRNS konstrukciókkal szemben PIAS1 vagy luciferáz [(shPIAS1-1, 5'-GATCCCC AAGGTCATTCTAGAGCTTTA TTCAAGAGA TAAAGCTCTAGAATGACCTT TTTTTGGAAA-3 '; shPIAS1-3, 5'-GATCCCC CGAATGAACTTGGCAGAAA TTCAAGAGA TTTCTGCCAAGTTCATTCG TTTTTGGAAA- 3 ′ vagy shLuc, 5′-GATCCCC CTTACGCTGAGTACTTCGA TTCAAGAGA TCGAAGTACTCAGCGTAAG TTTTTGGAAA-3 ′. A konstrukciók előállítását és transzfektálását a korábban leírtak szerint végeztük [49].
CAM assay
A CAM-vizsgálatot a máshol leírtak szerint végeztük [50], kis módosításokkal. A növények előkészítéséhez natív, nem pepszinezett I. típusú patkány farok kollagént (BD Bioscience, Bedford, MA) 0,2 M NaOH-oldattal semlegesítettünk és 10x DMEM tápközeggel kevertünk. 5x10 5 PC3 vagy PC3-DR sejtet adtunk 50 μl oldathoz. Kollagén-növényeket doxiciklinnel vagy anélkül (1 μg/ml) adtunk a CAM-okra, és 5 napig inkubáltuk. A xenograftokat sztereomikroszkóp alatt, digitális fényképezőgéppel (Olympus SZX10, Olympus E410, Bécs) elemeztük. A szövettani elemzéshez az ontványokat kivágtuk a CAM-ból, 4% paraformaldehidben rögzítettük, majd feldolgoztuk paraffin szekcionálásra és IHC-re. A következő antitesteket használtuk: anti-PIAS1 (1: 400; Abcam), anti-Mcl1 (1: 200; Santa Cruz) és anti-Ki67 (1: 100; DAKO, Glostrup, Dánia).
Humán prosztatarák-xenograftok létrehozása és kezelése meztelen egerekben
Statisztikai analízis
A statisztikai elemzésekhez az SPSS-t (V15.0) és a GraphPad Prism 5-et használtuk. Valamennyi kísérlet esetében meghatároztuk a Gauss-eloszlást Kolmogorov-Smirnov-teszt alkalmazásával. A kezelési csoportok közötti különbségeket Student t-tesztjével vagy Mann – Whitney U-tesztjével elemeztük. A 0,05 alatti P értékeket szignifikánsnak tekintettük. A tumor térfogatát/idejét többszörös teszteléssel korrigáltuk Bonferroni módszerrel, minden in vivo xenograft kísérletben. A csillagokkal jelölt összes különbség statisztikailag szignifikáns volt, amint azt az ábrák jelmagyarázatai kódolják (* P (4.5M, pdf)
Köszönetnyilvánítás
Ezt a munkát az Innsbrucki Orvostudományi Egyetem intramurális finanszírozási programja támogatta fiatal tudósok számára, a MUI-START, a 2010012007 projekt és az FWF P 25639-B19 (MP-nek) és W1101 (ZC) támogatásai.
A szerzők köszönetet mondanak Irma Sottsasnak, Karin Unterbergernek és Andrea Eigentlernek a TMA előkészítésért, a paraffin beágyazásáért és az immunhisztokémiai festésért, Mag. Eberhard Steiner a betegek kiválasztásához és statisztikai elemzéséhez, Dr. Walter Parson a sejtvonal-hitelesítéshez, Dr. Yaron Galanty (Cambridge-i Egyetem) a PIAS1 konstrukciók nagylelkű megosztásáért, Cornelia Heis a CAM tumorok IHC festéséért és Veronika Rauch a vírusfertőzésekkel kapcsolatos segítségért . A szerzők köszönetet mondanak Dr. Bettina Schlicknek a foltos sejtek mennyiségi meghatározásához nyújtott segítségért, valamint Dr. Natalie Sampsonnak, Dr. Holger Erbnek és Dr. Petra Massonernek a hasznos beszélgetésekért.
Lábjegyzetek
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
Szerzői hozzájárulások
MP létrehozta a projektet és feltételezte a hipotézist. Minden kísérletért ő volt felelős és megírta a kéziratot. JH immunfluoreszcens festést végzett, és segített a proliferációs és életképességi vizsgálatok végrehajtásában. HN és IE MP-vel együtt felelősek voltak az in vivo kísérletek végrehajtásáért. GS volt felelős a TMA létrehozásáért, és MP-vel együtt elemezte a festett betegmagokat. JK elvégezte és elemezte a CAM vizsgálatokat. Az SG és az IH segített a doxiciklin által indukálható alsejtvonalak létrehozásában. A HK felügyelte a TMA létrehozását. A ZC segített a kísérletek koordinálásában. Ezenkívül minden társszerző segített az írásban, javította a kéziratot és jóváhagyta annak végleges változatát.
- A prosztatarák jelei és tünetei
- Peter Facinelli 30 kg súlycsökkenést mutat be, félmeztelenül a prosztatarák ellen
- Elhízás és prosztatarák Mit kell tudni Cedars-Sinai
- Elhízás és mellrák túlélése Beszélgetés Anne McTiernannal - Amerikai Rákkutató Intézet
- Az emlőrák túlélése