A testmozgás visszafordítja a magas zsírtartalmú étrend által kiváltott károsodásokat az inzulinjelző kaszkád komponenseinek rekeszizálódása és aktiválása során a vázizomzatban
Absztrakt
Kísérleti terv.
Az összes kísérleti eljárást a Kaliforniai Állami Egyetem Northridge Intézményi Állatgondozási és Felhasználási Bizottsága hagyta jóvá, és megfelelt a laboratóriumi állatok felhasználására vonatkozó, az Egyesült Államok Egészségügyi és Emberi Erőforrások Minisztériuma által kiadott irányelveknek.
Hátsó szárú perfúziók.
Az állatokat pentobarbitál-nátrium (6,5 mg/testtömeg 100 g) intraperitoneális injekcióval érzéstelenítjük, és műtéti úton előkészítjük a hátsó végtag perfúziójára, Ruderman és munkatársai által korábban leírtak szerint. (47) és módosította Ivy és mtsai. (28) A műtéti előkészítést követően kanülöket illesztettek a hasi aortába és a vena cava-ba, és az állatokat pentobarbitál intrakardiális injekciójával leöltük, amikor a hátsó végtagokat 30 ml Krebs-Henseleit pufferrel (KHB; pH 7,55) mostuk. A kanüleket azonnal egy nem recirkuláló perfúziós rendszerrel helyezték el, és a hátsó végtagokat hagyták stabilizálódni egy 5 perces mosási periódus alatt. A perfuzátumot folyamatosan gázosítottuk 95% O2-5% CO2 elegyével és 37 ° C-ra melegítettük. A perfuzátum áramlási sebességét 7,5 ml/perc értékre állítottuk be a stabilizálás és az azt követő perfúzió során, amelynek során meghatároztuk a glükóz transzport sebességét.
A perfúziókat jelenlétében (n = 8/csoport) vagy hiány (n = 8/csoport) 500 μU/ml inzulin. Az alap perfuzátum tápközeg 30% mosott, lejárt emberi eritrocita (Ogden Medical Center, Ogden, UT), KHB, 4% dializált szarvasmarha szérum albumin (Fisher Scientific, Fair Lawn, NJ) és 0,2 mM piruvát. A hátsó végtagokat 1 mM glükózt tartalmazó perfuzátummal mostuk ki 5 percig a glükóz transzport mérésének előkészítése céljából. A glükóztranszportot egy 8 perces periódus alatt mértük a nem metabolizált glükóz analóg 3 8 mM koncentrációjával-O-metil-glükóz (3-MG; 32 μCi 3- [3 H] MG/mM; PerkinElmer Life Sciences, Boston, MA) és 2 mM mannit (60 μCi [1-14 C] mannit/mM; PerkinElmer Life Sciences). Közvetlenül a szállítási periódus után az RG egyes részeit kivágtuk mindkét hátsó végtagból, hideg KHB-vel nedvesített gézre foltoztuk, fagyasztva lezártuk N2 folyadékban, és későbbi elemzés céljából -80 ° C-on tároltuk.
3-MG szállítás.
Az inzulinnal stimulált vázizom 3-MG transzportjának sebességét a korábban leírtak szerint számoltuk (39, 56, 57).
Izomhomogenizálás a Western-blotoláshoz.
Az RG-ből részeket kivágtunk, fagyasztva lemértük, és jéghideg homogenizációs pufferben (1:10 tömeg/térfogat) homogenizáltunk, amely 50,0 mM HEPES-t (pH 7,6), 150 mM NaCl, 20 mM Na-pirofoszfát, 20 mM β-glicerofoszfátot tartalmaz., 10 mM NaF, 2 mM ortovanadát, 2 mM EDTA, 1% IGEPAL, 10% glicerin, 2 mM fenilmetil-szulfonil-fluorid, 1 mM MgCl2, 1 mM CaCl2, 10 μg/ml leupeptin és 10 μg/ml aprotinin. A homogenizátumot ezután egy mikrocentrifuga csőbe vittük és centrifugáltuk (19 600 g, 4 ° C) hűtött mikrocentrifugában (Micromax RF; International Equipment, Needham Heights, MA) 15 percig. A felülúszót összegyűjtöttük, lizátumnak jelöltük, és megvizsgáltuk a fehérjekoncentrációt a Bradford-módszerrel (5), amelyet Benchmark mikrolemez-olvasóval (Bio-Rad, Richmond, CA) alkalmaztunk.
A plazmamembrán frakcionálása.
A plazmamembrán-frakciókat a korábban leírtak szerint állítottuk elő (42). Ez az eljárás egy dúsított plazmamembrán-frakciót és egy citoszol-frakciót biztosít, amely nélkülözi a plazmamembránokat (46). Röviden, az RG egy részét 8 × (tömeg/térfogat) jéghideg pufferben homogenizáltuk, amely 20 mM HEPES-t (pH 7,4), 2 mM EGTA-t, 50 mM β-glicerofoszfátot, 1 mM ditiotreitolt, 1 mM Na3VO4-et, 10% -ot tartalmaz. glicerin, 3 mM benzamidin, 10 μM leupeptin, 5 μM pepstatin A és 1 mM fenil-metil-szulfonil-fluorid. A homogenizátumot 100 000-nél centrifugáltuk g 30 percig 4 ° C-on, és a felülúszót citoszolos frakcióként összegyűjtjük. Az üledéket 4x (tömeg/térfogat) jéghideg homogenizációs pufferben keverjük, majd 1% Triton X-et adunk hozzá. Az újraszuszpendált pelletet ezután 15 000-nél centrifugáltuk g 10 percig 4 ° C-on. A plazma membránfrakciót képviselő felülúszót összegyűjtöttük.
Western blottolás.
Akt2 kináz aktivitás.
aPKCζ/λ aktivitás.
Ötszáz mikrogramm RG citoszolos vagy plazmamembránfehérjét adtunk 4 μg anti-aPKCζ/λ-hoz (sc-216; SCBT), és egy éjszakán át inkubáltuk 4 ° C-on. Száz mikroliter Pro-A gyöngyöket tartalmazó szuszpenziót egyesítettünk mindegyik mintával, és 4 órán át forogva inkubáltuk 1,5 órán át. Inkubálás után a mintákat centrifugáltuk (18 300 g, 4 ° C) 10 percig, és az immunkomplexet a PI 3-kináz aktivitásnál leírtakkal megegyező eljárással mossuk (49). A mosási protokoll után a mintákat centrifugáltuk (18 300 g, 4 ° C) 10 percig, és a felülúszót eldobjuk. Ezután a Pro-A gyöngyöket 75 μl kináz pufferben szuszpendáltuk. A kináz reakciót 5 μCi [γ-32 P] ATP (PerkinElmer Life Sciences), 40 μM ATP és 5 μl mielin bázikus fehérje (M8-184; Sigma-Aldrich, St. Louis, MO) kombinálásával indítottuk el. A mintákat periodikusan vortexeltük, miközben 12 percig 37 ° C-on inkubáltuk. A reakciókat Laemmli puffer (1: 1) hozzáadásával állítottuk le. Az elemzéshez 15 μl minta/Laemmli puffert SDS-PAGE-nak vetünk alá redukáló körülmények között, 20% Tris-tricin felbontó gélen. Elektroforézis után a géleket műanyag csomagolásba csomagoltuk, és 8 órán át foszforszitán tettük ki. A képeket a fent leírt módon rögzítettük és számszerűsítettük.
IRS-1 tirozin és szerin foszforilezése.
Hatvan mikroliter Pro-A szuszpenziót, amelyet anti-IRS-1 antitesttel (kat. Sz. 06-248; UBT) vonunk be, 500 μg RG-lizátum fehérjéhez adunk, és 2 órán át 4 ° C-on inkubáljuk. . Inkubálás után a mintákat centrifugáltuk (18 300 g, 4 ° C) 10 percig, és az immunkomplexet mossuk. A Pro-A gyöngyöket 30 μl Laemmli-pufferben szuszpendáltuk, 7,5% -os rezolváló gélen SDS-PAGE-nak vetettük alá, és a fent leírtak szerint polivinilidén-difluorid membránokba helyeztük. Ezután a membránokat Western-blottolásnak vetjük alá, és a fehérjéket a fent leírtak szerint vizualizáljuk és mennyiségileg meghatározzuk anti-foszfotirozin (kat. Sz. 02-247; UBT) vagy anti-fosfo IRS-1 Ser 307 (kat. Sz. 02-) alkalmazásával. 247; UBT) mint elsődleges antitest.
Statisztikai analízis.
Az egyváltozós varianciaanalízist minden változónál alkalmazták annak megállapítására, hogy vannak-e szignifikáns különbségek a csoportok között. Amikor jelentős F arányt kaptunk, Tukey HSD post hoc tesztet használtunk a statisztikailag szignifikáns különbségek azonosítására (P
Asztal 1. A testtömeg és a zsírpárna tömegű lipideket eltávolítottuk erről az asztalról
Az értékek átlag ± SE. NORCON, normál étrend, kontroll állatok; HFC, magas zsírtartalmú étrend, kontroll állatok; HFX, magas zsírtartalmú étrend, testedzésre edzett állatok; HFRSG, magas zsírtartalmú étrend, roziglitizonnal kezelt állatok; HFRX, magas zsírtartalmú étrend, roziglitizonnal kezelt, testedzést végző állatok.
* Jelentősen eltér a NORCON-tól (P # jelentősen eltér a HFC-től (P A 307 foszforiláció fokozódott a többi állathoz képest (P 307 foszforilációt expresszáltak az IRS-1 fehérjekoncentrációhoz viszonyítva, és azt találták, hogy a szerin foszforilációja megnövekedett (P 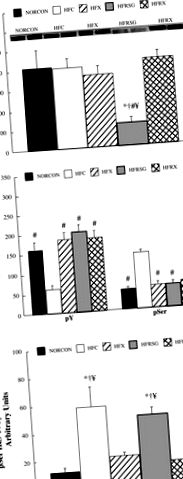
1. ábra.Az inzulinreceptor szubsztrát-1 (IRS-1) fehérje koncentrációja (A), IRS-1 tirozin (pY; B) és a Ser 307 (pSer) foszforilációja, valamint a pSer és az IRS-1 fehérjekoncentráció aránya (C) inzulinnal stimulált vázizomzatban, amelyet normál étrendből, kontrollból (NORCON) nyernek; magas zsírtartalmú étrend, kontroll (HFC); magas zsírtartalmú étrend, edzésre edzett (HFX); magas zsírtartalmú étrend, roziglitizonnal kezelt (HFRSG); és magas zsírtartalmú étrend, roziglitizonnal kezelt, testedzéssel (HFRX) kezelt állatok. * Jelentősen eltér a NORCON-tól (P
Akt2 fehérjekoncentráció.
A citoszolos Akt2 fehérje koncentrációja nem különbözött inzulin hiányában vagy jelenlétében a csoportok között (2. ábraA). Ezenkívül a plazmamembrán Akt2 fehérjekoncentrációja nem különbözött a csoportok között sem inzulin hiányában, sem jelenlétében (2. ábraB).
2. ábra.Citoszolos Akt 2 fehérjekoncentráció (A) és a plazmamembrán Akt2 fehérjekoncentrációja (B) NORCON, HFC, HFX, HFRSG és HFRX állatoktól nyerték. Az értékek átlag ± SE.
aPKCζ és -λ fehérjekoncentráció.
A citoszolos aPKCζ fehérje koncentrációja hasonló volt a csoportok között inzulin hiányában vagy jelenlétében (3. ábraA). Hasonlóképpen, a citoszolos PKCλ fehérje koncentrációja nem különbözött az egyes csoportok között inzulin hiányában vagy jelenlétében, kivéve a HFRX értéket, amely nagyobb volt, mint a NORCON csoporté bazális körülmények között (P
3. ábra.Citoszolos atipikus protein kináz Cζ (aPKCζ) fehérje koncentráció és (A) plazma membrán aPKCζ fehérje koncentráció (B) NORCON, HFC, HFX, HFRSG és HFRX állatokból származnak. * Jelentősen eltér a NORCON-tól (P
4. ábra.Citoszolos aPKCλ fehérje koncentráció (A) és a plazmamembrán aPKCλ fehérje koncentrációja (B) NORCON, HFC, HFX, HFRSG és HFRX állatoktól nyerték. * Jelentősen eltér a NORCON-tól (P
Inzulin hiányában a HFC állatok plazmamembránhoz kapcsolódó aPKCζ fehérje koncentrációja alacsonyabb volt (P
5. ábra.Citoszolos Akt2 aktivitás (A), plazma membrán Akt2 aktivitás (B), citoszolos aPKCζ/λ aktivitás (C) és a plazma membrán aPKCζ/λ aktivitása (D) NORCON, HFC, HFX, HFRSG és HFRX állatoktól nyerték. * Jelentősen eltér a NORCON-tól (P
aPKCζ/λ aktivitás.
A citoszolos aPKCζ/λ aktivitás bazális körülmények között hasonló volt a NORCON, a HFC és a HFX között (5. ábraC). A bazális citoszolos aPKCζ/λ aktivitás a HFRSG és HFRX csoportokban megemelkedett (P
6. ábra.A citoszolos glükóz transzporter 4 (GLUT4) fehérje koncentrációja (A) és a plazma membrán GLUT4 fehérje koncentrációja (B) NORCON, HFC, HFX, HFRSG és HFRX állatoktól nyerték. * Jelentősen eltér a NORCON-tól (P
Az inzulinnal stimulált szénhidrát-anyagcsere a magas zsírtartalmú állatok vázizomzatában jelentősen károsodott, amit a 3-MG transzport (43) és a plazmamembrán GLUT4 fehérje koncentrációjának csökkenése bizonyít a normál étrendű állatokhoz képest. Ezek a megfigyelések összhangban vannak számos korábbi jelentéssel, amelyek szintén kimutatták, hogy a magas zsírtartalmú étrend csökkenti az inzulin által stimulált glükóz transzportot (4, 8, 20, 21, 37, 39, 49, 54, 56), PI-3 kináz aktivitás (39, 49, 52, 57) és a plazma membrán GLUT4 fehérje koncentrációja (21, 49, 52, 56, 57) a rágcsáló vázizomzatában. Ezenkívül a magas zsírtartalmú állatokban a citoszolos inzulinnal stimulált Akt2 és aPKCζ/λ aktivitás csökkent, bár az Akt2, aPKCζ és az aPKCλ fehérje koncentrációja nem változott. Ezenfelül ezek a megfigyelések összhangban vannak a legutóbbi jelentéssel (23) és más kutatók (30, 39, 52) megfigyeléseivel, akik szintén kimutatták, hogy az Akt2 és az aPKCζ/λ aktivitás csökken a teljes fehérjekoncentráció és a foszforiláció változásának hiányában.
A plazmamembrán fehérje koncentrációját és az Akt2 aktivációját illetően nem találtuk, hogy az inzulin a plazma membránnal társított Akt2 fehérje koncentrációt vagy aktivitást növelte a bazális szint fölé. Ezzel szemben a plazma membrán fehérje koncentrációja és az aPKCζ és -λ fehérje aktivációja a magas zsírtartalmú vázizomban az inzulinra adott válaszként az alapszint fölé emelkedett, de az aPKCζ és -λ, valamint az aPKCζ/A magas zsírtartalmú vázizomzat λ aktivitása kisebb volt, mint a normál étrendű állatoké. Ezek az eredmények összhangban vannak korábbi megfigyeléseinkkel (23).
Összegzésként új bizonyítékokat szolgáltatunk arra vonatkozóan, hogy a magas zsírtartalmú táplálás nem változtatja meg a citoszolos Akt2 vagy az aPKCζ és -λ fehérje koncentrációt a normál étrend fogyasztásához képest. Inkább az inzulinnal stimulált citoszolos Akt2 és aPKCζ/λ aktivitások, az inzulin által stimulált plazmamembránhoz kapcsolódó aPKCζ és -λ fehérje koncentrációk, az aPKCζ/λ aktivitás és a GLUT4 fehérje koncentrációja csökken a magas zsírtartalmú állatokban. Különösen figyelemre méltó, hogy az aerob testmozgás megfordította a magas zsírtartalmú étrend hatásait, így az inzulin által stimulált rekeszek és az inzulinjelző kaszkád komponenseinek aktiválása hasonló volt a normál étrendű kontroll állatokéhoz. A roziglitazon nem fordította vissza a magas zsírtartalmú étrend által kiváltott glükóz metabolizmus károsodását a vázizomzatban, nem fokozta a testmozgás hatását, sőt egyes esetekben még a testedzés pozitív hatásait is gátolta. Ezek a megállapítások azt sugallják, hogy a krónikus testedzés, a rosiglitazon kivételével, visszafordíthatja a magas zsírtartalmú étrend által kiváltott károsodásokat az inzulin-jelző kaszkád komponenseinek kompartmentalizációjában és aktiválásában a vázizomzatban.
Ezt a tanulmányt az Ausztrál Kutatási Tanács (J. A. Hawley; DP0663862) és a Nemzeti Egészségügyi Intézetek (B. B. Yaspelkis; GM-48680, GM-08395 és DK-57625) támogatásával támogatták.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Köszönjük a GlaxoSmithKline-nak (Stevenage, Egyesült Királyság) a roziglitazon ajándékát.
Jelenlegi cím D. A. Rivas számára: Gyakorlási anyagcsere csoport, Orvostudományi Kar, RMIT Egyetem, Bundoora, Victoria Australia.
- A ginzeng étrend-kiegészítők hatása a magas zsírtartalmú étrend által kiváltott elhízásra C57BL6 egerekben -
- A testedzés megváltoztatja a magas zsírtartalmú takarmányozás hatását az sertések ACTH stresszválaszára - PubMed
- Könnyebb a testmozgáshoz Ez a 30 perces edzés tökéletes a kezdők számára
- A napi 15 perc edzés 3 évvel meghosszabbítja az élettartamot - Harvard Health
- Gyakoroljon napi 1 órát a súlygyarapodás elkerülése érdekében