Elhízás és inzulinrezisztencia
Az elhízás és a 2-es típusú cukorbetegség összefüggését évtizedek óta felismerték, és ennek a kapcsolatnak a legfőbb alapja az elhízás képessége az inzulinrezisztencia kialakítására. Az inzulinrezisztencia a 2-es típusú cukorbetegség etiológiájának alapvető szempontja, és más patofiziológiai következmények széles skálájához kapcsolódik, beleértve a magas vérnyomást, a hiperlipidémiát, az érelmeszesedést (azaz a metabolikus szindrómát vagy az X szindrómát) és a policisztás petefészekbetegséget (1) . Bár az elhízást meghatározó, megnövekedett zsírszövet-tömeg szisztémás inzulinrezisztenciát okozó mechanizmusainak számos részlete továbbra sem ismert, az elmúlt évek során robbanásszerűen megnőtt a megértésünk arról, amit ma adipo-inzulin tengelynek nevezhetünk. Megalapozott annak megfontolása is, hogy az inzulinrezisztencia és a hiperinsulinémia amellett, hogy az elhízás okozza, hozzájárulhat az elhízás kialakulásához. Ebben a perspektívában áttekintjük a közelmúltbeli előrelépéseket, kiemeljük a vita vagy a bizonytalanság területeit, és megközelítéseket javasolunk a megoldatlan kérdések tisztázására.
Inzulinhatás a zsírsejtben.
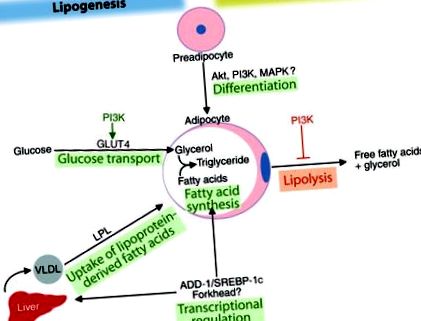
Az inzulin az adipocita-biológia gyakorlatilag minden aspektusának kritikus szabályozója, és az adipocyták az egyik legmagasabb inzulinra reagáló sejttípus. Az inzulin számos mechanizmus révén elősegíti az adipocita triglicerid raktározását, többek között elősegíti a preadipocyták adipocitákká történő differenciálódását, és érett adipocitákban stimulálja a glükóz transzportját és a triglicerid szintézist (lipogenezis), valamint gátolja a lipolízist (1. ábra). Az inzulin növeli a keringő lipoproteinekből származó zsírsavak felvételét is azáltal, hogy stimulálja a lipoprotein lipáz aktivitását a zsírszövetben. Az inzulin metabolikus hatásait széles szövetspecifikus hatások közvetítik, amelyek magukban foglalják a fehérje foszforilációjának és funkciójának gyors változását, valamint a génexpresszió változását. Az inzulin ezen hatásainak alapvető biológiai jelentőségét bizonyítja az a tény, hogy az ezeket az eseményeket elindító inzulin szignál kaszkád az evolúcióban nagyrészt konzerválódik a C. elegans-tól az emberig (2).
Az inzulin pleiotróp hatása a zsírraktározás elősegítésére. Az inzulin stimulálja a preadipociták differenciálódását adipocitákká. Az adipocitákban az inzulin elősegíti a lipogenezist azáltal, hogy stimulálja a glükóz és a lipoprotein eredetű zsírsavak felvételét, valamint az ADD-1/SREBP-1c indukálásával, amely szabályozza a zsírsavszintézist és a lipogenezist elősegítő géneket, nemcsak az adipocytákban, hanem a hepatocitákban is. Az inzulin a Forkhead transzkripciós faktorok révén is szabályozhatja a transzkripciót. Az inzulin a lipolízis gátlásával csökkenti a triglicerid lebomlását. Ezen metabolikus utak közül sokat a PI3K jelátviteli út szabályoz.
Inzulinrezisztencia elhízás és 2-es típusú cukorbetegség esetén.
Az „inzulinrezisztencia” kifejezés általában az inzulin glükózfelvételre, anyagcserére vagy tárolására gyakorolt hatásaival szembeni ellenállást jelenti. Az elhízás és a 2-es típusú cukorbetegség inzulinrezisztenciája az inzulin-stimulált glükóz transzport és anyagcsere csökkenésében nyilvánul meg az adipocytákban és a vázizmokban, valamint a máj glükóztermelésének elnyomott károsodásában (1). Ezek a funkcionális hibák részben abból adódhatnak, hogy mind a három célszövetben csökkent az inzulin jelátvitel, és az adipocitákban a fő inzulinra reagáló glükóz transzporter, a GLUT4 szabályozása is csökken. Az izomban és az adipocitákban egyaránt csökken az inzulin receptorához való kötődése, a receptor foszforilációja és a tirozin kináz aktivitása, valamint az IRS foszforilációja. Szövet-specifikus változások is vannak: A 2-es típusú cukorbetegségben szenvedő elhízott emberek adipocytáiban az IRS-1 expresszió csökken, ami az IRS-1-hez kapcsolódó PI3K aktivitás csökkenését eredményezi, és az IRS-2 válik a PI3K fő dokkoló fehérjéjévé (14) . Ezzel szemben az elhízott, 2-es típusú cukorbetegek vázizomzatában az IRS-1 és az IRS-2 fehérje szint normális, de a mindkét IRS-hez társuló PI3K aktivitás károsodott (15).
Az elhízás jelzésének egyik mechanizmusa lehet számos protein tirozin-foszfatáz (PTP) megnövekedett expressziója és aktivitása, amelyek defoszforilálják és így befejezik a tirozil-foszforilációs eseményeken keresztül terjedő jelátvitelt. Egyes adatok azt mutatják, hogy legalább három PTP, köztük a PTP1B, a leukocita antigénnel kapcsolatos foszfatáz (LAR) és az src-homológia-foszfatáz 2, expressziója és/vagy aktivitása fokozott az elhízott emberek és rágcsálók izom- és zsírszövetében (16) . Kimutatták, hogy a PTP1B és a LAR in vitro defoszforilálja az inzulinreceptort és az IRS-1-et (16, 17). Valójában azoknál az egereknél, amelyekben a PTP1B kiütésre került, fokozott az inzulinérzékenység és az étrend okozta elhízással szembeni rezisztencia (18, 19), legalábbis részben a megnövekedett energiafelhasználás miatt (19). Ez arra utal, hogy a PTP1B szabályozó szerepet játszik nemcsak az inzulin működésében, hanem az energia homeosztázisában is. Érdekes módon az inzulinérzékenység jelen van az izmokban és a májban, de az adipocitákban nem (18, 19). Kulcskérdés, hogy van-e okozati összefüggés az inzulinérzékenység és a soványság/energiafelhasználás között, vagy ezeket független jelátviteli utak szabályozzák?.
Más mechanizmusok is hozzájárulnak az elhízás inzulinrezisztenciájához. Morbid elhízás esetén a különféle inzulinszignál molekulák expressziója csökken a vázizomzatban (20). Az elhízás és a cukorbetegség minden formája esetében a GLUT4 visszaszorítása az adipociták inzulin-stimulált glükóz transzportjának fő tényezője. Elhízott és cukorbeteg emberek vázizomzatában azonban a GLUT4 expresszió normális (áttekintve a 21. hivatkozásban), és úgy tűnik, hogy a hibás glükóztranszport a GLUT4-et tartalmazó vezikulák károsodott transzlokációjának, dokkolásának vagy fúziójának köszönhető.
Bár az inzulinrezisztencia jellemző az elhízásra és a 2-es típusú cukorbetegségre, még nem állapították meg, hogy mindkét állapotban szenvedő egyéneknél az inzulin összes hatása károsodna-e. Lehetséges, hogy a máj lipogenezise és a lipidek tárolása a zsírszövet feleslegéhez vezet, míg a glükóz homeosztázissal kapcsolatos egyéb inzulinhatások károsodnak. Fontos lesz meghatározni azokat a jelátviteli útvonalakat és transzkripciós tényezőket, amelyek lehetővé tehetik az inzulin ilyen disszordáns működését.
Csökkent glükóz elhelyezés a zsírszövetben elhízás esetén
Az adipociták potenciális közvetlen szerepének további támogatása a szisztémás glükóz homeosztázis szabályozásában azokból a vizsgálatokból származik, amelyek során rágcsálókat vagy embereket CL316,243 β3 adrenerg agonistával kezelnek (25, 26). Mivel a β3 adrenerg receptorok szinte kizárólag zsírban expresszálódnak, várhatóan ezeknek a szereknek a hatása megváltozik a zsírban. A CL316,243-val végzett kezelés fokozott érzékenységet eredményez mind az egész test glükózfelvételében, mind a máj glükóztermelésének elnyomásában (25). Ezeket a hatásokat fokozott glükózfelvétel kíséri a zsírszövetben, anélkül, hogy hatással lenne több vizsgált izomcsoportra. Tehát a zsír szelektív glükózfelvételének növelése a β3 adrenerg receptor agonistákkal javíthatja az egész test glükózfelvételét, a zsírban kifejtett hatások pedig közvetett módon megnövekedett máj inzulinérzékenységet eredményeznek. Alternatív megoldásként a β3 agonisták úgy működhetnek, hogy megváltoztatják bizonyos adipocita termékek felszabadulását, amelyek befolyásolják a szisztémás inzulinérzékenységet.
A testzsír elhelyezkedésének jelentősége az inzulinrezisztencia szempontjából.
Az elhízás és az inzulinrezisztencia kapcsolata minden etnikai csoportban megmutatkozik, és a test teljes súlytartományában nyilvánvaló. Nagy epidemiológiai vizsgálatok azt mutatják, hogy a cukorbetegség és feltehetően az inzulinrezisztencia kockázata növekszik, amikor a testzsírtartalom (a testtömeg-index [BMI] alapján mérve) a nagyon soványtól az elhízottig növekszik, ami azt jelenti, hogy a testzsír „dózisa” hatás az inzulinérzékenységre széles tartományban (27). Bár ezt az összefüggést az adipozitás olyan mértékeivel látják, mint a BMI, amelyek tükrözik az általános zsírosságot, kritikus fontosságú felismerni, hogy az összes adipozitás helyszíne ebben a tekintetben nem egyenlő. A központi (intraabdominális) zsírraktárak sokkal szorosabban kapcsolódnak az inzulinrezisztenciához, a 2-es típusú cukorbetegséghez és a szív- és érrendszeri betegségekhez, mint a perifériás (gluteális/szubkután) zsírraktárak (28). Ezt a tényt a zsír- és inzulinérzékenységről nem magyarázták megfelelően. Lehetséges, hogy egy ismeretlen, genetikai vagy környezeti tényező egyaránt előidézi az inzulinrezisztenciát és a regionális adipozitás központi mintázatát, és hogy a központi elhízás valójában nem okoz inzulinrezisztenciát. Alternatív megoldásként az intraabdominális adipocyták bizonyos biokémiai jellemzői közvetlenül befolyásolhatják a szisztémás inzulinérzékenységet.
Vezető hipotézis e tekintetben az, hogy az intraabdominális adipocyták lipolitikusabban aktívak, részben az adrenerg receptorok komplementere miatt. Ez növelné az intraportális FFA-szintet és a fluxust, ami még bizonytalan mechanizmusokkal gátolhatja az inzulin clearance-ét és elősegítheti az inzulinrezisztenciát. A hiperinsulinémia önmagában inzulinrezisztenciát okozhat az inzulinreceptorok szabályozásának csökkentésével és a postreceptor útvonalainak deszenzitizálásával, amit az inzulin túlzott expressziója igazolt egyébként normális transzgenikus egerek májában. Ez a transzgén az inzulinreceptor expressziójának, az életkorral összefüggő csökkenését, a glükóz-intoleranciát és a hiperlipidémiát eredményezte az inzulin működésének vagy szekréciójának elsődleges genetikai hibája nélkül (áttekintve a 29. hivatkozásban). Alternatív hipotézis az, hogy mivel az adipocitákról ma már ismert, hogy számos olyan tényezőt választanak ki, amelyek képesek szisztémás hatások kifejtésére (lásd alább), az intraabdominális adipociták által kiválasztott tényezők tömbje különösen káros lehet a szisztémás inzulinérzékenységre. Eddig ez a hipotézis nem bizonyított.
Az adipociták mint endokrin sejtek.
Az adipociták jól ismertek a trigliceridek energiatároló raktáraként játszott alapvető szerepükről, amelyekből szükség esetén energiát hívnak elő FFA-k és glicerin formájában. Az elmúlt évek során felmerülő adatok azonban további szerepet játszottak az adipocitában, a szekréciós sejtben (2. ábra). Az adipociták számos peptidhormont és citokint expresszálnak és szekretálnak, beleértve a TNF-a-t is; plazminogén-aktivátor inhibitor-1, amely segíti a hemosztázis fenntartását; angiotenzinogén, amelynek proteolitikus terméke szabályozza az érrendszeri tónust; és a leptin, amely központi szerepet játszik az energiaegyensúly szabályozásában. A zsírszövet aktív szteroidhormonokat is képes előállítani, beleértve az ösztrogént és a kortizolt (30, 31). Az ilyen szekretált termékek révén az adipociták képesek befolyásolni a helyi adipocita biológiát, valamint a szisztémás anyagcserét olyan változatos helyeken, mint az agy, a máj, az izom, a β sejtek, az ivarmirigyek, a limfoid szervek és a szisztémás érrendszer. Ez a felismerés számos lehetőséget kínál a zsírfunkció vagy a tömeg és az inzulinrezisztencia közötti további kapcsolatokra, függetlenül az adipocita szerepétől az energia tárolásában és felszabadításában (ábra (1. ábra).
Fejlődő nézet az adipocita biológiai funkcióiról. Korábban az adipocitákat inert tároló raktáraknak tekintették, amelyek éhezés vagy éhezés idején zsírsavként és glicerolként szabadították fel az üzemanyagot. Újabban világossá vált, hogy az adipociták olyan endokrin mirigyek, amelyek fontos hormonokat, citokineket, vazoaktív anyagokat és más peptideket választanak ki. ANS, autonóm idegrendszer.
Nagy érdeklődés kísérte azt a felfedezést, miszerint az adipociták expresszálják és szekretálják a citokin TNF-α-t, és hogy az elhízott állatoktól és emberektől származó megnagyobbodott adipociták túlzottan expresszálják ezt a faktort (32). Noha nem minden vizsgálatban találták a TNF-α szintjét az elhízásban, ennek a faktornak a normális keringési szintje a kimutatási határon van, ami bizonytalanná teszi a kvantitatív elemzést. Ez az alacsony expresszió azt jelezheti, hogy a TNF-a parakrin, nem pedig endokrin módon hat. Ezért alternatív megközelítésekre van szükség a TNF-α szisztémás inzulinrezisztenciában betöltött szerepének értékeléséhez, és néhány, de nem minden olyan vizsgálatban, amely semlegesítő antitesteket vagy más szereket használt a TNF-α működésének állati modellekben történő blokkolására, úgy tűnik, hogy az ilyen blokád fokozza az inzulinérzékenységet ( 33).
A TNF-α sok hatással van az adipocita működésére, és ezek magukban foglalják a lipogenezis gátlását és a lipolízis fokozását. Ezeket a cselekvéseket egyesek visszacsatolási hurokként tekintették a túlzott energiatárolással szemben. A túlzott TNF-α okozhat-e inzulinrezisztenciát? A TNF-α jelátvitel rontja az inzulin jelátvitelt, részben az IRS-1 szerin-foszforilációja révén (32, 33), és csökkentheti a GLUT4 génexpressziót, így megalapozott sejtalapot hoztak létre a TNF-α-nak, mint az inzulinrezisztencia közvetítőjének. További támaszt jelent a TNFα vagy TNFα receptor gének kiiktatásának az inzulinrezisztenciára gyakorolt jótékony hatása az elhízással összefüggő inzulinrezisztencia számos állatmodelljében (32, 33). Az inzulinrezisztencia javulása a TNF-szignálozás elvesztésére adott válaszként azonban legfeljebb részleges, és a TNF-semlegesítés hatása nem minden kísérleti modellben volt látható. Így a TNF-α részben hozzájárulhat az inzulinrezisztenciához, de más tényezőknek is létezniük kell.
Ilyen tényező lehet a leptin, az ob gén terméke. Ez az adipocita eredetű hormon pleiotrop hatásokat fejt ki, beleértve a jóllakottságra, az energiafelhasználásra és a neuroendokrin működésre gyakorolt mély hatásokat (34). A leptin evolúciós szempontból a legmeggyőzőbb szerepe az a képessége, hogy kétirányú jelként szolgáljon, amely az anyagcsere-fiziológiát és a neuroendokrin státuszt váltja a táplált és éhezett állapotnak megfelelő programok között. Az elhízás megelőzésére szolgáló erős (adiposztatikus) jelként a leptin emelkedésének javasolt szerepét a leptin-rezisztencia könnyen felforgatja. Mivel a megnövekedett energiatárolók előnyben részesítenék az éhínség időszakában a túlélést, a leptin hatásának adiposztatikus aspektusát az evolúció során megválaszthatták (35). Ez a nézet, miszerint a leptin elsősorban az éhezési/táplálkozási kapcsolóban vesz részt, nem tagadja azt a tényt, hogy a leptin hiánya rágcsálókban és emberekben egyaránt súlyos elhízást eredményez, amelyre egyértelműen a leptin a gyógymód. Az sem csökkenti a leptinrezisztencia molekuláris alapjának meghatározásának fontosságát, amely korlátozza a növekvő leptin képességét az elhízás megelőzésére a legtöbb helyzetben.
A leptin autokrin, parakrin, endokrin és idegi áramkörök útján többféle intézkedést hajt végre a glükóz homeosztázis szabályozásában. Míg a leptin számos hatását a központi idegrendszer közvetíti, egyes hatások közvetlenül az inzulin célszövetek vagy a hasnyálmirigy szigetsejtjeinek szintjén jelentkezhetnek.
A rágcsálóktól eltérően a leptin- vagy leptinreceptor-mutációval és elhízással küzdő néhány embernél nem tűnik rendkívüli mértékű inzulinrezisztencia, amit a hiperinsulinémia értékel, és egyiket sem írták le még cukorbetegséggel (46, 47). Ez a különbség összefüggésbe hozható azzal a ténnyel, hogy az egerekkel ellentétben az embereknél a leptin csekély hatást gyakorol a HPA tengelyre. Ha a leptin bebizonyosodik, hogy fontos hatást gyakorol az emberek inzulinérzékenységére, mint az egereknél, akkor fontos lesz meghatározni, hogy a csökkent leptinhatás vagy a leptinrezisztencia milyen mértékben járul hozzá az emberek elhízás inzulinrezisztenciájához.
Lipotoxicitás és lipoatrophia: ugyanazon érme két oldala?
Két további módja van annak, hogy a zsírszövet funkciójának megváltozása befolyásolhatja a glükóz homeosztázist. Az egyik esetben az elhízásban megnövekedett zsírenergia-tárolás megnövekedett FFA-fluxust eredményez más szövetekben és fokozott triglicerid-tárolást eredményez ezekben a szövetekben, ami elősegíti az inzulinrezisztenciát és más káros hatásokat, amelyeket egyesek „lipotoxicitásnak” neveznek. A másikban paradox módon a zsírszövet hiánya sokféle eredményt szül. Hogyan magyarázzuk ezt a paradoxont?
Amikor a zsírraktár kibővül, mint az elhízásban, a plazma FFA-k megemelkednek, valószínűleg a kibővített zsírtömegből származó fokozott felszabadulás és valószínűleg a máj metabolizmusának károsodása miatt. Az emelkedett FFA-k rontják az inzulin képességét a máj glükóztermelésének elnyomására és a vázizomzatba történő glükózfelvétel stimulálására, valamint gátolják a hasnyálmirigy β sejtjeiből származó inzulin szekréciót. Az izomhiba a PI3K aktiválásának károsodását vonhatja maga után, valószínűleg a PKCθ emelkedése miatt (48). Az izomban a PI3K-aktiváció elvesztése szintén a magas zsírtartalmú étrend eredményeként jelentkezik (49). Emberben az izom trigliceridtartalma közvetlenül korrelál az inzulinrezisztenciával, az izom-foszfolipidek zsírsav-összetétele pedig befolyásolja az inzulin-érzékenységet (50). Sokkal többet kell megtudnunk azokról a mechanizmusokról, amelyek a lipid felhalmozódást vezérlik a nem adipózos szövetekben, és azokról a mechanizmusokról, amelyek révén az ilyen lipotoxikus funkcióromlás bekövetkezik. A β sejtekben végzett legújabb vizsgálatok arra utalnak, hogy a hosszú láncú zsírsavak káros hatásokat fejthetnek ki a ceramid túltermelésének indukálásával (51). Fontos lesz meghatározni, hogy a zsírsavak megváltoztatják-e a génexpressziót azáltal, hogy ligandumként kötődnek a peroxiszóma proliferátor-aktivált receptor (PPAR) család transzkripciós faktoraihoz.
Tiazoladinedionok és PPARγ betekintése.
A cukorbetegség egyik fő terápiás előrelépése a tiazoladinedionok (TZD) elérhetősége, a gyógyszerek olyan csoportja, amelyek legalább részben az inzulinérzékenység javításával javítják a hiperglikémiát (Olefsky, ez a Perspektíva sorozat, ref. 56). Hatásmechanizmusuk megértésében áttörést eredményezett az a felismerés, hogy ezeknek a gyógyszereknek a receptora a nukleáris transzkripciós faktor PPARy, amelyet korábban az adipogenezis kulcsfontosságú transzkripciós faktoraként azonosítottak. A PPARy-t TZD-k aktiválják, amelyek kötődnek a ligandumkötő doménhez és fokozzák a célgének transzaktiválódását. A PPARγ legnagyobb mértékű expressziója az adipocitákban történik, bár lényeges expresszió látható néhány más szövetben, például immunsejtekben és érrendszeri sejtekben, és ismeretlen jelentőségű alacsonyabb szintű expresszió figyelhető meg olyan szövetekben, mint az izom és a máj. Az a tény, hogy a TZD-k a PPARγ-n keresztül hatnak, és hogy a PPARγ túlnyomórészt zsírban expresszálódik, hatalmas új kapcsolat az adipocita és az inzulinrezisztencia között. Mi is pontosan a link?
Következtetések és következmények
Valószínűleg a zsírszövet, az inzulinhatás és a glükóz homeosztázis kapcsolatának összetett hangszerelése a túlélési igényből alakult ki az üzemanyag-ellátás fenntartása érdekében, amikor az élelmiszer kevés volt. Most, amikor a nyugati társadalomban rengeteg idő van, az elhízás és a vele járó betegségek elérték a járvány mértékét, és az új terápiás megközelítések azonosításához szükséges tudományos fejlődés szükségessége nem lehet élesebb. Az a kihívás, hogy az egyre növekvő adipocita funkciókat alkalmazzuk az energiafogyasztás és a felhasználás egyenletének csökkentésére a csökkentett zsírraktározás felé, nagy lehetőségeket kínál az emberi betegség lefolyásának megváltoztatására.
Köszönetnyilvánítás
Ezt a munkát az NIH támogatásai (RO1 DK-43051, RO1 DK-28082 és PO1 DK-56116), valamint Eli Lilly and Co. támogatása támogatta. A szerzők számos további hozzájárulást ismernek el a területen, amelyeket nem tudtak megemlíteni a hivatkozások számának korlátozása miatt. A szerzők köszönetet mondanak Young-Bum Kim-nek a szakértői segítségért.
- Elhízottság; Inzulinrezisztencia - Hogyan kapcsolódnak az OMAMain
- Az anyai inzulinrezisztencia megváltoztatja a hasnyálmirigy fejlődését, növeli az anyagcserezavarok kockázatát
- A niacin javítja a mikrobiom és az inzulinrezisztenciát; GT Egészség, Endokrinológia
- Az ER stressz és gyulladás mechanizmusa a máj inzulinrezisztenciájához az elhízásban - FullText -
- Osteopontin szükséges a magas zsírtartalmú étrend okozta inzulinrezisztencia korai megjelenéséhez egerekben