Kombinált genealógiai, feltérképezési és expressziós megközelítések a spontán hipertenzív patkány hipertónia jelölt gének azonosításához
A Molekuláris Orvostudományi Intézetből (C.A.H., E.B., M.F., P.A.D.) és az Emberi Genetikai Központból (E.B.), a Texasi Egyetem Egészségtudományi Központjából, Houston.
A Molekuláris Orvostudományi Intézetből (C.A.H., E.B., M.F., P.A.D.) és az Emberi Genetikai Központból (E.B.), a Texasi Egyetem Egészségtudományi Központjából, Houston.
A Molekuláris Orvostudományi Intézetből (C.A.H., E.B., M.F., P.A.D.) és az Emberi Genetikai Központból (E.B.), a Texasi Egyetem Egészségtudományi Központjából, Houston.
A Molekuláris Orvostudományi Intézetből (C.A.H., E.B., M.F., P.A.D.) és Humángenetikai Központból (E.B.), a Texasi Egyetem Egészségtudományi Központjából, Houston.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
A génexpresszió örökletes variációja egy olyan kulcsfontosságú evolúciós erő, amely által a fajok eltérnek egymástól. 1–4 A fajokon belül széleskörű bizonyíték van arra is, hogy öröklődő allél hatások vannak a génexpresszióra. 5,6 Valójában az ismert kódoló szekvencia és a szabályozó szekvencia polimorfizmusainak frekvenciáinak extrapolálása a teljes emberi genomban arra utal, hogy a szabályozó polimorfizmusok jobban hozzájárulnak az egyének közötti variációhoz, mint a kódoló szekvencia polimorfizmusok. 3 A mendeli tulajdonságok létrehozása mellett az ilyen öröklődő génszabályozó hatások jelentősen hozzájárulhatnak a poligénes betegség fenotípusainak, köztük a magas vérnyomás kialakulásához. Például az angiotenzinogén gént humán hipertóniában érintő bizonyítékok hangsúlyozzák a gén haplotípusainak szerepét, beleértve a funkcionális polimorfizmusokat a gén promoter régiójában, amelyekről kimutatták, hogy befolyásolják az angiotenzinogén gén transzkripcióját és társulnak a plazma angiotenzinogén szintjével. 7,8
A poligénes betegségre való hajlam örökletes alapjának megoldása szempontjából a pozicionális (kapcsolati leképezés) és az asszociációs megközelítések jelentős akadályokkal szembesülnek a lokuszok és a génvariánsok azonosításában, amelyekről következetesen kimutatták, hogy összefüggésben vannak a betegség fogékonyságával. 9,10 Az évtizedes erőfeszítések ellenére az esszenciális hipertóniára való fogékonyság genetikai alapjának feloldása az egyes gének szintjén korlátozott, és a megállapítások gyakran következetlenek. Ugyanezek a körülmények jellemzik az örökletes hipertónia állatmodelljeinek vizsgálatát, annak ellenére, hogy kedvezőbb vizsgálati lehetőségeket kínálnak, mint a kinőtt emberi populációk, például csökkent genetikai heterogenitás, ellenőrzött tenyésztés és nagyobb lehetőség az intervenciós vizsgálatokra. Tekintettel az öröklődő gének expressziójára gyakorolt hatásoknak a fajon belüli fenotípusok létrehozásában és az átfogó génexpresszió-értékelési eszközök rendelkezésre állására, az expressziós genetika eléggé érlelődött ahhoz, hogy konstruktív módon kombinálódjon a pozicionális genetikával, hogy hozzájáruljon az örökletes hipertónia allélbázisának feloldásához.
Mód
Állatok és mérések
A vizsgálatokat 4-, 8-, 12- és 18 hetes hím állatokon végezték. A Heidelberg alvezetékek WKY és SHR-A3 patkányait használtuk, amelyeket 8 éve tartanak fenn létesítményünkben. Az SHR-B2 és SHR-C készleteket 2002-ben T. Suzuki professzor (Kinki Egyetem Orvostudományi Kar, Kinki, Japán) bőkezűen szállította laboratóriumunkba, és az Okamoto által közölt eredeti alszármazékoktól származnak. 11 A vizsgálatokban felhasznált összes állatot tenyésztési programunkban állítottuk elő, és ellenőrzött körülmények között, a Laboratóriumi Állattenyésztés Értékeléséért és Akkreditálásáért Egyesület által jóváhagyott állattartó létesítményben tartottuk. Az állatoknak szokásos rágcsáló-chow-étrendet és ivóvizet ad libitum biztosítottak.
A szövetgyűjtéshez az állatokat izoflurán inhalációval altattuk, és a veséket gyorsan hasítottuk hasi laparotómiával. A vese gén expresszió elemzését axiális vese szegmensekből származó teljes RNS készítmények alkalmazásával végeztük, beleértve a kéreget és a medullát is. A húgycső medencéjét és a vese sinus fő érrendszerét eltávolítottuk a mintából. Mindegyik törzsből három vagy négy állatot használtunk minden időpontban, hogy statisztikailag elemezhessük az összes génexpressziós mérést. Minden állat mindegyik mintáját független mintaként kezeltük, és az egyesítést nem végeztük.
Átirat profilalkotás
A transzkriptum bőségét úgy határoztuk meg, ahogyan azt korábban 14 beszámoltuk, az Affymetrix patkány RG-U34A tömbjével, amely 5288 patkány génhez és 3452 patkány expresszált szekvencia címkéhez (EST) tartozó szondákat tartalmaz, a gyártó által ajánlott protokollok szerint. Ennek a tömbnek a legtöbb génjét 16 egyedi 25-mer oligonukleotidot tartalmazó próbakészletek kérdezik le. A nemspecifikus fluoreszcencia kiigazítását próbakészletenként 16 további oligonukleotid hibridizációs adatainak felhasználásával végezzük, amelyek azonosak, kivéve az oligonukleotid közepén lévő egyetlen bázist tartalmazó maradékot. Az expressziós szinteket átlag ± SEM értékként jelentjük. Egy névleges P A 0,05 értéket statisztikailag szignifikánsnak tekintettük a törzsek közötti összehasonlítás céljából (Mann – Whitney-teszt). Ezt az adatsort letétbe helyezték az NCBI Gene Expression Omnibus (GEO adatbázis) sorozatszámú GSE2104 (megjelenési dátum: 2005. április 1.).
Eredmények
A génexpresszió időbeli és törzsek közötti általános változásainak értékeléséhez regresszióanalízist végeztünk az adatsorok közötti összefüggések vizsgálatára. Az 1. táblázat a regressziók R-négyzet értékeit mutatja be, amelyek az egyes törzseket vizsgálják az adott időpontban. A kezdeti 3 idõpont alatt a WKY és az SHR-A3 teljes génexpressziója szorosabban kapcsolódik, mint a WKY-ben az SHR-B2 vagy SHR-C alvezetékekhez való expresszió. 18 hetes korban azonban drámai módon csökken a vese gén expressziójának kapcsolata SHR-A3 és WKY-ban, így az SHR-B2 és SHR-C expressziós mintázatai ebben a pillanatban jobban hasonlítanak a WKY-hez. Érdekes módon 18 hetes korban is jelentős csökkenés mutatkozik az SHR-A3 és SHR-B2, valamint az SHR-A3 és az SHR-C génexpressziója között. Az R négyzetértékek az idő múlásával szoros összefüggést mutatnak a vesegén expressziója között az SHR-B2 és SHR-C törzsekben.
1. TÁBLÁZAT: A génexpresszió regresszióanalízise az egyes gének és EST-k összefüggéseinek összehasonlítása a patkánytörzsek között a vizsgált 4 életkor mindegyikében
A 2. táblázat további betekintést nyújt a génexpressziós mintázat törzseken belüli kapcsolatába. Ismét a figyelemre méltó jellemző az, hogy az SHR-A3 gén expressziója a 18. héten lényegesen eltér a más időpontokban az SHR-A3 gén expressziójától. Ezzel szemben szinte nincs változás a 18 hetes génexpresszió és az SHR-B2 és SHR-C más időpontokban történő expressziója között. Az 1. és 2. táblázat együttesen azt sugallja, hogy a SHR-A3 gén expressziójában a 18. héten bekövetkezett jelentős változások következtek be, amelyek megkülönböztetik ezt a törzset mind a többi SHR alvonaltól, mind a WKY-tól.
2. TÁBLÁZAT A gének expressziójának regresszióanalízise az egyes gének és az EST expressziójának összefüggéseinek összehasonlítása az idő folyamán patkány törzseken belül
A 3. táblázat a tömbben ábrázolt egyedi géneket és EST-ket tünteti fel, amelyek állandó különbségeket mutatnak az idő múlásával, amikor az összes SHR alvonatot szembeállítják a WKY állatokkal. Ennek a tanulmánynak az a legfőbb indoka, hogy az SHR-alvezetékek közötti genealógiai kapcsolatok tulajdonképpen több olyan kongénikus alvonatot hoznak létre, amelyekben a hipertóniát megengedő és kauzális allélek megoszlanak az alvezetékek között, és amelyek a közös őseikből eredő és a hipertóniához nem kapcsolódó genomikus variációk között vannak. Így a hipertónia genezisében részt vevő gének, amelyek a génexpresszió öröklődő változásain keresztül hatnak, azonosíthatók azok között, amelyeknél a WKY és az összes SHR szubsztrán expressziója következetesen különbözik.
3. TÁBLÁZAT A gének és az EST-k következetesen különböznek az SHR törzsektől a WKY-vel összehasonlítva
Mivel hipotézisünk lehetővé teszi azt is, hogy egyes, a magas vérnyomáshoz nem kapcsolódó háttérgének is megoszthatók legyenek a magas vérnyomás alatt álló alcsoportok között, arra törekedtünk, hogy finomítsuk a differenciálisan expresszált gének listáját azáltal, hogy azonosítjuk közöttük azokat, amelyek kromoszóma régiókban helyezkednek el, és amelyeket a BP kvantitatív meghatározására törekvő vizsgálatok vonnak maguk után. vonás lokuszok (QTL) az SHR-ben. 14 gént és EST-t azonosítottunk, amelyek 8 kromoszómát és 11 SHR BP QTL-t képviselnek. Az 1. ábra mutatja ezeket a géneket és EST-ket tartalmazó kromoszómákat és azok kromoszómákon való elhelyezkedését. Ezeknek a géneknek és EST-knek az átlagos expressziós szintje az SHR alvezetékeken 5,4-szeres és 3,9-szerese a WKY-tól. 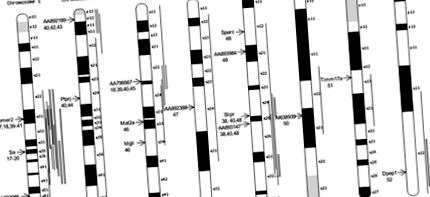
1.ábra. Következetesen differenciáltan expresszált gének és EST-k, amelyek az SHR BP QTL-ekhez kapcsolódnak. A gén vagy az EST kromoszóma helyzetét egy nyíl jelzi a kromoszóma bal oldalán; a gént vagy az EST-t e nyíl mellett jelölik, az SHR BP-gének e kromoszómában/régióban történő lokalizálását jelző hivatkozásokat a gén/EST-azonosítás alatt mutatjuk be. A vékony függőleges vonalak a BP QTL-ek mértékét jelentik a szabadon elkülönülő keresztezéseknél. A széles, árnyékolt vonalak kongenikus szegmenseket ábrázolnak, amelyek 27, 28, 33–38, amelyek SHR-ben vagy az SHR-ben izolálva vannak, és kimutatták, hogy befolyásolják a BP-t.
Vita
2. ábra. A jelen vizsgálatban használt SHR alszármazékok genealógiai összefüggései (módosítva: Okamoto és mtsai. 11).
A génexpressziós minták közötti összefüggés elemzése a törzseken belüli és törzsek közötti idõbeli különbségek között idõben erõs bizonyítékot szolgáltat a génexpresszióra gyakorolt öröklõdõ hatásról (1. és 2. táblázat). A genealógia alapján a várhatóan a legszorosabb genetikai kapcsolattal rendelkező törzsek, az SHR-B2 és az SHR-C, feltűnően szoros kapcsolatot mutatnak a génexpressziós mintázataikban. A közzétett genealógiai feljegyzések nem teszik lehetővé annak az utolsó generációnak a pontos meghatározását, amelyben az SHR-A3 közös szülőket osztott meg az SHR-B2-vel és az SHR-C-vel. 11 A 2. ábrán összefoglalt genealógiai információk azonban azt jelzik, hogy ez valamikor bekövetkezett az F1 és F8 generációk között, amikor a beltenyésztési együtthatók gyorsan emelkednek a kezdeti szintről. Mivel az SHR-B2-nek és az SHR-C-nek közös ősei vannak a beltenyésztés F11 és F14 generációiban, szorosabban kapcsolódnak egymáshoz, és ez a szoros genetikai kapcsolat az a valószínű erő, amely meghatározza ezekben a törzsekben a génexpressziós mintázatok nagy hasonlóságát (1. táblázat ). A gének expressziójában a WKY és a 3 SHR alvezeték közötti kapcsolat összessége meglehetősen hasonló, de jelentős csökkenés jellemzi a 18. héten. Ez a legnagyobb az SHR-A3 esetében, és tükrözi ennek a törzsnek a fokozott érzékenységét a magas vérnyomású végszervi sérülésekre.
Az Sa gént eredetileg a vesében nagyon differenciálisan expresszálódó génként azonosították. Elemzésünk szerint ez a különbség fennáll a vizsgált 3 SHR alvezeték között. Ezt a gént alaposan tanulmányozták differenciális expressziója, jól megalapozott SHR BP QTL-ben elfoglalt helyzete, az SA-lokusz SHR és WKY közötti polimorfizmusának 17–21 bizonyítéka, 22,23, valamint a BP-ben való részvételre utaló humán vizsgálatok bizonyítékai miatt meghatározás. 24–26 A legújabb patkánykongenikus vizsgálatok nem találtak támogatást az Sa részvételének a BP szabályozásában. 27,28 Hasonlóképpen, az Sa-gén és a BP funkcionális kapcsolatának egér-kiütéses modell alkalmazásával történő vizsgálatára irányuló erőfeszítések nem voltak eredményesek, 29 bár a géneltávolítás nem a robusztus analógia az SHR-ben megnövekedett allélos Sa-gén expresszióval.
Az itt közölt vizsgálatok egy további, folyamatban lévő szakasza magában foglalja a differenciálisan expresszált gének közötti szekvenciaváltozás jellemzését. Az Ephx2 fent leírt jellemzése mellett a 3. táblázatban meghatározott 4 gén polimorfizmus-elemzését és a szülői törzs genotipizálását befejeztük. Mindegyik esetben 1 és 4 egynukleotidos polimorfizmust azonosítottunk a kódoló, proximal 5 ′ Szabályozó, vagy melletti intronikus szekvencia (az adatokat nem mutatjuk be). Mindegyik esetben az összes tesztelt SHR altípus azonos genotípussal rendelkezik, de különbözik a WKY-től. Ugyanezt a genotípust azonosították a kereskedelmi SHR/N Criv alrészben is. Ez a következetes mintázat a genotípusban: ezen expressziós jelölt gének fenotípus viszonya megerősíti az indoklást, hogy tovább vizsgáljuk a differenciális gén expressziójának allél alapját az SHR-ben és ezen allélek hipertóniában való részvételét.
Folyamatban vannak e gének allélszerkezetének elemzésére irányuló erőfeszítések, és eszközöket biztosítanak ennek a megközelítésnek a következő szintre jutásához: annak értékelése, hogy a kódoló szekvencia variációja bekövetkezik-e a szabályozási variációval összefüggésben, a gén variáció funkcióra gyakorolt hatásainak értékelése, megerősítés az SHR × WKY kereszt F2 utódainak gén expressziós különbségeinek allél jellege és az F2 utódokban az allél variáció és a BP összefüggésének értékelése.
Perspektíva
- A jelenlegi táplálkozási megközelítések az autizmus spektrumzavar kezelésében A táplálkozási áttekintés
- Daganatos betegeknél a tumor nekrózis faktor expressziójának lefelé történő szabályozása pentoxifillinnel A kísérlet
- Ünnepeljük anyukáink fogyás eredményeit, akik együttesen több mint 130 kg-ot fogyottak
- Az RNS kölcsönhatásainak kémiai eltolódás feltérképezése a polipirimidin traktushoz kötődő fehérjével
- Az RNS kölcsönhatásainak kémiai eltolódási térképezése a polipirimidin traktusba kötődő Nukleic fehérjével