Korai posztnatális alacsony fehérjetartalmú táplálkozás, anyagcsere-programozás és az autonóm idegrendszer a felnőtt életben
Absztrakt
A laktáció alatti fehérje korlátozást a metabolikus programozás patkánymodelljeként alkalmazták a perinatális alultápláltság felnőttkori anyagcserére gyakorolt hatásának tanulmányozására. A magzati élet során a fehérje korlátozással ellentétben a fehérje korlátozása a laktáció alatt úgy tűnt, hogy nem okoz elhízást vagy a metabolikus szindróma, például a hiperinsulinémia jellemzőit, amikor az egyének felnőtté váltak. A fehérje korlátozása azonban provokálja a test alsúlyát és hipoinsulinémiáját. Ez az áttekintés az inzulin szekréciójának szabályozására és az autonóm idegrendszer (ANS) hatására összpontosít olyan felnőtt patkányokban, amelyek fehérje-alultápláltságot szenvedtek a laktáció alatt. A témában rendelkezésre álló adatok arra utalnak, hogy a laktáció perinatális fázisa, ha fehérjehiány sérti, lenyomja a felnőttek anyagcseréjét, és ezáltal megváltoztatja a glikémiás kontrollt. Bár a hipoinsulinemia felnőtt patkányokat programoz a normoglikémia fenntartására, a hasnyálmirigy β-sejtjei kevésbé érzékenyek a szekréciós ingerekre, például a glükózra és a kolinerg szerekre. Ezek a hasnyálmirigy-diszfunkciók az ANS-aktivitás egyensúlyhiányának tulajdoníthatók olyan felnőtt patkányokban, akik anyai fehérje-korlátozást tapasztaltak.
Bevezetés
Az egészség és a betegség (DOHaD) hipotézisének fejlődési eredete, amely előírja, hogy a felnőttkori anyagcsere-betegség programozható a perinatális stádiumban, számos kísérleti állatmodellben tesztelték. Számos bizonyíték azt sugallja, hogy az elhízás etiológiája nemcsak az ételbőséggel, hanem a korai életkorban bekövetkezett táplálékkorlátozással is összefügg [1–5]. Számos adat bizonyítja, hogy a magzat tápanyaghiánya növeli a metabolikus betegség kialakulásának kockázatát a felnőtt életben [6, 7]. A szoptatás a méh életéhez hasonlóan az agy fejlődésének nagyon fontos fázisa, különösen a rágcsálófajokban, és ezáltal egy másik érzékeny ablakot alkot, amely során a táplálkozási sértések felnőttkori anyagcserebetegségek programozásához vezethetnek [8, 9]. Valójában a szoptatás alatti túlzott táplálkozás elhízást és hiperinsulinémiát vált ki a metabolikus szindróma egyéb jellemzői között, míg táplálkozás alatt tartósan csökken a testtömeg és metabolikus változásokat okoz. Mivel az inzulin kulcsfontosságú szerepet játszik az anyagcsere-betegség kialakulásában, ezt a felülvizsgálatot az alultápláltságnak a laktáció alatt bekövetkező, az inzulin szekréció szabályozására gyakorolt hatásainak szentelik az autonóm idegrendszer feltételezett módosításai révén.
Autonóm idegrendszer és anyagcsere
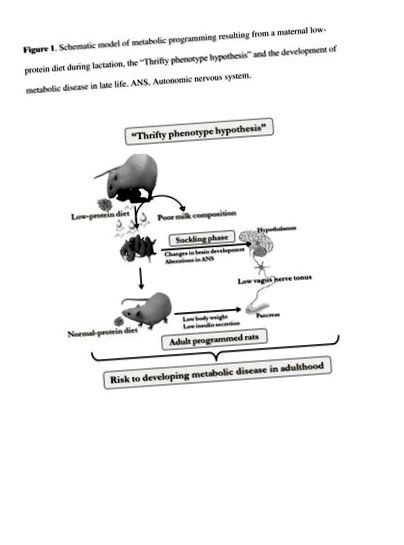
Nagy figyelmet fordítottak az inzulinra a szekrécióval szemben, amely az elhízásban figyelhető meg. Az ANS-aktivitás egyensúlyhiányát javasolták többek között ennek a hasnyálmirigy-β-sejtek működési zavarának. Elhízott embereknél és rágcsálóknál magas vagus idegaktivitást figyeltek meg, míg csökkent szimpatikus tónusról számoltak be [20–23]. Azonban, bár kevesebb figyelmet fordítottak a test alsósúlyának kialakulásának patofiziológiájára, számos tanulmány arról számolt be, hogy az alultáplált vagy alultáplált organizmusokban megváltozik az ANS-aktivitás [24, 25]. Az elválasztás után a krónikus fehérjehiányos táplálékkal táplált patkányok alacsony vagus ideg aktivitást mutattak, míg magas szimpatikus aktivitást regisztráltak, és ezek az adatok összhangban voltak a glükóz alacsony inzulin válaszával [25]. Egy másik vizsgálatban a fehérje-korlátozott patkányokból izolált hasnyálmirigy-szigetek gyenge glükóz- és kolinerg inzulintrópikus válaszokat mutattak [24], ami arra utal, hogy a hasnyálmirigy-β-sejtek diszfunkciója az alacsony súllyal rendelkező állatok megváltozott ANS-aktivitásának tulajdonítható, amint azt az 1. sematikus ábra mutatja.
Anyagcsere programozási sematikus modell, amely az anya alacsony fehérjetartalmú étrendjéből származik a laktáció alatt, a „Thrifty fenotípus hipotézis” és a metabolikus betegség kialakulása a késői életben. ANS, autonóm idegrendszer.
Az ételbőség vagy a testtömeg-szabályozás korlátozása magában foglalja a metabolikus homeosztázis és az ANS-egyensúly aktivitásának változását. Noha a hasnyálmirigy-β-sejtek által az inzulin szekréciója fokozott a túlsúlyos embereknél, az alacsony súlyúaknál csökken. Az ANS-aktivitás változásai képezhetik a β-sejtek diszfunkciójának hátterében álló mechanizmusokat: az elhízott egyéneknél megfigyelt magas PNS-tónus folyamatosan fokozza az inzulin szekrécióját, míg az alacsony testsúlyú személyeknél jelentett alacsony aktivitás gyenge kolinerg inzulin tropikus hatással jár [26].
Az egyre növekvő világméretű elhízási járvány - beleértve a fejlődő országok, például Kína, India, Mexikó és Brazília - hatalmas népességét is, egyre inkább tanulmányozzák ennek az egészségügyi és gazdasági katasztrófának az okait [27–30]. Köztudott, hogy a metabolikus szindróma és az elhízás magas összefüggést mutat az alacsony vagy hiányzó fizikai gyakorlatokkal és a kalóriadús étrend fogyasztásával a fejlődő országokban; bár a lakosok valóban táplálkozási átmenetet tapasztalhatnak, a túlsúlyos és elhízott egyének magas szintjét nem lehet kizárólag étrenddel és fizikai inaktivitással igazolni, egyéb jellegzetességek, például az anyagcsereprogramozás a korai táplálkozás korai szakaszában és az epigenetikai módosítások is felmerülhetnek. hangsúlyozza az elhízás kialakulását.
Táplálkozás korai életkorban és epigenetikai módosítások esetén az anyagcsere-betegségek társulása veszélyt jelent
A magzat táplálkozási korlátozása: az elhízás kialakulásának kockázata
Két évtizeddel ezelőtt azt figyelték meg, hogy az alacsony születési súly összefüggésben van a felnőttkori krónikus, nem fertőző betegségekkel, például a 2-es típusú cukorbetegséggel, a szív- és érrendszeri betegségekkel és az elhízással [2]. Feltételezik, hogy a perinatális növekedés során bekövetkező táplálkozási sérülések, beleértve a méh és a korai posztnatális életet, hozzájárulhatnak a felnőttek anyagcseréjének alkalmazkodásához a táplálkozási korlátozásokhoz. Ha azonban bőséges étrendet kínálnak a perinatális élet során alultáplált embereknek, ez a lehetőség metabolikus elmozdulást vált ki az energia tárolása és a magas zsírszövet felhalmozódása felé, ami a metabolikus/koszorúér-betegségek kialakulásának magas kockázatához vezet [1]. Ezek a megfigyelések vezettek a DOHaD (az egészség és a betegség fejlődési eredete) kifejezés bevezetéséhez, amelyet korábban Barker takarékos fenotípus hipotéziseként ismertek [41]. Jelenleg a DOHaD fogalmát kiterjesztik a perinatális élet, a terhesség és/vagy a szoptatás idején felmerülő egyéb sértésekre, mint például az alsúlyú, túlsúlyos, cukorbeteg vagy hiperpláziás anyákra. Ez a koncepció magában foglal minden olyan stresszes helyzetet is, amely a babákat vagy kölyköket hajlamosíthatja arra, hogy felnőttkorukban anyagcserezavarok alakuljanak ki [42–47].
Az élelmiszerhiány a laktáció alatt nem okoz elhízást
A szexuális dimorfizmus az anyagcsere programozásában
Fontos, hogy az anyagcsere programozásával összefüggő egyes diszfunkciók nem hasonlítanak a férfiak és a nők között. Ezek a diszfunkciók nemcsak attól függenek, hogy a táplálkozási zavar (alul/túl táplálkozás esetén) hol jelentkezett, hanem a nemek közötti fiziológiai különbségektől is [60–62]. Mint arról korábban beszámoltunk, a glükóz homeosztázis, az inzulinérzékenység, a hasnyálmirigy-β-sejtek működése és a zsírszövet-raktárak, a felnőttkor egyéb metabolikus jellemzői mellett, az anya korai fehérjeszegénységével megváltoznak [63–67]. Ezeket a változásokat, beleértve azok nagyságát, más módon fejezik ki mind nőstény, mind hím patkányokban. A fehérje alultápláltság a szoptatás alatt a férfiaknál nagyobb inzulinérzékenységet okoz, mint a nőknél [63, 67], és ez akkor is megfigyelhető, ha a terhesség és a laktáció alatt bekövetkezik a fehérje korlátozás, ami a férfiaknál magasabb inzulinérzékenységhez vezet [66, 67], míg az inzulin a nőknél rezisztencia figyelhető meg [65]. Ugyanakkor ellentmondó adatokról is beszámoltak [64]. A glükóz homeosztázis-károsodások különbségeit nemtől függően figyeljük meg olyan felnőtt patkányokban, akiknél prenatálisan fehérje-korlátozás volt folyamatban; a táplálkozási sértés időszaka azonban fontos az anyagcsere-zavar mértékének és minőségének meghatározásához.
Programozott anyagcsere és inzulin szekréció-kapcsolási folyamat
A neurotranszmitterek programozott anyagcseréje és inzulintrópikus hatásai
Következtetések
A mai napig a bizonyítékok összessége azt mutatja, hogy az anya fehérje korlátozása a laktáció alatt úgy programozza az anyagcserét, hogy kevesebb energiát foglaljon el patkány felnőttkorában. Bár számos tanulmány kimutatta, hogy a perinatális táplálkozási változások mind a stressz neuroendokrin rendszert módosítják, beleértve a hipotalamusz-hipofízis-mellékvese tengelyt, mind pedig a szimpatoadrenális rendszert, a PNS-ről ebben az összefüggésben kevéssé ismert. Ennek a rendszernek azonban minden aspektusa részt vesz az energia-anyagcsere szabályozásában. Kimutattuk, hogy a felnőtt hím patkány utódok, akiknek anyáinak a laktáció alatt fehérje-korlátja volt, alacsony PNS aktivitást mutatnak. A rágcsálók laktációja az agy fejlődésének döntő fázisa, és hasonlónak tekinthető az emberi terhességi időszak utolsó egyharmadához [9, 87]. Bár a fehérje korlátozása a laktáció alatt az anyagcserében állandó változásokat indukál, még mindig nem ismert, a bizonyítékok arra utalnak, hogy az ANS változások hozzájárulhatnak a glikémiás homeosztázis károsodásához metabolikusan programozott patkányokban. Hogy az ANS ezen módosításai kedveznek-e vagy gátolják-e a metabolikus szindróma jellemzőit, továbbra is ellentmondásos, és ez a kérdés további vizsgálatokat indokol.
Finanszírozás
Ezt a munkát a Brazil Szövetségi Alapítvány, a Conselho National de Desenvolvimento Científico e Tecnológico (CNPq), a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) és a Paraná Science Foundation (Fundação Araucária) támogatta.
- A terhesség korai terhességi metabolikus tényezői, amelyek normál testsúlyú terhességi diabetes mellitushoz kapcsolódnak
- A sclerosis multiplex rohamrendszerének korai jelei
- Központi idegrendszeri szabályozás az emberi agyi képalkotásról
- Központi idegrendszer tápanyagjelzése Az energiaegyensúly és a jövő jövőjének szabályozása
- KORAI; ENTERAL; TÁPLÁLÁS; BAN BEN; ESETEK; NAK,-NEK; TELJESÍTÉS; A bélből; VAL VEL; HASHÁRTYAGYULLADÁS