Purin anyagcserezavar
Kapcsolódó kifejezések:
- Hyperuricemia
- Lesch-Nyhan-szindróma
- Húgysav
- Enzim
- Automatizálás
- Purin
- Köszvény
- Urate
- Hipoxantin-foszforibozil-transzferáz
Letöltés PDF formátumban
Erről az oldalról
A purin metabolizmusa a hiperurikémia patogenezisében és a purinnal kapcsolatos anyagcsere veleszületett hibái betegséggel összefüggésben
Rosa Torres Jiménez, Juan García Puig, köszvény és más kristályos ízületi gyulladások, 2012
A purin anyagcseréjének zavarai: Osztályozás
A szénhidrát-anyagcsere egyes enzimhibái (glikogén-tárolási betegségek) összefüggenek a hiperurikémiával és a köszvénygel 8 (3-2. Ábra). Az I. típusú glikogenózis a glükóz-6-foszfát-hiány miatt veszélyezteti a glükóz-defoszforilezést, és kettős mechanizmus révén növelheti a szérum urátkoncentrációt: fokozott laktáttermelés, ami megzavarhatja a vizelet húgysav kiválasztását. 9 Másrészt a hyperuricemia az I. típusú glikogenózisban a fokozott ATP-lebontás és a megnövekedett AMP-termelés következtében megnövekedett hipoxantin-, xantin- és húgysavszintézis eredménye is lehet. 10 A III, V és VII típusú glycogenosisban az acetil-CoA szintézis károsodott, ami gyenge citromciklus-hatékonyságot és csökkent ATP-termelést eredményez. 10 Ennek ellensúlyozására az adenin-nukleotid-ciklus túltermeli a fumarátot, hogy ezzel táplálja a Krebs-ciklus aktivitását. Az adenin-nukleotid-ciklus túlzott aktivitása megnövekedett IMP-képződést eredményez az AMP-ből, amely bejuthat a purin-nukleotid degradációs útjába, ami fokozott húgysavszintézist eredményez 10 (lásd 3-2. Ábra).
Meghatározás
A köszvény a purin metabolizmusának örökletes rendellenessége, amely hiperurikémiát okoz emberben, különösen a férfiaknál. A „köszvény” kifejezés általános használatban az ízületi gyulladás egyik formájára utal. Jellemzően a vér húgysavszintjének emelkedése (a szérum-urátszint> 7 mg/dl férfiaknál és> 6 mg/dl nőknél) a nátrium-urát kristályainak lerakódását eredményezi az ízületekben, a csontokban és a bőr alatti szövetekben. Ezeknek a kristályoknak a gyulladásos reakciói súlyos, visszatérő akut ízületi rohamokat idéznek elő. A köszvény diagnózisát megerősíti a negatív kettős törésű kristályok bemutatása a szinoviális ízületi folyadékban.
Fül és időbeli csont
Tophaceous Gout
A tophaceus köszvény a purin anyagcseréjének vagy a húgysav renális kiválasztásának rendellenessége. A nátrium-urát kicsapódik, és az egész testben lerakódások maradnak (tophi). A köszvényes tophi egyik leggyakoribb helye a fül hélixje. Ezen a helyen a tophi nem fájdalmas, szilárd csomók. A köszvény örökletes vagy szerzett betegségként fordulhat elő. Az elsődleges köszvény (az esetek 90% -a) az anyagcsere örökletes hibája, amely a purinszintézis enzimatikus hibájából vagy a húgysav vese kiválasztásának hibájából ered. A másodlagos vagy szerzett köszvény (az esetek 10% -a) olyan rendellenességekben fordul elő, amelyek fokozzák a húgysav termelését (pl. Leukémiák) vagy csökkentik annak kiválasztódását (pl. Krónikus veseelégtelenség).
Szövettanilag a köszvényes tophi tű alakú urátkristályokból áll, amelyek egy idegen testet körülvevő óriássejt-reakcióval járnak. Ha gyanú merül fel a köszvény diagnózisáról, a reszektált szövetet abszolút alkoholban vagy bármilyen nemvizes rögzítőben kell rögzíteni, mert az urátkristályok vízoldékonyak.
A kezelés a szisztémás rendellenesség felé irányul.
A szisztémás betegség neurológiai vonatkozásai II
Roger E. Kelley, Hans C. Andersson, a klinikai neurológia kézikönyvében, 2014
A purin anyagcseréjének leggyakoribb rendellenessége a köszvény. Ez a lakosság nagyjából 1-2% -át érinti, és hiperurikémia jellemzi urátkristályos lerakódással, amely nephrolithiasisot és gyulladásos ízületi gyulladást eredményez (Schlesinger, 2010). A köszvény kialakulása multifaktoriális a patogenezisben, bár autoszomális domináns juvenilis köszvényes nephropathiáról számoltak be (Calabrese et al., 1990). Ez a genetikailag közvetített rendellenesség a csökkent urát renalis clearance-szel és nem a purin metabolikus útvonalának károsodásával függ össze. Az uromodulint kódoló UMOD gén mutációit azonosították, más néven Tamm – Horsfall glikoproteineket (Turner et al., 2003). Végső stádiumú vesebetegség alakul ki, amely a vese medulláris cisztáinak kialakulásához kapcsolódik.
A károsodott purin metabolikus utakon és a húgysav csökkent vese clearance-ein kívül a köszvényben megfigyelhető hyperuricemia további magyarázata a purin nukleotidkészlet nagysága, a purin analógok, köztük a nukleinsavak fokozott katabolizmusa, az előformázott purinok megnövekedett forgalma és a kísérő betegségek megnövekedett húgysavszint, például kóros elhízás, hiperlipidémia, rosszindulatú daganat, sarlósejtes betegség, glikogén tárolási betegség, étrend (hús, tenger gyümölcsei, sör, szeszes italok), valamint családi hajlam.
A köszvény általában nem közvetlenül kapcsolódik a neurológiai betegséghez. Lehetnek azonban másodlagos hatások is. Például az UMOD-val összefüggő vesebetegség urémiás encephalopathiához vezethet, ha nem kezelik megfelelően hemodialízissel. Továbbá az úgynevezett kockázati hármas az érelmeszesedés elősegítésére köszvényes betegeknél magában foglalja a gyulladást, az oxidatív stresszt és a hiperlipidémiát (Krishnan et al., 2008). Ez növelheti az agyi érrendszeri megbetegedések kockázatát, mint e triász szövődményét.
A köszvény kezelése magában foglalja a megelőzést alacsony purintartalmú étrenddel és az allopurinollal, amely blokkolja a hipoxantin kevésbé oldható xantinná való átalakulását a xantin-oxidáz gátlásán keresztül. Az akut támadásokat általában kolchicinnel vagy nem szteroid gyulladáscsökkentőkkel kezelik.
Gyermekneurológia III. Rész
HA. Jinnah,. Georges Van Den Berghe, a Klinikai Neurológia Kézikönyvében, 2013
Egyéb purin rendellenességek
Áttekintés
A purin anyagcseréjének számos egyéb rendellenessége van, ahol a neurológiai jellemzők kevésbé jól jellemezhetők, vagy csak kis számú beteg számára állnak rendelkezésre (Camici et al., 2009). Ezen rendellenességek némelyikében a neurológiai jellemzők következetlenek, és kérdéseket vetnek fel az anyagcserezavarhoz való viszonyukkal kapcsolatban. Ezek közül a legelterjedtebbeket az alábbiakban vázoljuk és a 187.1. Táblázat foglalja össze .
Foszforibozil-pirofoszfát-szintáz-hibák
A foszforibozil-pirofoszfát (PRPP) szintáz egy példa arra, hogy ugyanazon gén különböző mutációi hogyan vezethetnek különböző klinikai fenotípusokhoz. A PRPS1 gén mutációi, amelyek növelik a PRPP szintáz aktivitását, szenzineineurális halláskárosodáshoz vezetnek. Ezeknek a betegeknek körülbelül a fele pszichomotoros retardációval is rendelkezik különböző mértékben.
A PRPS1 gén azon mutációit, amelyek csökkentik, de nem szüntetik meg a PRPP szintáz aktivitását, összefüggésbe hozták a CMTX5 típusú Charcot – Marie – Tooth szindróma egyes eseteivel. Az érintett egyének szenzineineurális hallásvesztéssel, optikai neuropátiával és perifériás szenzomotoros neuropathiával rendelkeznek. A null PRPP szintázhoz vezető mutációk összekapcsolódtak az Arts szindrómával, amelyet hallás és látásvesztés, pszichomotoros retardáció és visszatérő fertőzések jellemeznek.
Nem ismertek azok a mechanizmusok, amelyek révén a PRPP-szintáz rendellenességei neurológiai diszfunkciókat okoznak. A PRPP koszubsztrátként szolgál egy különféle enzimcsalád számára, amelyek közül csak három vesz részt közvetlenül a purin metabolizmusában. Ezek közé tartozik a de novo purinszintézis első és sebességkorlátozó lépése (amidofoszforiboziltranszferáz (AMPRT)), valamint két újrahasznosító enzim (APRT és HPRT). A PRPP szintáz hibáival járó klinikai szindrómák nem hasonlítanak az APRT vagy a HPRT hibákhoz társuló szindrómákra. Így a PRPP szintázzal kapcsolatos neurológiai megnyilvánulások a nem purin útvonalak változásaiból származhatnak.
Purin-nukleotid-foszforiláz-hiány
A purin-nukleotid-foszforiláz (PNP) hiány általában az immunrendszerrel kapcsolatos rendellenességekkel jár. A legtöbb betegnek eltérő mértékű immunhiánya van, egyharmadának autoimmun betegségei vannak. Körülbelül fele neurológiai jellemzőkkel rendelkezik. A súlyosság széles skálája van. Súlyosabban érintett egyének súlyos pszichomotoros retardációt mutatnak, míg a kevésbé súlyosan érintett egyéneknél csak enyhe motoros vagy kognitív rendellenességek lehetnek. A neurológiai nehézségek markáns változékonyságának oka továbbra is bizonytalan. A neurológiai problémák egy része közvetlenül az enzimhibából eredhet, míg mások másodlagosak lehetnek az immunhibák vagy más ismeretlen öröklött vagy szerzett tényezők közötti kölcsönhatás miatt.
Adenozin-deamináz-hiány
Az adenozin-deamináz (ADA) hiány leggyakrabban súlyos kombinált immunhiányos szindrómával jár, halálos fertőzésekkel csecsemőkorban vagy kora gyermekkorban. A csontvelő-transzplantációval vagy enzimpótlással járó kezelésekkel túlélő gyermekek időnként idegrendszeri nehézségeket okoznak. Problémák lehetnek pszichomotoros retardáció, rohamok vagy halláskárosodás. E problémák egy része közvetlenül az enzimhibából eredhet, míg mások krónikus fertőzés vagy kezelésük következményei.
Deoxyguanozin kináz hiány
A deoxiguanozin-kináz (dGK) enzim mitokondriális, és hiánya a mitokondriális DNS-kimerülési szindrómák súlyos formájával jár. A legtöbb betegnél májelégtelenség és súlyos pszichomotoros retardáció jelentkezik röviddel a születés után. A halálos multiorganikus rendszer meghibásodása az élet első évében gyakori.
IMP dehidrogenáz hiány
Az IMP dehidrogenázt (IDH) 1 kódoló gén mutációit összefüggésbe hozták a 10-es típusú retinitis pigmentosa-val és néhány esetben Leber veleszületett amaurosisával.
Urolithiasis és nephrocalcinosis gyermekkorban
Bernd Hoppe,. Dawn S. Milliner, az átfogó gyermekgyógyászati nephrológiában, 2008
Xantin
A xanthinuria a purin anyagcseréjének ritka autoszomális recesszív rendellenessége, amely urolithiasishoz vezet. A xantin-oxidoreduktáz vagy dehidrogenáz hiánya, amely a purin lebontási útjának utolsó két lépését katalizálja, nagy mennyiségű xantin és hipoxantin termelését eredményezi, ami a húgysav csökkent termeléséhez kapcsolódik. A xantin kövek bármely korban, akár csecsemőknél is kialakulhatnak, a xantin gyenge oldhatósága következtében. Van azonban egy nagy klinikai változatosság, amelyet nem magyaráz a genetikai hiba; a betegek csak körülbelül felének van urolithiasis. 83 A kristályos nephropathia okozta akut veseelégtelenség ritka szövődmény. 84 A legtöbb beteg közel-keleti vagy mediterrán eredetű. 83 A xanthinuria ritka a világ más részein.
A diagnózist kőelemzéssel vagy a vizelettel történő túlzott xantin-kiválasztás jelenlétéből állítják fel. A cél egy narancssárga-barna vizelet üledék, narancssárgás pelenkák, 85 vagy mély hypouricemia megállapítása, amelyet gyakran véletlenül fedeznek fel.
A klasszikus xanthinuria két típusa ismert. Az I. típusban az allopurinol oxipurinollá való átalakulása nem sérül, míg a II. Típusban az aldehid-oxidáz további hiánya blokkolja az allopurinol oxipurinollá való átalakulását. Mindkét típus klinikailag azonos, és feltehetően ugyanazon XDH gén különböző mutációi okozzák.
A klasszikus xanthinuria mindkét típusával ellentétben a molibdén-kofaktor és a kombinált xantin-dehidrogenáz/szulfit-oxidáz-hiány együttes hiányából eredő xanthinuria összetett betegség. Az ilyen betegeknél általában újszülöttkori rohamok, súlyos neurológiai tünetek és diszmorf tünetek jelentkeznek, és a vizelettel szulfociszteinsavat választanak ki. 83.
Másodlagos xantinkövek, sőt xantin nephropathia is kialakulhat a húgysav durva túltermelésével járó súlyos hiperurikémia allopurinollal történő kezelésének eredményeként, amint ez a Lesch-Nyhan-szindrómában és a myeloproliferatív rendellenességekben megfigyelhető. Az ilyen kövek azonban a xantinon kívül gyakran további összetevőket tartalmaznak. 83.
Lesch – Nyhan-szindróma
Laura De Gregorio, William L. Nyhan, a Neurológiai Tudományok Enciklopédiájában, 2003
Biokémiai alapok
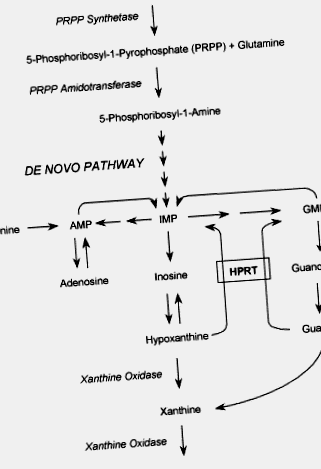
A Lesch – Nyhan-szindróma (LNS) a purin metabolizmusának genetikai rendellenessége, amelyet a HPRT enzim szinte teljes hiánya okoz. A HPRT katalizálja azt az újrafeldolgozási reakciót, amelyben a szabad purinbázisokat, a hipoxantint és a guanint újrahasználják, hogy kialakítsák a megfelelő nukleotidjaikat, inozinsavat és guanilsavat. Ez a purinmentési mechanizmus alternatív és gazdaságosabb utat biztosít a de novo purin nukleotid szintéziséhez. A húgysav a purin anyagcseréjének végterméke. A mentési út hiányában túlzott mennyiségű húgysav keletkezik (1. ábra). Így a hyperuricemia a HPRT-hiány minden típusának közös jellemzője.
1.ábra . A purin metabolikus útvonalainak diagramja. AMP, adenozinsav; IMP, inozinsav; GMP, guanilsav; HPRT, hipoxantin-guanin-foszforibozil-transzferáz.
Fejlődési fogyatékossággal élő személyek önkárosító magatartásának és fájdalmának áttekintése
1 LESCH-NYHAN SZINDRÓMA
Az LNS (Lesch & Nyhan, 1964) a purin anyagcseréjének nemi vonatkozású rendellenessége, amelyben az egyén görcsösséget, koreoatetózist, lehetséges mentális retardációt, emelkedett vizeletsavszintet, önkárosító és agresszív viselkedést mutat (Schroeder et al., 1991) . Pontosabban, ez a szindróma a hipoxantin-guanin-foszforibozil-transzferáz (HG-PRT) enzim hiányos aktivitásával jár. Születéskor az LNS-ben szenvedő legtöbb ember normális motoros fejlődést mutat, de 6–8 hónapra a progresszív generalizált spasztikus parézis és a bilaterális anthetosis jelei jelentkeznek. Az akaratlan izommozgások is fejlődnek, beleértve a chorea-t, a ballismust és a remegést. A szindróma kialakulását súlyos dysarthia és dysphagia is kíséri. Ezenkívül az LNS minden esetben obszesszív jellegű harapása következik be a szájban és az ujjakban. Az önsérülés által generált látszólagos fájdalom ellenére (a fájdalom észlelése normálisnak tűnik az LNS-ben) az önharapás továbbra is fennáll.
Lesch – Nyhan-szindróma
Bevezetés
A Lesch-Nyhan-szindróma (LNS) a purin metabolizmusának X-hez kapcsolódó genetikai rendellenessége, amelyet a hipoxantin – guanin-foszforiboziltranszferáz (HPRT) enzim szinte teljes hiánya okoz.
A HPRT katalizálja azt az újrahasznosítási reakciót, amelyben a szabad purinbázisokat, a hipoxantint és a guanint újrahasználják, hogy kialakítsák a megfelelő nukleotidjaikat, inozinsavat és guanilsavat. Ez a purinmentési mechanizmus alternatívát és gazdaságosabb utat biztosít a de novo purin nukleotid szintéziséhez. A húgysav a purin anyagcseréjének végterméke. A mentési út hiányában túlzott mennyiségű húgysav keletkezik (1. ábra). Így a hyperuricemia a HPRT-hiány minden típusának közös jellemzője.
1.ábra . A purin metabolizmusának útvonala. AMP, adenozin-5′-monofoszfát; ATP, adenozin-trifoszfát; GMP, guanozin-5′-monofoszfát; IMP, inozin-5′-monofoszfát; PRPP, 5-foszforibozil-1-pirofoszfát.
A klasszikus Lesch – Nyhan-betegséget hiperurikémia, mentális retardáció, önkárosító magatartás, koreoatetózis és görcsösség jellemzi. A HPRT-hiány expressziójában azonban széles fenotípusos heterogenitás figyelhető meg. A HPRT gén az X kromoszóma hosszú karján helyezkedik el (Xq26 – q27), és a betegség szinte kizárólag férfiaknál fordul elő.
Becslések szerint az LNS előfordulási gyakorisága 100 000-től 1-ig 380 000-től 1-ig terjed. Számos HPRT-hiányos beteg HPRT-génjének molekuláris defektusának jellemzése heterogén mutációkat mutatott ki, ugyanazokkal a változásokkal ritkán nem rokon törzskönyvekben találhatók meg. Változó fokú reziduális aktivitással rendelkező enzimeket találunk azoknál a betegeknél, akiknél a klasszikus betegség bizonyos jellemzői hiányoznak, és durva összefüggés van a klinikai megnyilvánulások súlyossága és az intakt fibroblasztokban mért reziduális aktivitás mennyisége között.
A xantin-oxidáz gátlókkal, például allopurinollal vagy febuxosztáttal történő kezelés megakadályozza a húgysav túltermelésének legtöbb következményét, míg a neurológiai vagy viselkedési tünetek esetén nincs hatékony kezelés.
Önkárosító magatartás: Nem emberi prímamodellek az emberi állapot számára
Dopamin
Ha a SIB potenciálisan előállítható a szuperérzékeny vagy felfelé szabályozott DA receptorok stimulálásával, akkor ésszerű, hogy a DA receptor antagonisták képesek legyenek csillapítani, ha nem blokkolni e viselkedési patológia előfordulását. Bár jelenleg kevés bizonyíték van a DA-antagonisták ilyen hatására Lesch – Nyhan-szindrómában (Nyhan, 2000; Saito és Takashima, 2000), jelentős irodalom áll rendelkezésre az értelmi fogyatékos/fejlődési fogyatékossággal élő személyek neuroleptikus (antipszichotikus) válaszairól. ) gyógyszerek, amelyek általában blokkolják a D2 és néha a D1 receptorokat is. Összességében ezek a tanulmányok vegyes eredményeket hoztak, pozitív válaszokkal (azaz a SIB gyakoriságának vagy súlyosságának csökkenésével) egyes esetekben, más esetekben azonban nem (Baumeister et al., 1993; Schroeder et al., 1995; Clarke, 1998). Ezen meggyőző eredmények ellenére továbbra is érdeklődik a DA antagonisták, különösen az olyan atipikus neuroleptikumok, mint például a risperidon, az olanzapin vagy a kvetiapin, amelyek további molekuláris célpontokkal, például az 5-HT2 receptorokkal kölcsönhatásba lépnek (lásd a gyógyszerrel kapcsolatos későbbi részt). kezelések a SIB-hez).
- Nem fertőző betegség - áttekintés a ScienceDirect témákról
- Prosztata Adenoma - áttekintés a ScienceDirect témákról
- Hasnyálmirigy-lé - áttekintés a ScienceDirect témákról
- Csipkebogyó - áttekintés a ScienceDirect témákról
- Paralytic Ileus - áttekintés a ScienceDirect témákról