Jelentős fogyás
A klinikai vizsgálatok során a betegek többsége klinikailag jelentős, ≥5% -os súlycsökkenést ért el a Saxenda ® 1 alkalmazásával
A betegek lefogytak a Saxenda ® segítségével
Egy 1 éves vizsgálat során a Saxenda ® -val kezelt betegek 85% -a fogyott 1
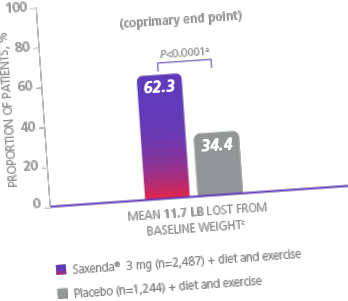
Egy 56 hetes vizsgálatban 3731, 2-es típusú cukorbetegség nélküli és ≥30, vagy ≥27% -os BMI-vel rendelkező, legalább 1 súlyfüggő komorbiditású beteget vontak be a betegekre, vagy a Saxenda ® (n = 2,487), vagy a placebo (n = 1.244), valamennyi beteg csökkentett kalóriatartalmú étrendben részesült (
500 kcal/nap hiány) és testmozgási tanácsadás. 1
A betegek többsége klinikailag jelentős, ≥5% -os súlycsökkenést ért el a Saxenda®1 alkalmazásával
a Különbség a placebótól (legkisebb négyzetek [LS]) átlag 27,9% [95% CI, 23,9. 31.9]).
b Különbség a placebóhoz képest (LS átlag), 18,5% (95% CI, 15,2, 21,7).
c A súlycsökkenés fontban (lb) az átlagos testtömeg 5% -ának, 10% -ának vagy 20% -ának számít.
d A testtömeg-görbe változásának gyakorisága kumulatív eloszlása alapján.
- Az elsődleges végpontok a súlycsökkenés átlagos százalékos aránya, a kiindulási súlycsökkenés ≥5% -át elérő betegek százaléka és a kiindulási súlycsökkenés> 10% -át elérő betegek százaléka volt 1
- A súlycsökkenést a testsúly bármely csökkenésének definiálták az 1. vizsgálat kezdetétől
- Az átlagos kiindulási testtömeg 233,9 font, az átlagos BMI pedig 38,3 kg/m 2 volt
a Különbség a placebótól (legkisebb négyzetek [LS]) átlag 27,9% [95% CI, 23,9. 31.9]).
b Különbség a placebóhoz képest (LS átlag), 18,5% (95% CI, 15,2, 21,7).
c A súlycsökkenés fontban (lb) az átlagos testtömeg 5% -ának, 10% -ának vagy 20% -ának számít.
d A testtömeg-görbe változásának gyakorisága kumulatív eloszlása alapján.
- Az elsődleges végpontok a súlyváltozás átlagos százalékos aránya, a kiindulási súlycsökkenés ≥5% -át elérő betegek százaléka és a kiindulási súlycsökkenés> 10% -át elérő betegek százaléka volt 1
- A súlycsökkenést a testsúly bármely csökkenésének definiálták az 1. vizsgálat kezdetétől
- Az átlagos kiindulási testtömeg 233,9 font, az átlagos BMI pedig 38,3 kg/m 2 volt
a Különbség a placebótól (legkisebb négyzetek [LS]) átlag 27,9% [95% CI, 23,9. 31.9]).
b Különbség a placebóhoz képest (LS átlag), 18,5% (95% CI, 15,2, 21,7).
c A súlycsökkenés fontban (lb) az átlagos testtömeg 5% -ának, 10% -ának vagy 20% -ának számít.
d A testtömeg-görbe változásának gyakorisága kumulatív eloszlása alapján.
- Az elsődleges végpontok a súlycsökkenés átlagos százalékos aránya, a kiindulási súlycsökkenés ≥5% -át elérő betegek százaléka és a kiindulási súlycsökkenés> 10% -át elérő betegek százaléka volt 1
- A súlycsökkenést a testsúly bármely csökkenésének definiálták az 1. vizsgálat kezdetétől
- Az átlagos kiindulási testtömeg 233,9 font, az átlagos BMI pedig 38,3 kg/m 2 volt
Klinikailag értelmes fogyás
A Saxenda ® -val kezelt betegek többsége klinikailag jelentős fogyást ért el és tartotta fenn 1
a A placebóhoz viszonyított különbség statisztikailag szignifikáns volt. ITT-MI, több imputációval történő kezelés szándéka. 1
21 lb átlagos fogyás
a Saxenda ® betegeknél, akik befejezték a vizsgálatot 2
- Az átlagos kiindulási testtömeg 233,9 font, az átlagos BMI pedig 38,3 kg/m 2 volt
Másodlagos végpont: Hatás a derék kerületére
A nagy derékkörfogat fontos jelzője az elhízással kapcsolatos egészségügyi kockázatoknak 3
Derék mérése 3
A kerület helyes mérése egyszerűen megtanulható és fontos tudni
A Saxenda ® 3,2 hüvelykkel csökkentette a derék kerületét, míg a placebóval 1,6 hüvelyk. 1
A derék átlagos kerülete a kiinduláskor 45,3 hüvelyk volt a Saxenda®-val kezelt betegeknél (n = 2 487) és 45,1 hüvelyk a placebót szedő betegeknél (n = 1244) 1
1. vizsgálat (1 éves) 1,4
- Egy 56 hetes, randomizált, kettős-vak, placebo-kontrollos vizsgálat eredményei a Saxenda ® biztonságosságának és hatékonyságának értékelésére
- Azokat a betegeket, akiknek BMI-értéke ≥30, vagy ≥27, 1 vagy több súlyfüggő társbetegséggel (N = 3731) randomizálták, napi egyszeri Saxenda ® (n = 2,487) vagy placebót (n = 1,244) kaptak életmóddal együtt. módosító program, amely megnövekedett fizikai aktivitást és 500 kcal/napos diétát tartalmazott
- A betegek 4 hetes dózisnövelési perióduson mentek keresztül, amelyet 52 héten keresztül teljes dózis követett
- Az elsődleges végpontok a súlyváltozás átlagos százalékos aránya, a betegek százalékos aránya a kiindulási súlycsökkenés ≥5% -át érte el, és azoknak a százalékos aránya, akiknél a kiindulási súlycsökkenés> 10% -ot ért el az 56. héten
- A másodlagos végpontok közé tartozott a derék kerülete, a vérnyomás és a lipidek változása
- Az átlagos kiindulási testtömeg 233,9 font, az átlagos BMI pedig 38,3 kg/m 2 volt
- A 2-es típusú cukorbetegségben szenvedő betegeket kizárták a részvételből
Lásd Roberto útját a súlykezeléshez
Leírás:
Tanúja lehet Roberto és orvosa közötti beszélgetésnek, miközben Roberto küzd a súlyának kezeléséért. Amikor Roberto felemelte a súlyát orvosának, már edzett és egészségesen táplálkozott. Orvosa tudta, hogy még több segítségre van szüksége Roberto számára a súly megtartásában; ekkor ajánlotta a Saxenda ® -ot .
AJÁNLOTT TARTALOM
Tartós fogyás
Fontos biztonsági információk a 3 mg Saxenda ® (liraglutid) injekcióhoz
FIGYELEM: A pajzsmirigy c-sejtes daganatok kockázata
A liraglutid dózisfüggő és a kezelés időtartamától függő pajzsmirigy C-sejtdaganatokat okoz klinikailag releváns expozíciónál patkányok és egerek mindkét nemében. Nem ismert, hogy a Saxenda ® okozza-e az embereknél a pajzsmirigy C-sejtes daganatait, beleértve a medulláris pajzsmirigyrákot (MTC), mivel a liraglutid által kiváltott rágcsáló pajzsmirigy C-sejtdaganatok emberi jelentőségét nem határozták meg. A Saxenda ® ellenjavallt olyan betegeknél, akiknek személyes vagy családi kórtörténete MTC, valamint 2-es típusú endokrin multiplex neoplazia szindrómában szenvedő betegeknél (MEN 2). Tanácsot adjon a betegeknek az MTC lehetséges kockázatával kapcsolatban a Saxenda ® alkalmazásával, és tájékoztassa őket a pajzsmirigydaganatok tüneteiről (pl. Nyaki tömeg, dysphagia, dyspnoe, tartós rekedtség). A szérum kalcitonin rendszeres monitorozása vagy a pajzsmirigy ultrahangjának használata bizonytalan értékű az MTC korai felismerése szempontjából a Saxenda ® -val kezelt betegeknél. .
Jelzések és felhasználás
- A 3 mg Saxenda ® (liraglutid) injekció a csökkentett kalóriatartalmú étrend és a megnövekedett fizikai aktivitás kiegészítéseként a krónikus súlykezelés érdekében felnőtt betegeknél, akiknek a kezdeti testtömeg-indexe (BMI) 30 kg/m 2 vagy nagyobb (elhízás) vagy legalább 27 kg/m 2 (túlsúlyos) legalább egy, a testsúlyhoz kapcsolódó komorbid állapot (pl. magas vérnyomás, 2-es típusú diabetes mellitus vagy dyslipidemia) jelenlétében
A használat korlátai
- A Saxenda ® nem javallt 2-es típusú cukorbetegség kezelésére
- A Saxenda ® és a Victoza ® egyaránt ugyanazt a hatóanyagot, a liraglutidot tartalmazza, ezért nem szabad együtt használni. A Saxenda ® nem alkalmazható más GLP-1 receptor agonistákkal együtt
- A Saxenda®-t nem vizsgálták inzulint szedő betegeknél. A Saxenda ® és az inzulin nem használható együtt
- A Saxenda ® biztonságosságát és hatékonyságát más fogyás elleni termékekkel kombinálva, beleértve az orvosi rendelvényre kapható gyógyszereket, a vény nélkül kapható gyógyszereket és a növényi készítményeket, nem igazolták.
Fontos biztonsági információk folytatása.
Ellenjavallatok
A Saxenda ® ellenjavallt:
- Azok a betegek, akiknek személyes vagy családi kórtörténetében MTC vagy MEN 2 szerepel
- Azok a betegek, akiknél korábban súlyos túlérzékenységi reakció lépett fel a liraglutiddal vagy a készítmény bármely összetevőjével szemben
- Terhesség
Figyelmeztetések és óvintézkedések
- A pajzsmirigy C-sejtdaganatok kockázata: Ha megmérik a szérum kalcitonin értékét, és megállapítják, hogy az emelkedett, akkor a beteget tovább kell értékelni. A fizikális vizsgálat vagy a nyak képalkotása során észlelt pajzsmirigy csomókkal rendelkező betegeket szintén tovább kell értékelni
- Akut hasnyálmirigy: A forgalomba hozatalt követően liraglutiddal kezelt betegeknél akut hasnyálmirigy-gyulladást figyeltek meg, beleértve a végzetes és nem halálos vérzéses vagy nekrotizáló hasnyálmirigy-gyulladást. Gondosan figyelje meg a betegeket a hasnyálmirigy-gyulladás jeleinek és tüneteinek (tartós, súlyos hasi fájdalom, néha hányással vagy anélkül is a hátába sugárzással). Ha gyanú merül fel a hasnyálmirigy-gyulladásban, azonnal hagyja abba a Saxenda alkalmazást, és ha a hasnyálmirigy-gyulladás megerősítést nyer, ne indítsa újra
- Akut epehólyag-betegség: Jelentős vagy gyors fogyás növelheti a kolelithiasis kockázatát; az akut epehólyag-betegség előfordulása azonban nagyobb volt a Saxenda ® -val kezelt betegeknél, mint a placebóval, még a súlycsökkenés mértékének figyelembevétele után is. Kolelithiasis gyanúja esetén epehólyag-vizsgálatok és megfelelő klinikai nyomon követés szükséges
- A hipoglikémia kockázata az antidiabetikus terápia egyidejű alkalmazásával: Ha a Saxenda-t inzulinszekretagógnal (pl. Szulfonilureával) együtt alkalmazzák, súlyos hipoglikémia léphet fel. Fontolja meg az inzulin szekretagóg adagjának csökkentését a hipoglikémia kockázatának csökkentése érdekében. Figyelje a vércukorszintet a Saxenda ® megkezdése előtt és a kezelés alatt, és szükség szerint állítsa be a cukorbetegség elleni gyógyszereket
- A pulzusszám növekedése: A Saxenda ® -val kezelt betegeknél a nyugalmi pulzus átlagosan 2-3 ütem/perc (bpm) növekedését figyelték meg. Rendszeres időközönként figyelemmel kíséri a pulzusszámot, és tájékoztassa a betegeket, hogy a Saxenda ® kezelés alatt pihenés közben számoljon be szívdobogásról vagy versenyző szívverés érzéséről. Hagyja abba a Saxenda ® alkalmazást olyan betegeknél, akiknél a nyugalmi pulzusszám tartósan növekszik
- Vesekárosodás: Akut veseelégtelenségről és a krónikus veseelégtelenség súlyosbodásáról számoltak be, amelyek néha hemodialízist igényelhetnek, általában hányinger, hányás, hasmenés vagy dehidráció kapcsán. Vigyázzon, ha vesekárosodásban szenvedő betegeknél kezdi vagy növeli a Saxenda ® adagját
- Túlérzékenységi reakciók: Súlyos túlérzékenységi reakciókról (pl. Anafilaxia és angioödéma) számoltak be liraglutiddal kezelt betegeknél. Ha túlérzékenységi reakció lép fel, a betegeknek abba kell hagyniuk a Saxenda ® szedését és haladéktalanul orvoshoz kell fordulniuk
- Öngyilkossági magatartás és ötletek: A klinikai vizsgálatok során 3348 Saxenda ® -val kezelt beteg közül 9 (0,3%) és a placebóval kezelt 1941-ből 2 (0,1%) számolt be öngyilkossági gondolatokról; az egyik Saxenda ® -val kezelt beteg öngyilkosságot kísérelt meg. Figyelje a Saxenda ® betegeket a depresszió, az öngyilkossági gondolatok vagy viselkedés és/vagy a hangulatban vagy a viselkedésben bekövetkező szokatlan változások megjelenése vagy súlyosbodása szempontjából. Ha a betegek öngyilkossági gondolatokat vagy magatartást tapasztalnak, hagyják abba a kezelést. Kerülje a Saxenda ® alkalmazását olyan betegeknél, akiknek korábban történtek öngyilkossági kísérleteik vagy aktív öngyilkossági gondolataik
Mellékhatások
- A leggyakoribb, ≥5% -ban jelentett mellékhatások: hányinger, hipoglikémia, hasmenés, székrekedés, hányás, fejfájás, csökkent étvágy, dyspepsia, fáradtság, szédülés, hasi fájdalom és megnövekedett lipázszint
Gyógyszerkölcsönhatások
- A Saxenda ® késlelteti a gyomor kiürülését, és hatással lehet az egyidejűleg alkalmazott orális gyógyszerek felszívódására. Figyelje a Saxenda ® -val egyidejűleg alkalmazott orális gyógyszerek késleltetett felszívódásának lehetséges következményeit
Használat meghatározott populációkban
- Nincsenek adatok a liraglutid emberi anyatejben való jelenlétéről; liraglutid volt jelen a szoptató patkányok tejében
- A Saxenda ® -ot 18 évesnél fiatalabb betegeknél nem vizsgálták, és gyermekgyógyászati betegeknél nem ajánlott
- A Saxenda ® lassítja a gyomor kiürülését. A Saxenda ® -ot nem vizsgálták már fennálló gastroparesisben szenvedő betegeknél
Kattintson ide a Saxenda ® vényköteles információkért, beleértve a dobozos figyelmeztetést is.
- Új súlycsökkentő lövés Saxenda (liraglutide) Mennyire működik CBS News
- A pikkelysömör gyógyszer segítheti a fogyást is - Clinical Advisor
- A legjobb fogyás tisztítja a méregtelenítő étrendet az egynapos eredmények érdekében
- Kis tippek a nagy fogyás eredményéhez
- Nastya Kamenskih rajongók izgatott eredmények fogyás; szüksége van legalább egy kicsit ott; A Bobr