Vaszkuláris diszfunkció a diabetes mellitusban
A milwaukee-i Wisconsini Orvosi Főiskola Orvostudományi és Kardiovaszkuláris Központjából.
A milwaukee-i Wisconsini Orvosi Főiskola Orvostudományi és Kardiovaszkuláris Központjából.
A vaszkuláris simaizom membránpotenciál az ér tónusának meghatározó tényezője elsősorban a feszültségfüggő kalciumcsatornák (VDCC) szabályozásán keresztül. A VDCC-k nyitási valószínűségét megnöveli a membrán depolarizációja, megkönnyítve a kalcium beáramlását és a vaszkuláris simaizomsejtek (VSMC) összehúzódását. A membránpotenciál és a VDCC-aktivitás vezérlését egy komplex jelsorozat szervezi, amely közvetlenül a sarcolemmal membrán alatt fordul elő.
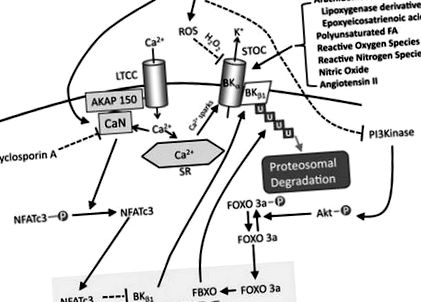
A nagy vezetőképességű kalciummal aktivált káliumcsatornák (más néven maxi-K vagy BK csatornák) kulcsfontosságú szerepet játszanak a vazomotoros tónus modulálásában mind az egészség, mind a betegség szempontjából. A VSMC-ken expresszált BK-csatornák törésként hatnak az érrendszeri tónus növekedésére, amely a membrán depolarizációja és a citoszolos kalcium emelkedése után következik be. A citoszolos kalcium intracelluláris emelkedése a VDCC-n keresztül ryanodin receptorok aktiválódásához vezet, amelyek kalciummennyiséget szabadítanak fel a szarkoplazmatikus retikulumból (kalcium-szikrák). Ezek az intracellulárisan létrehozott szikrák emelik a kalcium helyi szubmembrán koncentrációját és aktiválják a BK csatornákat, amelyek növelik a kálium vezetőképességét és alacsonyabb membránpotenciált. 1 Ez csökkenti a VDCC-k nyitását, ezáltal modulálva az összehúzódást (2. ábra).
Ábra. A vaszkuláris nagy vezetőképességű kalcium-aktivált kálium (BK) csatornák aktiválásának és modulációjának útjai. A diabetes mellitus ≥3 mechanizmussal csökkenti a BK csatorna aktivitását. Először, amint azt Nystoriak és munkatársai kimutatták, 2 a kalcineurin aktiválásával, az aktivált T-sejtek defoszforilezett nukleáris faktorával, a c3 izoform (NFATc3) bejut a sejtmagba, ahol gátolja a BK β1 alegységének transzkripcióját, ezáltal csökkentve a BK kalciumérzékenységét. Másodszor, a cukorbetegség által kiváltott reaktív oxigénfajok (ROS), különösen a hidrogén-peroxid emelkedése közvetlenül oxidálja a ciszteinmaradékokat a BK α alegységének tál régiójában, hogy csökkentse a nyitást. Végül a foszfoinozitol-3-kináz (PI3) kináz csökkent inzulinaktivációja cukorbetegségben csökkenti a villa O-család transzkripciós faktor (FOXO) -3a foszforilációját, lehetővé téve a csak f-box fehérje (FBXO) mag lokalizációját és transzkripcióját, amely ezután aktiválódik a BK β1 alegységeinek proteoszomális lebontása. Az AKAP jelzi az A-kináz rögzítő fehérjét 150; Akt, protein-kináz B; CaN, kalcineurin; FA, zsírsav; LTCC, L típusú kalciumcsatorna; STOC, spontán átmeneti kifelé irányuló áram; és U, ubiquitin.
A vaszkuláris tónus BK-csatorna modulációjának klasszikus példája a myogén vazokonstrikció csillapítása. 3,4 Az intraluminális nyomás növekedése depolarizálja a VSMC membránt, ami kalcium beáramlást és myogén összehúzódást vált ki. A kalcium beáramlás kiváltja a korábban nyugalmi BK csatornákat, ami megnövekedett kálium vezetőképességet, a simaizom membrán hiperpolarizációját és a kalcium beáramlás csökkenését eredményezi, ezáltal csillapítva a myogén összehúzódást.
A BK csatornák homotetramer α alegységekből állnak, kálium-szelektív pórusrégióval. A csatornakomplexumot β alegységek szegélyezik, amelyek fokozzák a kalciumérzékenységet. Az β1 alegység funkcionális mutációinak elnyerése emberben a magas vérnyomás és a koszorúér-betegség alacsony előfordulásával jár együtt, 5–7, míg a funkciómutációk genetikai elvesztése az α alegységben vagy a β1 alegység csökkenése növeli a vérnyomást és a szív- és érrendszeri betegségeket. 8–10 Ezzel szemben a β alegység funkcionális polimorfizmusai csökkentik a diasztolés vérnyomást és csökkenthetik a kardiovaszkuláris események kockázatát. 6.
Diabetes mellitusban a BK csatornák hatása csökken, részben a β1 alegység expressziójának csökkenéséből adódó csökkent kalcium érzékenység miatt. 11 Érdekes módon a csökkent aktivitás jellege idővel változik. A Zucker magas zsírtartalmú diéta által kiváltott diabetes mellitus modelljének korai szakaszában (8 hét) vaszkuláris diszfunkciót és csökkent BK áramokat figyelnek meg a VSMC-kben. 12-6 hónapra a BK csatornák továbbra is nyitottak a feszültségváltozásokra, de a kalcium érzékenység csökken. 13 Ebben a fejlettebb szakaszban a cukorbetegségben szenvedő patkányok Zucker magas zsírtartalmú étrend által kiváltott modellje a BK csatorna rendellenes biofizikai tulajdonságait is demonstrálja, amelyeket a korábbi időpontokban nem figyeltek meg, beleértve a kalciumérzékenység csökkenését, a hosszabb záródási időket és a rövidebb nyitást. alkalommal. 13.
Az NFATc3 út vaszkuláris ioncsatornákra gyakorolt hatása nem csak a BK csatornára jellemző, mert az NFATc3 nukleáris lokalizációja az angiotenzin II-re válaszul csökkenti a Kv2.1 csatorna expresszióját. Így az NFATc3 a vazodilatáció több komplementer útját is bekapcsolhatja a betegségben. Valójában, a BK-hoz hasonlóan, a Kv-csatorna aktivitása is 17, az expressziója pedig 18 csökken a diabetes mellitusban. Az NFATc3 közvetlenül növelheti az L típusú kalciumcsatorna kalcium beáramlását azáltal, hogy a csatornát összekapcsolja az aktivátor protein kináz Cα-val. 19 Reciprok módon a protein-kináz Cα, a kalcineurin és az subsarcolemmal perzisztens kalcium-sziporkák összecsapódnak, hogy megváltoztassák az érrendszeri génexpressziót az NFATc3-on keresztül. 20
A kalcineurin – NFATc3 útvonal szövetségese lehet a BK csatorna funkciójának csökkentésében betegség esetén. A BK-csatorna β1 alegységeinek fokozott proteoszomális degradációja diabetes mellitusban fordul elő, csökkentve a csatorna aktivitását. Így a β1 alegység fokozott pusztulása és csökkent képződése szinergikusan hozzájárulhat a csökkent BK érzékenységhez a diabetes mellitusban. A pórusképző α alegység expresszióját ez nem befolyásolja. 22.
A jelenlegi tanulmány eredményei jóval túlmutatnak a diabetes mellituson. A hipertónia egyes formáit a csökkent β1 alegység expresszió és a BK funkció csökkenése jellemzi. A szívelégtelenség a megnövekedett perifériás vaszkuláris rezisztenciával is összefügg, részben a BK csatorna érzékenységének kísérő csökkenésével és a nukleáris NFATc3 növekedésével magyarázható. 8 Valószínű, hogy a BK-csatorna aktivitásának csökkentése a kardiovaszkuláris maladaptív állapotok gyakori patofiziológiai jellemzője, ami közös terápiás célpontra utal.
A jelen tanulmány által felvetett számos kérdés megválaszolatlan marad. Mennyire általánosítható az NFATc3 és a kalcineurin szerepe a diabetes mellitus más modelljeire? A magas zsírtartalmú diétás egérmodell érrendszeri változásai nem lehetnek reprezentatívak, annak ellenére, hogy a BK β1 alegység expressziója csökkent a diabetes mellitus egyéb formáiban. 11 Ezenkívül a túlzott zsírbevitel és a glükóz-diszreguláció hozzájárulása nem különböztethető meg ettől a tanulmánytól. Az érrendszer működését a vezetõ artériákban (aorta, mesentericus artéria) értékeltük, és nem az arteriolákban, amelyek a hipertóniában az érrendszeri rezisztencia elsõdleges forrása; a géntechnológiával módosított egerek vérnyomás-változásai azonban a megváltozott kalciumjelzés globálisabb hatását sugallják az artériás ágyon. Az NFATc3 transzkripcióval szabályozza azokat a más fehérjéket, amelyek hozzájárulhatnak a megváltozott vazomotoros tónushoz a diabetes mellitusban, ideértve a ciklooxigenázt is. 23
Egy másik megválaszolatlan kérdés az, hogy a betegség hogyan aktiválja az NFATc3 útvonalat. Mi az a közeli jel, amely kiváltja az NFATc3 defoszforilezését és nukleáris transzlokációját? Számos kardiovaszkuláris rizikótényezőben, köztük a diabetes mellitusban, a magas vérnyomásban és a szívelégtelenségben közös nevező az oxidánsok emelkedése, ami károsítja az endotheliális és a VSMC funkciót. Lu és mtsai 24 kimutatták, hogy a BK-csatornák visszaszorítása az 1-es típusú diabetes mellitus (streptozotocin) patkánymodelljében az emelkedett oxidatív stressznek tulajdonítható. Diabetes mellitus in vivo vagy megemelkedett glükóz in vitro stimulálja a reaktív oxigéntermelést a nikotinamid-adenin-dinukleotid-foszfát-oxidáz révén, csillapítva az Akt-ot és aktiválva a villás doboz O-család transzkripciós faktor-3a/f-box csak fehérjétől függő BK β1 lebomlását (ábra). Ez összhangban áll Friedman és mtsai25 tanulmányával, amely azt mutatja, hogy az endothelin-1-en keresztüli vaszkuláris NFATc3 felemelkedését megakadályozza a Tempol, egy szuperoxid-megkötő. A helyzet még bonyolultabb, mivel a hidrogén-peroxid, amelyről azt gondolják, hogy a szuperoxid elsődleges redox-jelző származéka, a 26,27-es kalcineurin erős inhibitora, amely várhatóan megakadályozza a BK β1 NFATc3-on keresztüli szabályozását.
Összefoglalva, a BK csatornák a vaszkuláris tónust szabályozó subarcolemmal kalcium jelátviteli komplex szerves részét képezik. Annak megértése, hogy a vazokonstrikciónak ez a moduláló hatása miként romlik a betegségben, új utakat nyithat a diabetes mellitus, a magas vérnyomás és a szívelégtelenség kardiovaszkuláris szövődményeinek kezelésében. Jelen tanulmány megteszi az első lépést annak megállapításával, hogy a kalcineurin – NFATc3 útvonal hozzájárul a magas vérnyomáshoz a diabetes mellitusban azáltal, hogy a BK csatorna kalcium-szenzibilizáló β1 alegységének expresszióját csökkenti.
A finanszírozás forrásai
Ezt a tanulmányt a RO1 HL113612 és az American Heart Association Fellowship Award finanszírozta .
- Az emberi placenta a terhességi cukorbetegség mellitus cukorbetegség ellátásában
- Az adrenalin vaszkuláris és metabolikus hatása a zsírszövetben 2-es típusú cukorbetegségben Táplálkozás;
- Az alsó végtag érrendszeri betegségei 1-es típusú cukorbetegségben
- A terhesség korai étrendjének savassága és a terhességi cukorbetegség kockázata - PubMed
- Toxinok és Diabetes Mellitus Környezeti kapcsolat Diabetes Spectrum