Döntött tengely: maladaptív gyulladás és HPA-tengely diszfunkció hozzájárul a TBI következményeihez
Absztrakt
Bevezetés
Csak az Egyesült Államokban több mint 5,3 millió ember szenved traumás agysérüléssel (TBI) összefüggő fogyatékosságban (1). A legmagasabb jelentett TBI utáni károsodás a pszichiátriai rendellenességek kialakulása vagy súlyosbodása, beleértve a depressziót, szorongást és hangulati rendellenességeket, amelyek általános életminőség-romlást és megnövekedett hosszú távú halálozást eredményezhetnek (2, 3). Például egy tanulmány szerint a pszichiátriai rendellenességben szenvedő betegek csaknem fele csak a TBI után kezdte meg a tüneteket (4, 5). A TBI utáni pszichiátriai rendellenességek kialakulásában vagy súlyosbodásában a maladaptív gyulladás és a mikroglia priming járulékos szerepet játszik (6, 7). Egyre több bizonyíték arra utal, hogy a stresszre adott megváltozott válasz jelentősen veszélyeztetheti a poszttraumás felépülést és súlyosbíthatja az agy már gyulladt állapotát, amely fenntarthatja a TBI-t követő hosszú távú káros eredményeket.
Általánosságban elmondható, hogy a stressz a test reakciója a környezet változásaira a homeosztázis aktív fenntartása érdekében (8). Az allosztázis az a folyamat, amelynek során a homeosztázis változások révén fenntartható. Az allosztázis a hipotalamusz-hipofízis-mellékvese (HPA) tengely összehangolt aktiválásával és szabályozásával valósul meg, amely aktiválásakor stresszhormonokat szabadít fel. Az elsődleges stresszhormon a kortizol emberben és a kortikoszteron rágcsálókban, mindkettőt CORT-nak fogják nevezni ebben a felülvizsgálatban. A CORT a test stresszreakcióinak szabályozására és a homeosztatikus egyensúlyt fenntartó egyéb folyamatok, különösen a gyulladás és az alvás szabályozására szolgál. A stresszes és nem stresszes ingerekre adott CORT-válasz szabályozásának messzemenő hatása lehet az egészségi állapotra és a traumás sérülésből való felépülésre.
A klinikai adatok azt mutatják, hogy a TBI-t követő HPA-tengely elnyomott aktiválása miatti mellékvese-elégtelenség az összes TBI-eset egynegyedében fordul elő (9). Ezek a klinikai vizsgálatok igazolják, hogy a TBI indukálja a neuroendokrin funkció kiindulási változásait, de nem nyújt betekintést arra, hogy ezek a változások befolyásolják-e a sérülés utáni reakciót és a stresszes ingerekre történő felépülést, vagyis az allosztázist. A TBI utáni HPA-tengely diszfunkciója nem megfelelő válaszokhoz vezet a stresszre, ami viszont diszregulálhatja a gyulladást. Mindkét folyamat szerepet játszik a TBI utáni pszichiátriai rendellenességek kialakulásában; az agykárosodás utáni stressz-immunútvonalak közötti keresztbeszélgetést azonban mind a preklinikai, mind a klinikai vizsgálatok során továbbra sem vizsgálják.
Ez az áttekintés a TBI utáni ideggyulladás áttekintéséről, valamint az agysérülés utáni stressz-immun útvonalak közötti kölcsönhatásról fog beszámolni. Ezután megvitatjuk a TBI utáni HPA tengely diszfunkció klinikai előfordulását és azt, hogy a kísérleti TBI modellek hasonlóan jelentettek-e megváltozott stresszválaszt. Végül megvizsgáljuk a TBI utáni HPA tengely diszfunkció jellemzésének kísérleti megközelítéseit. Hangsúlyt kap a kombinált stressz-TBI modellek értéke, amelyek tisztázzák azokat a molekuláris mechanizmusokat, amelyek összekapcsolják a neuroendokrin károsodást az immun diszregulációval.
Ideggyulladás TBI után
A TBI két fázisban fordul elő: elsődleges és másodlagos sérülés. Az elsődleges sérülést maga a sérülés mechanikai erői okozzák, beleértve az axonális nyírást, a vérzést és a zúzódást (10). Az elsődleges sérülés különböző súlyosságú, gyakran enyhe, mérsékelt vagy súlyos. A TBI-nek sok típusa van, amelyeket lazán kategorizálhatunk diffúz és fokális TBI-re. A diffúz TBI-re példaként említhetők a robbanásszerű sérülések vagy a hipoxiás-ischaemiás sérülések, amelyek széleskörű károsodásokkal járnak, de nem alkotnak külön elváltozást, míg a fokális TBI magában foglalja a koponyatöréseket vagy idegen testeket, például golyót vagy repeszeket, amelyek elváltozást eredményeznek. Sokféle kísérleti TBI állatmodell létezik, amelyek egyaránt képviselik a diffúz és a fokális TBI-t (11). A diffúz TBI gyakori modellje a folyadékütő sérülés (FPI), amelyet úgy hoznak létre, hogy folyékony impulzust adnak az agy intakt dura mater-jára (12). A kontrollált kortikális ütközés (CCI) egy fókuszált TBI modellt jelent, amelyet egy dugattyú okoz, közvetlenül az agyba helyezve, és így zúzódást eredményez (13). Az ilyen típusú sérülési modellek használata elengedhetetlen a TBI-kutatásokhoz az óvintézkedések kidolgozása és az elsődleges sérülés különböző formáinak hatásának csökkentése érdekében.
A másodlagos sérülést közvetett módon a TBI okozza, és hosszan tartó folyamatok eredményeként alakul ki, amelyeket traumák indítanak el, ideértve az ödémát vagy a véráramlás változását. Ezenkívül a másodlagos sérülés neuronális károsodást és degenerációt jelent molekuláris folyamatok révén, ideértve a mitokondriális diszfunkciót (14), az oxidatív károsodást (15) és a neuroinflammációt (16), ami a TBI utáni farmakológiai beavatkozás potenciális célpontjává teszi. Az ideggyulladás különösen érdekes a másodlagos sérüléseknél, mivel szerepet játszik a sérülés utáni neurodegeneratív betegségek kialakulásában (17, 18). Ahogy azt korábban áttekintettük, számos sejttípus járul hozzá a TBI utáni neuroinflammatorikus válaszhoz (19, 20), de a preklinikai és klinikai kutatások nagy része a központi idegrendszer (CNS) veleszületett immunsejtjének, a mikroglianak a szerepére összpontosított. A mikroglia által közvetített gyulladás számos tünettel jár együtt a TBI után, beleértve a motorhiányt (21), a hangulati rendellenességeket (22) és a neurodegenerációt (23). A Microglia potenciális terápiás célpontot nyújt a neuroinflammáció negatív hatásainak enyhítésére a TBI utáni másodlagos sérülés részeként.
Mikroglia által közvetített neuroinflammation, miután a TBI dinamikus
Reaktív mikroglia szükséges a törmelék megtisztításához és a szinapszisok modulálásához közvetlenül a TBI után, de amikor a krónikus reakcióképesség neurotoxikus lehet. Ennek oka az oxidatív stressz és a neurotoxikus citokinek, például a nitrogén-oxid (NO) fenntartása az indukálható nitrogén-oxid szintáz (iNOS) révén (33). Az NOX2, egy reaktív oxigénfaj (ROS), a kísérleti CCI után 1 és 2 nappal az egerekben magasan expresszálódik a kéregben, és együtt lokalizálódik morfológiailag reaktív mikrogliákkal (34). Egy másik kísérleti tanulmány azt találta, hogy a CCI a Nox2// - egerekben szignifikánsan csökkent CD68 jelölést, csökkent léziós területet és gyulladásos citokinek, köztük Il-1β, Il-6 és Tnfα gének expresszióját (35). Ez azt jelzi, hogy az NOX2 nemcsak a mikroglia reaktivitásának citotoxikus terméke, hanem más mikrogliákkal is kapcsolatba léphet a mikroglia által közvetített gyulladás fenntartása érdekében. A fatális TBI-es esetek humán boncolási mintáinak klinikai elemzése szintén a NOX2 expressziójának szignifikáns növekedését mutatja a kéreg egészében, összehasonlítva a kontrollokkal (36). Bár átmeneti mikroglia reaktivitásra van szükség a sérülésre adott megfelelő immunválaszhoz, a tartós gyulladás rosszul adaptív, és idegi degenerációhoz és sejtvesztéshez vezethet.
A TBI mikroglia alapozást indukál, amely hozzájárul a TBI utáni folyamatokhoz
A stressz glükokortikoidokon keresztül befolyásolja a gyulladást
A megváltozott GC felszabadulás befolyásolja a gyulladást
HPA tengely diszfunkció TBI után
A TBI után azonnal bekövetkezik a HPA tengely akut aktiválása a sérülés stressze miatt. Enyhe blasztos TBI egerekben megnöveli a keringő CORT-t közvetlenül a sérülést követően, amely a TBI után 3 órával tetőzik a kontrollokhoz képest, és a TBI után 5 órával visszatér az alapvonalra (88). Ugyanez a növekedés a HPA-tengely aktiválásában a klinikai populációkban is megfigyelhető, mivel az egyik tanulmány az enyhe és mérsékelt TBI-t követő első 1-2 napon azt mutatta, hogy a keringő CORT-szintek jelentősen növekednek az életkorhoz illeszkedő kontrollokhoz képest (89). Ugyanez a klinikai vizsgálat azt mutatja, hogy a súlyos TBI-t követően a kiindulási szérum CORT-szint 1-3 nappal a TBI-t követően csökken. Bár ez a stressz csökkenés a sérülést követően hosszú távon csökkentheti a gyulladásos reakciókat, az elnyomott HPA-tengely aktiváció a súlyosabb TBI után rosszabb eredményt eredményezhet.
A TBI utáni HPA tengelyelnyomás okai
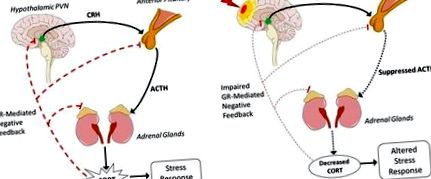
A TBI utáni HPA-rendellenességek legnagyobb előfordulási gyakorisága az agyalapi mirigy elülső rendellenességeinek következménye, amelynek következtében csökken az ACTH felszabadulás és ezáltal csökken a CORT (1B. Ábra). Az agyalapi mirigy különösen érzékeny a TBI-re és a sérülés okozta nyomásváltozásokra vagy vérzésre. A longitudinális klinikai vizsgálatok a TBI-betegek 41% -áról számolnak be rendellenesen magas reggeli CORT-szinttel a sérülés után 10 nappal (99). 3 hónapra 32% -uknál rendellenesen alacsony volt a reggeli CORT szint. Ez az incidencia viszonylag stabil marad a 6. és 12. hónapban, rendellenesen alacsony CORT-szinttel a betegek 37, illetve 35% -ában. Az agyalapi mirigy diszfunkciója csökkenti az ACTH felszabadulását, így a mellékvesék szintetizálnak és kevesebb GC-t termelnek. Erre a csökkenésre reagálva a negatív visszacsatolás érzékenységét növelik a kompenzáció érdekében. Mint ilyen, a fokozott gátlás tovább csökkentheti a GC felszabadulását és megváltozott reakciót okozhat a stresszorokra. A közvetlen, közvetett és visszacsatolás szabályozásának bonyolultsága miatt a HPA minden szintjén még nem ismert egyetlen olyan mechanizmus, amellyel az ACTH termelés csökken.
A TBI utáni mellékvese szövődményei viszonylag ritkák, mivel az első klinikai esettanulmányról 1997-ben számoltak be (100). A beteget a TBI után egy hónappal tartós gyengeség, fáradtság és émelygés miatt vették fel rehabilitációra, és csak azután, hogy a rehabilitáció során nem mutattak jelentős javulást, endokrin munkát végeztek, amely exogén ACTH alkalmazása után felfedte a GC elnyomott felszabadulását. A szintetikus GC-k, a prednizon és a fludrokortizon kezelésének megkezdésétől számított egy héten belül a szédülés és a letargia tünetei jelentősen javultak. Noha ritka, a mellékvesék elégtelenségének esetei a mellékvesék károsodásán keresztül diagnosztizálhatatlanok maradhatnak, mivel a tünetek csak a TBI-vel fordulnak elő jelentősen. Ezt a szövődményt gyakran tapasztalják a test többszörös traumáiban, amelyek a mellékvesék közvetlen sérüléséhez vezethetnek, és leggyakrabban nem tulajdoníthatók közvetlenül a TBI-nek, ezért általában társbetegségnek, nem pedig a TBI közvetlen tünetének nevezik.
A TBI utáni HPA tengely diszfunkció következményei
Jól jellemezték a HPA tengely TBI-t követő túlzott aktiválódását és a TBI utáni helyreállításra gyakorolt hatását (7, 101). Például a CORT szintek a középvonal FPI után érik el a csúcsot egerekben a sérülés után 30 perccel, és a robusztus HPA tengely aktiválódása továbbra is fennáll, mivel a CRH mRNS expressziója a sérülés után 2 órával 40% -kal növekszik az álkontrollokhoz képest (102). Ennek a fokozott HPA-aktivációnak a gátlása a CRH antagonistán keresztül a sérülés után 15 perccel, valamint 2, 4, 6 és 8 órával jelentősen, 45% -kal csökkenti az elváltozás mennyiségét (103). Ez azt mutatja, hogy a HPA tengely túlzottan aktiválódik, miután a TBI növeli az idegsejtek halálát, ami viszont befolyásolhatja a neuroinflammációt. Amint azt korábban leírtuk, a TBI miatti túlzott GC-k mikroklíma alapozást is indukálnak, és a stressz hatására fokozzák a gyulladásos citokinek szintjét, ami maladaptív és krónikus gyulladást eredményez.
Úgy tűnik, hogy a felnőttek életkora a sérülés idején nem befolyásolja a HPI tengely diszfunkcióval szembeni sérülékenységet a TBI után, mivel a legtöbb tanulmány szerint nincs összefüggés az életkorral (93). A gyermekkori TBI után azonban a 12 évesnél fiatalabb gyermekek hajlamosabbak a sérülés után a HPA diszfunkcióra, mint az idősebb serdülőknél (106). Valójában egy tanulmány megállapította, hogy az összes megkérdezett, enyhe vagy súlyos TBI-vel rendelkező gyermek jelentősen elnyomta a CORT-felszabadulást a HPA aktiválására adott válaszként inzulinvizsgálatokkal (107 A sérülés korai életkori stressz-expozícióként hat a gyermekkori TBI-ben, ami maladaptív HPA-tengely érését indukálhatja, és ezáltal tartósan növelheti a stressz iránti fogékonyságot az élet későbbi szakaszaiban (108). A HPA-tengely diszfunkciója miatt megváltozott stresszválaszokkal kombinálva a gyermekkori TBI jelentősen megváltoztathatja a normális öregedést, és hozzájárulhat a pszichiátriai következmények és az életminőség csökkenésének esélyéhez. Ezek az adatok a sérülésekkel öregedő egyének növekvő népességét jellemzik, akiknek nagyobb a kockázata a TBI-vel kapcsolatos fogyatékosság kialakulásának a sérülés kora és a megváltozott stresszválasz tartóssága miatt.
A kísérleti stressz modellek betekintést nyújtanak a TBI utáni HPA tengely diszfunkció, gyulladás és kimenetel kapcsolatába
Visszafogási stressz
Kényszerű gyakorlat
Kényszerített úszás
Láb sokk
A stressz modellek következésképpen befolyásolják az alvást
A fokozott stressz klinikailag és kísérletileg is bizonyítottan alvászavarokat vált ki, még akkor is, ha a stresszornak való kitettség megszűnik (129). A GC felszabadulásának összehangolása a HPA tengely aktiválásával és a környezeti jelzésekkel elengedhetetlen a normális alvásminőség és a hosszú élettartam megőrzéséhez. A differenciális HPA aktivitás közvetíti az alvás szakaszait. Az emberek átlagosan 7–8 órát alszanak éjszaka 6–8 órás alvási rohammal, és a nem REM alvás (azaz lassú hullámú alvás) és a REM alvás (azaz paradox alvás) körülbelül 6 ciklusát tapasztalják (130). Az egerek viszont 12–14 órán át alszanak a fényfázis alatt, csupán 2–4 perces alvási rohammal. Ezenkívül többfázisú alvásuk van, ami azt jelenti, hogy a nem REM és a REM alvás ciklusait periodikusan tapasztalják, közben ébrenléti időszakkal. Az alvási architektúra ezen különbségei ellenére a rágcsálók alvási modelljeinek jellemzői, például az alvás cirkadián és homeosztatikus modulációja hasonlóak az emberhez (131), és ezért gyakran használják a transzlációs kutatásokban.
Az alvászavar megromlik a TBI után
A preklinikai és klinikai traumakutatás jövőbeli lépései
Szerző közreműködései
ZT: írta a kéziratot. JG: szakértelmet nyújtott az ideggyulladásban és szerkesztette a kéziratot. OK-C: szakértelmet nyújtott a TBI-ben és szerkesztette a kéziratot.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- 10 olyan élelmiszer, amely a tudomány szerint valóban hozzájárul a hosszú távú egészséghez
- A Brendan Brazier növényi étrend növelheti az energiát, hozzájárulhat a HuffPost Life jólétéhez
- 4 étel az egészséges ízületek számára, amelyek csökkentik a gyulladást
- 4 legrosszabb étel, amely gyulladást okoz, nagyon egyszerű
- Szakértők szerint 10 módszer a bél gyulladásának megszabadítására