Az éhezést utánzó étrend időszakos beadása beavatkozik a cukorbetegség progressziójába, helyreállítja a β sejteket és rekonstruálja a bél mikrobiotáját egerekben
Siying Wei
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Ruomei Han
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Jingyu Zhao
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Shuo Wang
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Meiqin Huang
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Yining Wang
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Yan Chen
CAS Táplálkozási, Anyagcsere- és Élelmiszer-biztonsági Laboratórium, Sanghaji Táplálkozási és Egészségügyi Intézet, Sanghaji Biológiai Tudományok Intézete, Kínai Tudományos Akadémia, Kínai Tudományos Akadémia, 320 Yueyang Rd, Sanghaj, 200031 Kína
Társított adatok
A felhasznált adatok és anyagok kérésre rendelkezésre állnak.
Absztrakt
Elektronikus kiegészítő anyag
A cikk online verziója (10.1186/s12986-018-0318-3) kiegészítő anyagot tartalmaz, amely az engedélyezett felhasználók számára elérhető.
Bevezetés
Ebben a tanulmányban azt kívántuk megvizsgálni, hogy egy új típusú alacsony fehérjetartalmú alacsony szénhidráttartalmú FMD képes-e beavatkozni az egerek 2-es típusú cukorbetegségébe. Különösen azt kívántuk megvizsgálni, hogy ennek az FMD-nek a szakaszos beadása képes-e helyreállítani a db/db egerekben elveszett β-sejtek működését; és hogy a bél mikrobiota hozzájárulhat-e az FMD intervenciós hatásához.
Módszerek és anyagok
Egér modell
Az SLAC-tól (Sanghaj, Kína) vásárolt hathetes hím C57BL/ksJ-db (db/db) egereket kórokozótól mentes körülmények között tartottuk, és 12 órás világos/sötét ciklusban tartottuk a Táplálkozástudományi Intézetben. Az összes egeret megmértük a vizsgálat kezdetén, és véletlenszerűen két csoportba soroltuk: standard táplálékot és szabad hozzáférést az élelemhez és vízhez (CTRL), valamint szakaszos éhezést az FMD-vel (
A CTRL csoport napi kalóriabevitelének 30% -a) 1 hétig, majd további hétig ad libitum táplálás (FMD). Az 1-es típusú diabéteszes egér modell esetében alacsony dózisú sztreptozotocint (STZ) (40 mg/kg) injektáltak intraperitoneálisan öt egymást követő napon keresztül. Az egereket lemértük és éheztettük 8 órával az STZ injekció előtt. Az STZ-t nátrium-citrát pufferben (pH 4,5) oldottuk, és azonos térfogatú citrát puffert injektáltunk kontroll egerekbe. Ezeket a kísérleteket a Sanghaji Biológiai Tudományok Intézetének (SIBS), a Kínai Tudományos Akadémia (CAS) Táplálkozástudományi Intézetének Intézményi Állatgondozási és Felhasználási Bizottságának irányelveivel összhangban végezték el, jóváhagyási számuk 2010-AN-8.
Az étrendet utánzó egér böjt
A tanulmányban használt FMD-t (kínai nevén Gembynear Nutrition Bar vagy kínaiul Zhenbainian) a Pekingi Táplálkozási, Egészségügyi, Élelmiszertudományi és Technológiai Kutatóintézet (Peking, Kína) szívesen nyújtotta. A száj- és körömfájás összetételét és táplálkozási adatait az 1. kiegészítő fájl tartalmazza: S1 és S2 táblázat. Minden egeret reggel friss élelemmel láttak el (9: 00-10: 00). Az FMD egerek általában az első néhány órában elfogyasztották a szállított táplálékot.
Egerek székletminta gyűjtése
Valamennyi egeret egyedileg ketrecbe helyeztük. Minden egérből friss székletmintákat gyűjtöttünk 14:00 órakor.
15:00. a lehetséges cirkadián hatások minimalizálása érdekében. A mintákat jégen üres mikrocsövekbe gyűjtöttük, és a későbbi felhasználás céljából azonnal -80 ° C-on tároltuk.
A vércukorszint és az inzulin mérése
Az egereket 6 órán keresztül éheztettük (reggel 9:00.
15:00 óra) a vércukorszint mérése előtt. A vércukorszintet a farokvénán keresztül mértük a OneTouch UltraEasy vércukorszint-ellenőrző rendszerrel (Lifescan, Milpitas, CA, USA). A szérum inzulinszintet egér enzimhez kapcsolt immunszorbens vizsgálattal határozták meg (Shanghai Enzyme-linked Biotechnology Co., Shanghai, Kína). A szemgömbből teljes vért vettünk, és a plazmát 3000 fordulat/perc sebességű centrifugálással 15 percig elválasztottuk EDTA-K2-vel kezelt mikrocsövekben (Kangjian Medical, Kína). A homeosztatikus modell értékelést (HOMA) alkalmazták az inzulinrezisztencia (HOMA-IR) és a β sejtfunkció (% B) számszerűsítésére. A HOMA-IR-t a következő képlet segítségével számoltuk: HOMA-IR = (éhomi glükóz × éhomi inzulin)/22,5. A HOMA% B-t a következő képlet segítségével számoltuk ki: HOMA-% B = (20 × éhomi inzulin)/(éhomi glükóz - 3,5)%.
Glükóz tolerancia teszt (GTT) és inzulin tolerancia teszt (ITT)
Az egereket külön-külön ketrecben tartottuk, és 4 órán át éheztettük az ITT-t (reggeli koplalás), és egy éjszakán át éheztettük a GTT esetében. Glükózt (2 g/kg) vagy inzulint (2 egység/kg) intraperitoneálisan injektáltunk. A vércukorszintet minden injekció után 0, 15, 30, 60 és 90 percnél mértük.
A szérum és a máj paramétereinek mérése
Az egereket eutanizáltuk, és a vért a orbitális sinusból azonnal EDTA-K2-vel kezelt mikrocsövekbe vettük (Kangjian Medical, Kína). Ezután a mikrocsöveket 3000 fordulat/perc sebességgel 15 percig centrifugáltuk, és a plazma felülúszót 3 részre osztottuk különböző felhasználások céljából. Az összes plazmamintát, kivéve az azonnali felhasználásra szánt mintákat, -80 ° C-on tároltuk. A máj lipidjeit kloroform/metanol (2: 1) eleggyel extraháltuk. Az aszpartát-transzamináz (AST) és az alanin-transzamináz (ALT) plazmaszintjét AST/ALT meghatározó készlettel (ShenSuo UNF, Kína) határoztuk meg. A trigliceridek (TG) és az összkoleszterin (TC) plazma- és májszintjét kolorimetriás módszerekkel határoztuk meg a megfelelő készletekkel (ShenSuo UNF, Kína). Mindezeket a vizsgálatokat a gyártó utasításai szerint hajtották végre.
Immunfluoreszcencia elemzés
Az egérszöveteket 4% paraformaldehidben rögzítettük, dehidratáltuk és paraffinba ágyazottuk. A szöveteket vastag szeletekre (4 μm) osztottuk, paraffinmentesítettük xilolban, és etil-alkoholos sorozatokkal (100%, 90%, 70%, 50% és 30%) és vízzel rehidratáltuk. Az antigént hőkezeléssel nyertük fel 0,1 M citrátpufferrel (pH = 6,0), és a metszeteket blokkoló pufferrel (PBS + 1% normál kecskeszérum + 0,1% trixton-100) blokkoltuk. A következő elsődleges antitesteket használtuk: anti-inzulin (C27C9, Cell Signaling Technology, Boston, MA, USA), anti-glükagon (ab10988, Abcam, MA, USA), anti-Ngn3 (sc-374442, Santa Cruz Biotechnology, Dallas), Texas, USA) és anti-Ki67 (550609 a BD Biosciences-től, New Jersey USA). A metszeteket primer antitestekkel egy éjszakán át nedvesített kamrában inkubáltuk. PBS-sel végzett mosás után a metszeteket 1 órán át szobahőmérsékleten inkubáltuk szekunder antitestekkel (Alexa Fluor 488 szamár anti-nyúl IgG, Alexa Fluor 546 szamár anti-egér, hígítás 1/500). Az összes szekunder fluorokróm-konjugált antitestet a Life Technologies-től (Eugene, OR, USA) szereztük be. A festett metszetek képeit 40x-es objektív segítségével készítettük LSM 510 konfokális mikroszkóppal (Zeiss, Jena, Németország).
Májminták H&E festése
Az egérmájat boncoltuk és PBS-ben mostuk. Az összes szövetet 4% paraformaldehidben rögzítettük 48 órán át szobahőmérsékleten, dehidratáltuk és paraffinba ágyazottuk. Ezután a szöveteket vastag szeletekre (4 μm) osztottuk és hematoxilinnal és eozinnal (H&E) festettük.
RNS izolálás, RT-PCR és valós idejű PCR
Az egér májszöveteit TRIzol reagensben (Invitrogen, CA, USA) lizáltuk. A teljes RNS-t a gyártó utasításai szerint tisztítottuk, reverz átírással és szintetizáltuk komplementer DNS-re FastQuant RT Kit (gDNase-vel) (Tiangen Biotech Co., LTD, Peking, Kína) felhasználásával. A valós idejű PCR-t az ABI Prism 7900 szekvencia detektáló rendszerrel végeztük a gyártó ajánlásait követve (Applied Biosystems, CA, USA). A relatív mRNS-szinteket az összehasonlító ΔCT módszerrel számszerűsítettük, és az 1. kiegészítő fájlban leírt primerek szekvenciájával normalizáltuk aktinná: S4 táblázat.
A bél mikrobiotájának elemzése
Statisztikai analízis
Az összes adatot átlag ± SEM-ben fejeztük ki. A jelentős különbségeket vagy kétfarkú Student t-tesztekkel, vagy egyirányú ANOVA-val értékelték, majd adott esetben a Student-Newman-Keuls tesztet.
Eredmények
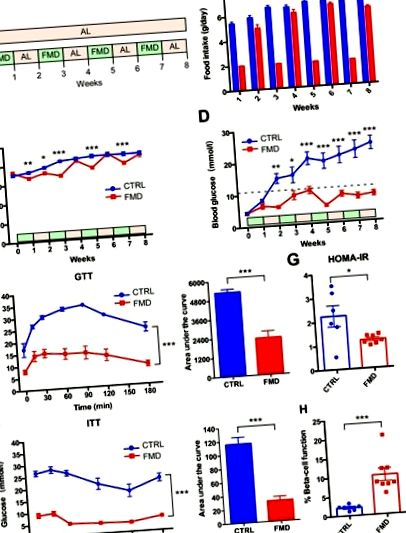
Az FMD szakaszos beadása a testtömeg jelentős változása nélkül beavatkozik a 2-es típusú cukorbetegség kórképébe db/db egerekben
A máj steatosisát javítja az FMD szakaszos adagolása
- Szakaszos böjt az 5 2 diétával - Diabetes Online
- Az időszakos böjt biztonságos a cukorbetegek számára A mindennapi egészség
- Szív-egészséges ételek, amelyeket bele kell foglalni a cukorbetegség étrendjébe A mindennapi egészség
- Növényi étrend és időszakos böjt alkalmazása fogyáshoz
- Az időszakos böjt jó annak, aki 2-es típusú cukorbetegségben szenved