Az étrendi rostok és metabolitok hatása a hízósejtek aktiválására és a hízósejtekkel kapcsolatos betegségekre
Jelle Folkerts
1 Tüdőgyógyászati Osztály, Erasmus MC, Rotterdam, Hollandia
2 Farmakológiai osztály, Gyógyszerésztudományi Tanszék, Természettudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
3 A Stanfordi Egyetem Orvostudományi Klinikája, Stanford, Kalifornia, Egyesült Államok
4 Bőrgyógyászati és Allergia Tanszék, Charité - Universitätsmedizin Berlin, Berlin, Németország
Ralph Stadhouders
1 Tüdőgyógyászati Osztály, Erasmus MC, Rotterdam, Hollandia
5 Sejtbiológiai Tanszék, Erasmus MC, Rotterdam, Hollandia
Frank A. Redegeld
2 Farmakológiai osztály, Gyógyszerésztudományi Tanszék, Természettudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
See-Ying Tam
3 Patológiai Osztály, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia, Egyesült Államok
Rudi W. Hendriks
1 Tüdőgyógyászati Osztály, Erasmus MC, Rotterdam, Hollandia
Stephen J. Galli
3 A Stanfordi Egyetem Orvostudományi Klinikája, Stanford, Kalifornia, Egyesült Államok
Marcus Maurer
4 Bőrgyógyászati és Allergia Tanszék, Charité - Universitätsmedizin Berlin, Berlin, Németország
Absztrakt
Számos hízósejtekkel összefüggő betegség, köztük az allergia és az asztma, az elmúlt évtizedekben erőteljesen megnövekedett, különösen a nyugati (ized) országokban. Felmerült, hogy a nyugati étrend hozzájárulhat az allergiák és az asztma előfordulásához és megnyilvánulásához az étkezési rostok csökkentett bevitelével és metabolitjaik későbbi termelésével. Az élelmi rostok és metabolitjai bizonyítottan pozitívan befolyásolják az immunrendellenességek kialakulását a mikrobiota összetételének megváltoztatása, valamint a B- és T-sejt aktiváció szabályozása révén. Ezeknek az étrendi összetevőknek a hízósejtek, az allergiában és az asztmában fellépő gyulladásos válasz kulcsfontosságú sejtjeinek aktiválódására gyakorolt hatása azonban továbbra sem ismert. A hízósejtek a bélben és a vaszkularizált szövetekben való elhelyezkedésük miatt nagy koncentrációban vannak étrendi rostoknak és/vagy metabolitjainak kitéve. Itt átfogó áttekintést nyújtunk az étrendi rost és különféle metabolitjai közvetlen hatásairól a hízósejtek aktivitásának szabályozására és a hízósejtekkel összefüggő betegségek patofiziológiájára vonatkozóan.
Bevezetés
Az étkezési rost nem emészthető szénhidrátokból áll, amelyeket növényi poliszacharidokból és növényi vagy emberi tejből származó oligoszacharidokból nyernek. Ellenállnak az enzimatikus és kémiai emésztésnek, amíg el nem jutnak a vastagbélig, ahol a bélbaktériumok rövid láncú zsírsavakká (SCFA) és más metabolitokká fermentálódnak (7). Az emlősöknek, beleértve az embereket is, hiányoznak a poliszacharidok és a rezisztens oligoszacharidok nagy részének lebontásához szükséges enzimek, amint azt a csíramentes egerekben az SCFA csökkent mennyisége mutatja, amelyeknél a bélben nincsenek baktériumok (8). A magas zsírtartalmú/alacsony rosttartalmú étrendet a Firmicutes/Bacteroidetes fajok arányának növekedése kíséri, amely különböző betegségtípusokkal, köztük az elhízással jár (9). Ezzel szemben a magas rosttartalmú étrend fokozott Bacteroidetes/Firmicutes arányhoz és megnövekedett SCFA-koncentrációkhoz vezet (10, 11). A bél mikrobiota potenciális szerepét az allergiás megbetegedésekben és az asztmában jól dokumentálták és alaposan áttekintették (12–14). Itt koncentrált áttekintést nyújtunk az étrendi rostok és metabolitjainak a hízósejt-aktivitás szabályozására és a hízósejtekkel társult betegségek patofiziológiájára gyakorolt közvetlen hatásairól.
Étrendi rost - forrása, anyagcseréje és biológiai hatása
A keményítővel és keményítőszerű poliszacharidokkal szemben, amelyek enzimatikus reakciók által könnyen hidrolizálhatók és felszívódnak a vékonybélben, az étkezési rostok csak a vastagbélben történt bakteriális fermentáció után emészthetők meg és nem szívódnak fel. Az élelmi rostok meghatározása és kategorizálása összetett és kihívást jelent, mivel táplálkozási, funkcionális és kémiai tulajdonságaik sokfélék. Az Amerikai Gabonakémikusok Szövetsége meghatározza az étkezési rostokat, mint „több mint három fokos polimerizációjú szénhidrátpolimereket, amelyek nem emészthetőek meg és nem szívódnak fel a vékonybélben” (15) (táblázat (1. táblázat). 1). Ez a meghatározás azonban nagyon sokféle rostot tartalmaz. Az (allergiás) gyulladás és az immunológia területén nem keményítő poliszacharidok (főleg zöldségekben, gyümölcsökben és gabonafélékben találhatók), oligoszacharidok (elsősorban növényekben, babban és emberi tejben találhatók), valamint specifikus analóg szénhidrátok, például rezisztens keményítő, a közelmúltban különös figyelmet kapott. Ezért ezen élelmi rost-összetevők és metabolitjainak hatására fogunk összpontosítani. A többi élelmi rost-komponens és metabolit szerepét az immunrendszerben másutt vizsgálták (16–18).
Asztal 1
Élelmi rostok alkotóelemei. a
| Cellulóz |
| Hemicellulóz |
| Arabinoxilánok |
| Arabinogalaktánok |
| Polifruktózok |
| Inulin |
| Oligofruktánok [frukto-oligoszacharidok (FOS)] |
| Galacto-oligoszacharidok (GOS) |
| Íny |
| Nyálkák |
| Pektinek |
| Analóg szénhidrátok |
| Emészthetetlen dextrinek |
| Rezisztens maltodextrinek (kukoricából és más forrásokból) |
| Rezisztens burgonya dextrinek |
| Szintetizált szénhidrátvegyületek |
| Polidextróz |
| Metil-cellulóz |
| Hidroxi-propil-metil-cellulóz |
| Emészthetetlen („ellenálló”) keményítők |
| A nem keményítő poliszacharid és lignin komplexhez kapcsolódó lignin anyagok a növényekben |
| Viaszok |
| Fitát |
| Bevágás |
| Szaponinok |
| Suberin |
| Tanninok |
diétás rostkomponensek, amelyeket az Amerikai Gabonakémikusok Szövetsége határoz meg. Elfogadva az „Étrendi rost meghatározása” részből (15).
A poliszacharidok és a rezisztens oligoszacharidok is erős szubsztrátok az SCFA-k előállításához. Az SCFA-król ismert, hogy biológiai hatásukat a GPR41, GPR43 és GPR103 (19–21) membránreceptorok, valamint a peroxiszóma-proliferátor-aktivált receptor (PPAR) nukleáris receptorcsalád aktiválásával fejtik ki (22). A PPAR-k transzkripciós faktorként funkcionálnak, miután a retinoid X receptorral heterodimer képződik, és szabályozzák az anyagcserében és az immunitásban egyaránt szerepet játszó gének expresszióját (23). Az SCFA-k képesek gátolni a hiszton-deacetiláz (HDAC) aktivitását (24–26), amelyről ismert, hogy szabályozza a génexpressziót, valamint a nem hiszton fehérjék acetilezését, ideértve a transzkripciós faktorokat is (27). Az acetát, a propionát és a butirát a legszélesebb körben leírt SCFA-k, és a bélrendszerben 60:20:20 moláris arányban találhatók (28). Fontos, hogy az SCFA-k nem korlátozódnak a bélrendszerre, hanem szisztémásan terjedhetnek és a vérben kimutathatók (29).
Az étrendi rost és metabolitjai hatása a hízósejtek működésére
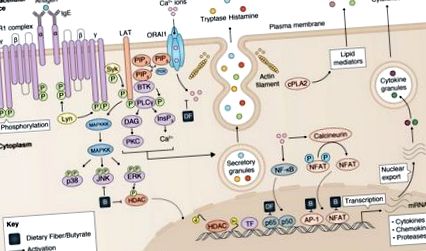
A hízósejtek aktiválódásának gátlása étkezési rostokkal és butiráttal. A hízósejtek aktiválását az étrendi rostok és a butirát modulálják (1) csökkent kalciumbejutással, (2) a JKN/p38 foszforiláció gátlásával, (3) csökkent hiszton-deacetiláz (HDAC) aktivitással és (4) a p65, AP- szabályozásával. 1, NFAT aktivitás. Részben Cildir et al. (40).
Bár az étkezési rostok hatásait alaposan megvizsgálták olyan betegségekben, amelyek a hízósejtek aktiválódásával járnak, kevés publikáció jelent meg arról, hogy ezek milyen hatással vannak a hízósejtek aktiválására és működésére. Egy nemrégiben készült tanulmány kimutatta, hogy az Angelica poliszacharid (AP), amely az Angelica gyógynövény fő rostforrása, dózisfüggő módon gátolhatja a hízósejt hisztamin felszabadulását, valamint a mediátor szintézist a csökkent Ca 2+ bejutás, a p38 foszforiláció, és NF-KB p65 expresszió (47). További tanulmányok alátámasztották ezeket az eredményeket, bizonyítva, hogy mind a poliszacharidok (48, 49), mind az oligoszacharidok (50) közvetlenül gátolhatják a hízósejtek degranulációját és a gyulladáscsökkentő citokin termelést in vitro.
Ezzel szemben a mikrobiális metabolitok, az SCFA-k hatását a hízósejtek működésére részletesebben tanulmányozták. Korai jelentésben Galli et al. kimutatta, hogy az MC/9 egér hízósejtek csökkent sejtproliferációt és megnövekedett hisztamin-tartalmat és citoplazmatikus granulátumokat mutattak ki, amikor in vitro butirátnak voltak kitéve (51). Nemrégiben Diakos és munkatársai (52) jelentették elsőként, hogy a butirát gátolhatja a hízósejtek degranulációját és a TNF-termelést. A butirát beadása jelentősen gátolta a JNK foszforilációját, de az Erk1/2 és a p38 nem, ezáltal potenciálisan szabályozva a hízósejtek aktiválódását és a TNF termelését. Az IgE-függő hízósejt-stimulációt követő TNF-termelésről ismert, hogy a génátírás szintjén erősen szabályozott (53, 54). Ezért a szerzők értékelték a különböző transzkripciós faktorok kötődését a TNF promoter régióban, és megállapították, hogy a butirát jelentősen gátolta az AP-1 és az NF-AT nukleáris kötődését.
A butirát hatását a hízósejtek degranulációjára Wang et al. (55), aki kimutatta, hogy a nátrium-butirát előkezelés csökkentette a degranulált hízósejtek százalékos arányát, csökkentette a hízósejt-mediátor tartalmat és csökkentette a gyulladásgátló citokinek mRNS-expresszióját az elválasztott sertésekből izolált jejunális nyálkahártya-készítményekben. Egy korábbi jelentéssel (52) összhangban ez a tanulmány azt is megállapította, hogy a butirát befolyásolta a MAPK jelátviteli utat azáltal, hogy gátolta a JNK, de az Erk1/2 és p38 foszforilációját.
Összefoglalva, az in vitro vizsgálatok azt sugallják, hogy mind az étkezési rostok, mind annak metabolitjai a hízósejtekkel kapcsolatos betegségeket szabályozhatják a hízósejtek aktiválására és degranulációjára gyakorolt fő gátló hatásuk révén (1. ábra). Néhány publikált tanulmány korlátozott adatai azt sugallják, hogy ezek a hatások némelyikét a MAPK jelátviteli út gátlásán és a csökkent TF aktivitáson keresztül közvetítik, amelyekről ismert, hogy modulálják a hízósejtek működését. A butirát gátolja a hízósejt-aktiválódás mechanizmusainak további részletes vizsgálatát fontos hivatkozási alapnak az étkezési rostok és metabolitok hízósejtekkel kapcsolatos betegségekre gyakorolt hatásainak vizsgálatára vonatkozó eredmények értelmezésében.
Étrendi rost kölcsönhatások a gasztrointesztinális hízósejtekkel
A GI az elsődleges szerv, amely kölcsönhatásba lép az élelmi rostokkal. Bár az étkezési rostok definíció szerint nem fermentálhatók a vastagbélbe való belépés előtt, a széklet viszkozitásának szabályozásával és a széklet tömegének növelésével egészségügyi előnyöket gyakorolnak a GI traktusban. Az ételallergiában szenvedő betegek számára előnyös lehet a vékonybél magas rostkoncentrációja is, mivel a pektinben gazdag gyümölcsök akadályozzák az allergén emésztést a pepszin által in vivo és in vitro, így szabályozzák az atópiás egyének allergiás szenzibilizációját (64). Az étrendi rostok (GI) egészségére gyakorolt jótékony hatásának nagy része azonban a vastagbélből származó mikrobiális metabolitokból származik.
A GI traktusban jelentős mennyiségű hízósejt van stratégiailag elhelyezve a nyálkahártyában és a submucosában (65). Ezért a GI-betegségek, például az ételallergia mediátoraként betöltött szerepüket jól dokumentálták, és javasolták, hogy hozzájáruljanak a vastagbélgyulladás és a Crohn-kór bizonyos formáinak patológiájához (66–68). A bél hízósejtjei ugyanis erősen szabályozhatják a véráramlást, a simaizmok összehúzódását, a GI-gát funkciót, valamint az (allergiás) gyulladás megindítását (69). Ezenkívül a nyálkahártya típusú hízósejtek (egy triptáz-pozitív, kimáz-negatív altípus) száma megnövekedhet bizonyos típusú (allergiás) GI-gyulladásokban, míg a kötőszöveti típusú hízósejtek (egy triptáz/kimáz kettős pozitív hízósejt-altípus) száma stabilabb (65, 70, 71.). A hízósejtek a bélben való elhelyezkedésük miatt az élelmi rostok és metabolitjainak nagy koncentrációja alatt vannak. Érdekes módon a magas rosttartalmú étrend ezen hízósejtekkel kapcsolatos betegségekre gyakorolt hatását jól dokumentálták, és ígéretes jövőbeni beavatkozási lehetőséget kínálnak (72, 73). Ezenkívül az étkezési rostok és metabolitjainak egyes közvetlen hatásait a bél hízósejtjeinek aktiválódására jelentették ezekben a betegségekben, az alábbiakban leírtak szerint.
Ételallergia
Számos legújabb tanulmány betekintést nyújtott az élelmi rostok és metabolitok hatásmechanizmusába allergiás egerekben és emberekben. Tan és mtsai. (79) beszámolt arról, hogy a magas rosttartalmú étrend (guargumival és cellulózzal dúsítva) megvédte az egereket a mogyoróallergiától a megváltozott bélmikrobiota és SCFA-termelés révén. A magas rosttartalmú étrenddel etetett egerekben csökkent az anafilaxia és az IgE koncentráció. Arról azonban nem számoltak be, hogy ez csökkent hízósejt-aktiválódást eredményezett-e. Érdekes módon hasonló eredményeket értünk el, ha acetátot vagy butirátot, de propionátot nem adtunk az ivóvízhez 3 hétig az allergén szenzibilizáció előtt. Ezek a megállapítások azt sugallják, hogy a magas rosttartalmú étrendek jelentős immunszabályozó hatásokat fejthetnek ki az SCFA termelése során. Kivit és munkatársai (80) hasonló vizsgálatában az egereket prebiotikus rövid láncú galakto- és FOS-szal (scGOS/lcFOS, amelyek hasonlítanak az emberi tej nem emészthető oligoszacharidokra) tápláltak, és orálisan szenzibilizálták a tejsavóra, egy közönséges élelmiszer-allergénre. Ezeknek az egereknek csökkentek az allergénre adott akut túlérzékenységi válaszok, a fül duzzadásával mérve, valamint a szérum nyálkahártya hízósejt-proteáz-1 (mMCP-1) szintjei, mindkettő markere a hízósejtek degranulációjának.
Az ilyen vizsgálatokban azonban az étrendeket általában hetekig tartják az allergén szenzibilizáció előtt. Az allergiás gyulladásra gyakorolt hatásuk ezért gyakran a szenzibilizációra és az allergia kialakulására gyakorolt jótékony immunszabályozó hatásoknak tulajdonítható, nem pedig a kialakult allergiás betegségek gyulladásos válaszának. Mindazonáltal Kivit és munkatársai (80) kimutatták, hogy az scGOS/lcFOS-diéták szabályozták a tejsavóra allergiás egerek galaktin-9 szintjét. A galaktin-9 a hízósejtek degranulációjának hatékony gátlója az IgE – antigén komplex képződés gátlásán keresztül (81), és a galaktin-9 magas szérumszintje állítólag az allergiás gyulladás és a hízósejtek in vivo degranulációjának csökkenésével függ össze (80).
Az élelmi rost anyagcseretermékei indokoltan jelentős figyelmet kaptak az étkezési rostok egészségügyi előnyeinek lehetséges magyarázatai felkutatása során. Az étrendi rostok közvetett hatásain túl (azaz a vastagbélben történő erjedés után, beleértve a galaktin-9 és az SCFA termelésének szabályozását is) a rostoknak közvetlen (azaz a mikrobiális fermentáció előtt) immunszabályozó hatása lehet az élelmiszerallergiára és a hízósejtekre. aktiválás. Ezért az étkezési rostok allergiák és más hízósejtekkel kapcsolatos betegségek megjelenésére és megnyilvánulására gyakorolt hatásait vizsgáló tanulmányoknak figyelembe kell venniük, hogy az étkezési rostok közvetlenül befolyásolhatják az immunválaszokat, ezáltal szabályozva a hízósejt-aktivációt köztes tényezők nélkül.
Gyulladásos bélbetegség
Mindazonáltal a hízósejtek közvetlen aktivátorai az IBD-ben nincsenek pontosan meghatározva, jelenleg nincs bizonyíték arra, hogy az IgE-függő hízósejt aktiválódását érintenék. Az IBD-ben a gyulladás ismert tényezője, a pszichés stressz azonban szignifikánsan magasabb hízósejt-degranulációt okozott az IBD-ben szenvedő betegeknél (92). Valójában a kortikotropin-felszabadító faktor, a stressz hatására ismert felszabaduló hormon, a TNF és proteázok hízósejtfüggő felszabadulása révén fokozott bélparacelluláris permeabilitás és bélgyulladás (93). Végül a hízósejtek súlyosbíthatják az IBD tüneteit az Ig-mentes L-lánc (Ig-fLC) aktiválását követően. Az Ig-fLC-kről beszámoltak arról, hogy a hízósejtek nagy affinitású receptoraihoz kötődnek, hogy a második allergén találkozás és azonnali allergiás válasz után degranulációt indukáljanak (94). Érdekes, hogy az IBD hízósejtfüggő modelljében az egereket Ig-fLC-vel szenzibilizálták, majd rektális hapten-provokáció követte őket, majd nyálkahártya-hízósejt-aktiválódást és fokozott vaszkuláris permeabilitást mutattak (95). Az IBD-ben szenvedő betegeknél erősen megnövekedett Ig-fLC koncentráció van a szérumban, valamint a vastagbél és az ileum szövetekben, ami arra utal, hogy a hízósejtek szerepet játszhatnak az IBD-ben az Ig-fLC szenzibilizáció révén.
A gyulladás lokalizációja miatt az új terápiák az élelmi rostok és metabolitok használatára összpontosítanak az IBD tüneteinek kezelésére (96) vagy megelőzésére (72), beleértve a hízósejtek aktiválását vagy toborzását. Van Hung és mtsai. (100) nemrégiben kimutatta, hogy a fermentálható élelmi rost (guargumi) csökkentheti a gyulladást a kolitikus egerekben, valószínűleg a széklet SCFA-koncentrációjának jelentett növekedése révén. A magas rostbevitel és a metabolittermelés fordítottan korrelált a bélsorompó funkció elvesztésével. A gyulladáscsökkentő citokinek, például a TNF, az IL-6 és az IL-17A expresszióját a magas rosttartalmú étrend miatt nem szabályozták, bár e citokinek specifikus forrását nem említették. Hasonló vizsgálatok, amelyek az élelmi rostok gyulladáscsökkentő képességét vizsgálják a vastagbélgyulladásos modellekben, arról számoltak be, hogy az étkezési rostok UC-ben kifejtett jótékony hatása nem függ a fajtól (101) vagy a modelltől (102), sem az élelmi rost típusától (91).
2. táblázat
Élelmi rostok és metabolitjai hízósejtekkel kapcsolatos betegségek esetén.
- A hőkezelt árpa étkezési rostok hatása a hiperkoleszterinémia ellen - Bader Ul Ain - 2020
- A folyamat hatása a zabkorpa oldható étkezési rost fizikai-kémiai tulajdonságaira - Zhang - 2009 -
- Diétás hatású rost, szemcsehossz és válogatás; DAIReXNET
- Diétás beavatkozások gyomor-bélrendszeri betegségekben - 1. kiadás
- Az étrendi rost-, gyümölcs- és zöldségfogyasztás csökkenti a nőkben előforduló vesekövek kockázatát