Az extra szűz olívaolaj-polifenolok elősegítik a koleszterin kiáramlását és javítják a HDL működését
Hicham Berrougui
1 Orvostudományi Tanszék, Geriatriás Szolgálat, Orvostudományi és Biológiai Tudományok Kar, Sherbrooke Egyetem, 3001 12e Avenue Nord, Sherbrooke, QC, Kanada J1H 5N4
2 Biológiai Tanszék, Polidiszciplináris Kar, Moulay Slimane szultán egyetem, BP 592, 23000 Beni Mellal, Marokkó
Souad Ikhlef
1 Orvostudományi Tanszék, Geriatriás Szolgálat, Orvostudományi és Biológiai Tudományok Kar, Sherbrooke Egyetem, 3001 12e Avenue Nord, Sherbrooke, QC, Kanada J1H 5N4
Abdelouahed Khalil
1 Orvostudományi Tanszék, Geriatriás Szolgálat, Orvostudományi és Biológiai Tudományok Kar, Sherbrooke Egyetem, 3001 12e Avenue Nord, Sherbrooke, QC, Kanada J1H 5N4
Absztrakt
Jelen munka eredményei bizonyítják, hogy az extra szűz olívaolaj (EVOO) fogyasztásának jótékony szerepe van az oxidatív stressz és a szív- és érrendszeri betegségek szempontjából. Az EVOO-ban található polifenolok felelősek a lipoproteinek oxidatív károsodásainak gátlásáért és az ABCA1 útvonalon keresztül elősegítik a reverz koleszterin transzport folyamatát.
1. Bemutatkozás
A szívkoszorúér-betegség (CHD) a halálozás fő oka a nyugati világban. Az alacsony sűrűségű lipoproteinek (LDL) oxidációja az érelmeszesedés kialakulásának korai eseménye, a CHD kiváltó oka [1]. Az oxidált LDL-t az LDL-receptor Apo (B/E) nem ismeri fel, de a makrofágok nem szabályozott módon veszik fel őket a scavenger-receptor útvonalon keresztül, ami habsejtek kialakulásához vezet, ami az arterioszklerotikus elváltozások jellemzője [1].
A makrofág-specifikus reverz koleszterin transzport (RCT) az egyik legfontosabb HDL-mediált kardioprotektív mechanizmus. Az RCT az a folyamat, amelynek során a perifériás sejtekben lévő koleszterin kiáramlik a keringő HDL-be, és visszavezetésre kerül a májba az epében és a székletben való kiválasztódás céljából [2, 3]. Az RCT promócióját a HDL egyik fő antiaterogén funkciójának tekintik [4, 5]. A koleszterin sejtekből történő kiáramlása a HDL-be az RCT első és sebességkorlátozó lépése [6]. Két fő makrofág koleszterin efflux útvonalat írtak le: SR-BI receptor által közvetített koleszterin efflux és ABCA1/ABCG1 által közvetített koleszterin efflux. Az ABCA1 elősegíti a foszfolipidek és a koleszterin kiáramlását lipidszegény apo-AI-ba egy olyan folyamat révén, amely magában foglalja az apo-AI közvetlen kötődését az ABCA1 transzporterhez, míg az ABCG1 és az SR-BI kulcsfontosságú közvetítője a makrofág koleszterin kiáramlásának az érett HDL-hez [7 ]. Egy nemrégiben készült bizonyíték azt mutatja, hogy a gyulladásos folyamat olyan változásokat indukál a HDL összetételében és anyagcseréjében, amelyek károsítják az RCT-t [8]. Érdekes módon nemrégiben megmutattuk, hogy az RCT az öregedéssel is károsodik, különösen az ABCA1 által közvetített koleszterin efflux útvonal változásai miatt [9, 10].
Úgy tűnik, hogy a polifenolok jótékony hatásait rengeteg biokémiai út és jelátviteli mechanizmus közvetíti, amelyek függetlenül vagy szinergikusan hatnak. Jelen tanulmányban az EVOO-ban található fenolos vegyületek ateroprotektív hatását vizsgáltuk egészséges egyének koleszterin-kiáramlására és oxidatív stressz károsítására.
2. Módszerek
2.1. Tárgyak
Huszonnégy egészséges önkéntest (30,92 ± 2,55 év) normál szérum lipidprofillal és vérnyomással vettek fel. Mind nemdohányzók voltak, és nem szedtek semmilyen gyógyszert, beleértve a lipidszint-csökkentő kezeléseket vagy az orális antioxidánsokat. Egyik női alany sem esett át menopauza miatt ösztrogénpótló kezelésen. A résztvevők egyike sem mutatott gyulladás, elhízás vagy cukorbetegség klinikai tüneteit. A résztvevők fizikai és biokémiai paramétereit az 1. táblázat mutatja be. A Sherbrooke Geriatric University Institute Etikai Bizottsága jóváhagyta a vizsgálatot, és minden alany írásos tájékoztatáson alapuló beleegyezést nyújtott be, mielőtt felvételizett volna.
Asztal 1
A résztvevők klinikai és biokémiai paraméterei.
| n = 24 (tömeg/m) | 14/10 |
| Életkor (átlag ± SD év) | 30,92 ± 2,55 |
| Testtömeg-index (kg/m 2) | 23,7 ± 1,65 |
| Rendszeri vérnyomás (Hgmm) | 127 ± 4,65 |
| Dias. vérnyomás (Hgmm) | 78,23 ± 2,09 |
| Összes koleszterin (mmol/l) | 5,06 ± 0,2 |
| Trigliceridek (mmol/L) | 1,32 ± 0,15 |
| HDL-c (mmol/L) | 1,42 ± 0,09 |
| LDL-c (mmol/L) | 3,05 ± 0,15 |
| Apo A1 (g/L) | 1,56 ± 0,05 |
| Apo B (g/l) | 0,90 ± 0,04 |
| Apo B/Apo A1 | 0,8 ± 0,04 |
| TC/HDL-c | 3,81 ± 0,23 |
| LDL-c/HDL-c | 2,5 ± 0,2 |
| TG/HDL-c | 1,08 ± 0,17 |
| Glükóz (mmol/L) | 4,43 ± 0,10 |
| Inzulin (pmol/L) | 38,32 ± 5,26 |
| CRP (mg/l) | 3,16 ± 0,13 |
TC (összkoleszterin); HDL-C (HDL-koleszterin); LDL-C (LDL-koleszterin); CRP (C-reaktív fehérje).
2.2. Fitokémia
A fenolos vegyületeket az EVOO-ból extraháltuk Pirisi és munkatársai módszerével. [20]. Röviden: az EVOO-t n-hexánnal és metanol/víz elegyével keverjük, majd örvényberendezésben éjszakán át 4 ° C-on keverjük. Az elegyet ezután centrifugáljuk, és a hidroalkoholos oldatot n-hexánnal mossuk, majd egy éjszakán át liofilizáljuk.
2.3. Lipoprotein izolálás
Az éhező emberi plazmát heparin csövekbe gyűjtöttük, és a HDL-t azonnal izoláltuk Sattler és munkatársai módszerével. [21]. Az izolált lipoproteineket egy éjszakán át 4 ° C-on 10-2 M nátrium-foszfát-pufferrel (pH 7,0) szemben dializáltuk. A fehérjekoncentrációkat kereskedelmi vizsgálati készletekkel (Bio-Rad, Kanada) mértük a gyártási protokoll alkalmazásával.
2.4. Lipoprotein dúsítás EVOO-val és EVOO-PC-vel
Az emberi plazmát egy éjszakán át enyhe keverés mellett inkubáltuk 4 ° C-on EVOO (0,2 mg/ml plazma) vagy EVOO-PC (1,76 mg/ml plazma) jelenlétében. Ezután az LDL-t és a HDL-t a fent leírtak szerint izoláltuk.
2.5. Réz által közvetített lipoprotein oxidáció
A lipoproteinek peroxidálása a korábbiakban leírtak szerint történt, átmenetifém-ionokat használva oxidálószerként [22]. Röviden, a kontroll, az EVOO és az EVOO-PC-vel dúsított lipoproteineket [(LDL 100 μg/ml) vagy (HDL 200 μg/ml)] 10 mM nátrium-foszfát pufferben (pH 7) szuszpendáltuk, és 0-4 órán át inkubáltuk. 37 ° C-on 10 μM réz-szulfát jelenlétében. Az oxidációs reakciót EDTA hozzáadásával leállítottuk. A lipid-peroxid képződését a konjugált dién képződésének 234 nm-en történő monitorozásával értékeltük.
2.6. Sejtkultúrák
Humán THP-1 monocitákat és J774 makrofágokat tenyésztettünk RPMI 1640, illetve DMEM táptalajban. A táptalajt 10% hő-inaktivált FBS-sel, 50 mM 2-p-merkaptoetanollal (csak a THP-1 esetében), 2 mM L-glutaminnal, 5 mg/ml glükózzal és 100 E/ml penicillinnel egészítettük ki. A THP-1 monociták makrofágokká történő differenciálódását úgy indukáltuk, hogy a monocitákat 100 μM PMA jelenlétében 96 órán át tenyésztettük.
2.7. A koleszterin kiáramlásának mérése
A THP-1 eredetű makrofágokat és a J774 makrofágokat friss tenyésztő táptalajban inkubáltuk, amely 0,2 μCi/ml [3H] -koleszterint tartalmaz 48 órán át, vagy 1 μCi/ml [3H] -koleszterint 24 órán át. A betöltött sejteket mostuk, 1 órán át 1% BSA-t tartalmazó szérummentes táptalajban 12 órán át egyensúlyoztuk, újból mostuk és különféle kezeléseknek vetettük alá. A THP-1-ből származó makrofágokat 24 órán át inkubáltuk (1) HDL-mentes táptalajjal, (2) HDL (50 μg/ml), (3) EVOO-val dúsított HDL (OO-HDL) vagy (4) EVOO-val. -PC-vel dúsított HDL (PC-HDL).
A [3H] -koleszterinnel töltött THP-1-eredetű makrofágokat oxidatív stressznek tettük ki, amikor 0,2 mM vas/aszkorbáttal (Fe/Asc) inkubáltuk őket EVOO-PC (320 μg/ml) hiányában vagy jelenlétében 6 órán át. . Ezután 24 órán át HDL-vel inkubáltuk őket, hogy meghatározzuk a koleszterin kiáramlását különböző körülmények között.
Az EVOO-PC hatását az ABCA1 által közvetített koleszterin effluxra J774 makrofágok alkalmazásával értékeltük. A [3H] -koleszterinnel töltött J774 makrofágokat 12 órán át 0-320 μg/ml EVOO-PC-vel inkubáltuk, hogy ABCA1-dúsított sejteket hozzunk létre, vagy 300 μM 8-Br-cAMP-vel (pozitív kontroll), hogy stimuláljuk az ABCA1 gén transzkripcióját. és a felületi fehérje expressziója. A J7774 makrofágokat ezután 25 μg/ml apo-AI-vel inkubáltuk 4 órán át.
Az EVOO-PC által közvetített koleszterin efflux mechanizmusának jobb megértése érdekében tanulmányoztuk az EVOO két fő fenolos vegyületének (tirozol és hidroxi-tirozol) az ABCA1 által közvetített koleszterin effluxra gyakorolt hatását. A [3H] -koleszterinnel töltött J774 makrofágokat 12 órán át 0-25 μM tirozollal vagy hidroxi-tirozollal inkubáltuk, hogy ABCA1-dúsított sejteket hozzunk létre, majd 25 μg/ml apo-AI-vel inkubáltuk 4 órán át. 8-Br-cAMP-t használtunk pozitív kontrollként.
A koleszterin kiáramlását folyadék szcintillációs számlálással határoztuk meg, és a felszabadult radioaktívan megjelölt koleszterin százalékát (a koleszterin efflux százalékát) a következő képlet segítségével számítottuk: (cpm a táptalajban/[cpm a sejtekben + táptalaj]) × 100.
2.8. Western Blot elemzések
Az ABCA1 fehérje expresszióját J774 makrofágokban 12 órán át 0-320 mg/ml EVOO-PC-vel vagy 5 vagy 10 μM hidroxi-tirozollal vagy tirozollal inkubálva tanulmányoztuk. A fehérjéket (20 μg) elektroforézissel elválasztottuk 10% -os akrilamid géleken, és polivinilidén-difluorid (PVDF) membránokra vittük át. A membránokat 5% tejjel blokkoltuk PBS/Tween 20-ban, és primer antitestekkel (anti-ABCA1), majd specifikus IgG-HRP-konjugált szekunder antitestekkel inkubáltuk. Kontrollként β-aktint használtunk. A fehérjeszalagokat fokozott kemilumineszcencia reagenssel (ECL) detektáltuk [10].
2.9. Statisztikai analízis
Az értékeket átlag ± SEM-ben fejezzük ki. A többszörös összehasonlításhoz egyirányú varianciaanalízist (ANOVA) alkalmaztunk. Lineáris regressziós analízist alkalmaztunk két összefüggő változó közötti összefüggés értékelésére. Az összes statisztikai elemzést GraphPad Prism-5 szoftverrel végeztük.
3. Eredmények
3.1. Extra szűz olívaolaj és az EVOO fenolos vegyület kivonatok hatása a lipoprotein oxidációra
Az összes fenolos vegyület (41,9 mM; galluszsav ekvivalens) koncentrációját Folin-Ciocalteu módszerrel becsültük.
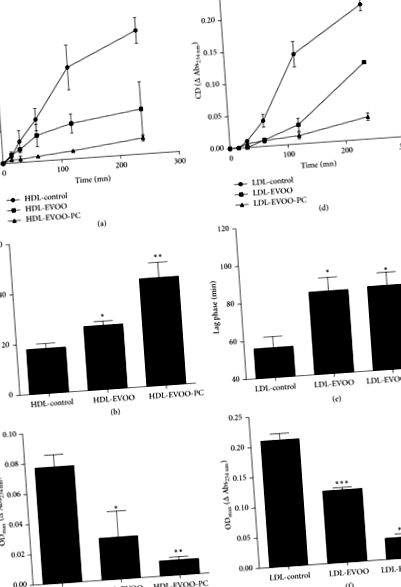
A többszörösen telítetlen zsírsavak (PUFA) HDL-ben és LDL-ben való peroxidációját konjugált diének képződésével értékeltük. A peroxidációs kinetika azt mutatta, hogy az LDL lagfázisa hosszabb volt, mint a HDL. A késleltetési fázist követte a terjedési és a befejezési fázis.
Ezen eredmények tükrében megvizsgáltuk az EVOO-PC-ben lévő két fő fenolos vegyület (tisztított tirozol és hidroxi-tirozol) hatását a J774 makrofágok koleszterin effluxjára és az ABCA1 fehérje expressziójára. Eredményeink azt mutatták, hogy a tirozol és a hidroxi-tirozol koncentrációtól függően megnöveli az ABCA1-függő koleszterin kiáramlását (4. (a) és 4. (b) ábra, ill.).
A tirozol és a hidroxi-tirozol fokozza az ABCA1 fehérje expresszióját és fokozza az apoA-I által közvetített koleszterin kiáramlást. A [3H] -koleszterinnel töltött J774 makrofágokat 12 órán át inkubáltuk különböző koncentrációjú (0-25 μM) tirozollal (a) vagy hidroxi-tirozollal (b), hogy ABCA1-dúsított sejteket állítsunk elő, amelyeket 25 μg/ml-rel inkubáltunk. apo-AI-t 4 órán át. Az eredményeket legalább három független kísérlet átlagának ± SEM-nek fejezzük ki.
4. Megbeszélés
Az olívaolaj a fő zsírforrás a mediterrán étrendben. Számos ismeret bizonyította a mediterrán étrend és az olívaolaj-fogyasztás előnyeit az érelmeszesedés és a CHD megelőzésében [24–27]. Számos tanulmány arról számolt be, hogy az olívaolaj antiaterogén hatása összefügg a különféle összetevők, különösen az egyszeresen telítetlen zsírsavak (MUFA) és a polifenolok által kifejtett antioxidáns és gyulladáscsökkentő hatásokkal [11, 17, 28–30]. A fenolos vegyületek, különösen a hidroxi-tirozol és az oleuropein, dózisfüggően gátolják az LDL és HDL oxidációját in vitro és in vivo, elnyomják a szuperoxid-vezérelt reakciókat, és megtörik a lipid-peroxidok láncszerű terjedését [31–34]. Érdekes módon Kovász és munkatársai tanulmánya. [17] kimutatta, hogy az EVOO fogyasztása növeli a fenolos vegyületek étkezés utáni koncentrációját a plazmában, valamint az LDL és HDL-ben, ami megmagyarázhatja a fenolos vegyületek védőhatását.
A plazma HDL-koleszterinszintje markánsan és fordítottan korrelál az érelmeszesedéses kardiovaszkuláris betegségek kockázatával [35]. Feltételezték, hogy a HDL megkönnyíti a koleszterin kiáramlását a perifériás szövetekből, és az RCT nevű folyamatban visszahozza a májba [36]. Az ABCA1 megkönnyíti a sejtek koleszterin kiáramlását a lipidszegény apo-AI-ig, de a HDL-ig nem [7, 37], míg egy másik ABC transzporter, az ABCG1, valamint az SR-BI receptor részt vesz a makrofágokból a HDL koleszterin kiáramlásába [38, 39]. Egyes tanulmányok szerint az élelmiszer-tápanyagok és az étrend kulcsfontosságú szerepet játszhatnak az RCT szabályozásában [25, 40–42]. Korábban kimutattuk, hogy az EVOO fogyasztása javítja az RCT folyamatot azáltal, hogy fokozza a HDL koleszterin kiáramlását közvetítő képességét, és az emberi monocita eredetű makrofágok (HMDM) a szabad koleszterin kiválasztását [43]. Jelen tanulmányban azt vizsgáltuk, hogy az EVOO fogyasztása miként elősegítheti a koleszterin kiáramlását. Összpontosítottunk az EVOO-PC hatására, különösen az esszenciális fenolokra, mint a tirozol és a hidroxi-tirozol.
Kevéssé ismert azonban a molekuláris mechanizmus, amely révén a fenolos vegyületek elősegítik a koleszterin kiáramlását. Annak érdekében, hogy jobban megértsük azt a mechanizmust, amellyel az EVOO-PC fokozza a HDL által közvetített koleszterin kiáramlást, megvizsgáltuk az EVOO-PC sejtjelzési utakra gyakorolt hatását. Eredményeink egyértelműen azt mutatták, hogy az EVOO-PC, beleértve a tirozolt és a hidroxi-tirozolt, stimulálja az ABCA1 fehérje expresszióját a J774 makrofágokban, ami megmagyarázhatja, hogy ezek a fenolok hogyan segítik elő a koleszterin kiáramlását az apoA-1-re. Uto-Kondo és mtsai. [40] beszámolt arról, hogy az egészséges emberek kávéfogyasztása fokozza a HDL által közvetített koleszterin kiáramlást az ABCG1 és az SR-BI növelésével, de az ABCA1 expresszióval nem, és ennek oka lehet a kávéban található fenolsavak. Ez valószínűtlennek tűnik, tekintve, hogy a fenolsavak aktiválják a máj X receptor-α (LXRα) expresszióját, ami viszont mind az ABCA1, mind az ABCG1 transzaktiválja. Más kutatások azonban, köztük a miénk is, kimutatták, hogy a resveratrol stimulálja az LXRα-t, az ABCA1-et és az ABCG1-et [52, 53]. Úgy tűnik tehát, hogy a különböző fenolos vegyületek különböző mechanizmusok révén stimulálhatják a koleszterin kiáramlását.
Összefoglalva, eredményeink azt mutatták, hogy az EVOO-PC fokozza a HDL antiaterogén tulajdonságait azáltal, hogy csökkenti a HDL oxidatív módosulásait és fenntartja a HDL fizikai-kémiai tulajdonságait, amelyek viszont javítják a HDL funkcionalitását, különösen a koleszterin kiáramlásának elősegítő képességét. Az EVOO-PC emellett megvédte a sejteket az oxidatív károsodásoktól és stimulálta az ABCA1 fehérje expresszióját, amely kulcsfontosságú tényező a koleszterin kiáramlásában és a HDL genezisében. Eredményeink összhangban vannak korábbi eredményeinkkel, amelyek azt mutatják, hogy az olívaolaj-polifenolok fogyasztása csökkenti a szív- és érrendszeri kockázatokat.
Elismerés
Jelen tanulmányt a kanadai Egészségügyi Kutatóintézetek támogatásai támogatták (MOP-89912 és IAO-134212).
- MÉL SÜTŐ EXTRA SZŰZ OLÍVAOLAJJAL - Giuliana Prémium Olívaolaj - Giuliana Olívaolaj
- Koleszterin Az olívaolaj-forrás
- Ételek, amelyek javítják hozzáállását
- Coronavirus Diet 9 olyan étel, amely elősegíti a relaxációt, hogy nyugodt maradjon; CBS Detroit
- Élelmiszerek, amelyek természetesen csökkentik a koleszterint - új nyugati orvosok Új nyugati orvosok egészségügyi ellátása