Biológiai óra
Kapcsolódó kifejezések:
- Hypothalamus
- Éberség
- Kortizol
- Melatonin
- Cirkadián ritmus
- Gyors szemmozgás alvás
- Suprachiasmatic Nucleus
- Alzheimer kór
- Alvási ébrenléti ciklus
- Alvásminőség
Letöltés PDF formátumban
Erről az oldalról
A biológiai órák befolyásolják a hormonális váladékot és a válaszokat
Donald W. Pfaff,. Geoffrey A. Head, a hormon/magatartási viszonyok elveiben, 2018
Absztrakt
A biológiai órákról ismert, hogy befolyásolják a hormonális váladékot és reakciókat. Sokféle kísérleti állatnál és embernél a keringő hormonszint nagyon rendszeres 24 órás ingadozása figyelhető meg. A hormon beadására adott egyes viselkedési válaszok amplitúdója a napszak függvényében változik. Emlősöknél az agy cirkadián órája a neuronok aktivitásában nyilvánul meg a hipotalamusz kis részében, a suprachiasmatic nucleusban (SCN). Az SCN a perifériás cellák többségében az SCN-hez szinkronizált órákat vezérli. Ez a rendszer számolja a hormonszint és a viselkedési szokások napi ingadozásait és cirkadián ritmusait. Az állatvilágban az etetés ritmikus módon történik. Az évszakok, a nappali/éjszakai ciklus és az ételek rendelkezésre állása egyaránt befolyásolja az etetést, de van egy mögöttes ritmus, amelyet hormonok és idegi mechanizmusok vezérelnek. Az embereknél a hormonváladék és a viselkedés napi változásait legalább kétféle erő vezérli: a fény által magával ragadott 24 órás ritmus és az alvás iránti vágy.
A homeosztázis és a stresszre adott általános válaszok
J.A. Simpson MD, FRCP, FRCP (Ed), FRCP (Glas), FRS (Ed), W. Fitch PhD, MB ChB, FFARCS, in Applied Neurophysiology, 1988
KIRKÁD ÉS HOSSZÚTÁVÚ RITMUSOK
A „biológiai órák” létezése, amelyek a testhőmérséklet, a testsúly, a vérkémia, az izgalmi állapot és az egyéb paraméterek többé-kevésbé ritmikus változását szabályozzák, ma már jól elfogadott, bár az oszcillátorok jellege és helyszínei vita tárgyát képezik. A neuroendokrin váladék változása lehet cirkadián (pl. ACTH), menstruációs (pl. Gonadotropinok), szezonális (esetleg növekedési hormon) vagy viszonylag rövid ciklusokban (pl. Alvás-ébrenlét), és az egyik ritmus egymásra helyezhető (pl. nem REM alvás, 142. o.).
Ezeket az alapvető ritmusokat torzítja az egyik és a másik tevékenység közötti kölcsönhatás. Ezenkívül egy ciklust külső ingerek is magával ragadhatnak. Fontos példa erre a fény hatása egyes hipotalamusz által szabályozott funkciók alapértékeire. A retinák nappali stimulálása aktiválja a retinohypothalamicus vetületét a hipotalamusz suprachiasmaticus magjába (25.1. Ábra). A szuprachiasmatikus mag a hipotalamusz ventromedialis, dorsomedial és íves magjaiba vetül, hogy modulálja a gonadotróf hormonok (és esetleg az ACTH és a növekedési hormon) felszabadulását, ami a baromfiipar számára ismert tény. Ez nem azonosítható az ember különálló magjaként, de az intenzív terápiás személyzetnek tisztában kell lennie az emberi alany követelményeivel a rendszeres sötétség (és esetleg a csend) időszakaiban.
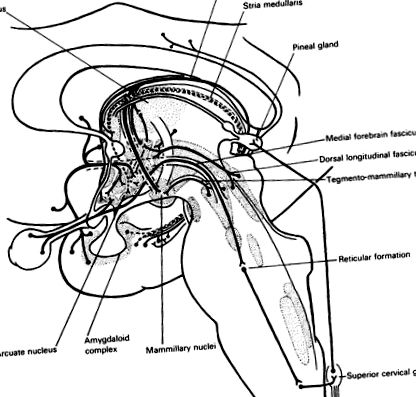
25.1. Ábra Afferensek a hipotalamuszhoz. A mediális előagyi köteg afferens szálakat gyűjt a preoptikus területekről, beleértve az orbitofrontális kéreget és a septum magokat. Az amigdaloid komplex az íves magba vetül a hippocampus képződésén és az andstria terminalison keresztül (···). Az agy közepe a hátsó hipotalamuszba vetül a dorzális longitudinális fasciculus és a tegmento-mammillaris traktus, valamint egy dopaminerg rendszer által (lásd 3.3. Ábra). A hippocampus – fornix rendszer magában foglalja a septum és az elülső hipotalamusz vetületeit, de a mammilláris maghoz való fő hozzájárulása a thalamusba kerül. A retina neuronokat küld a szupraoptikus magba. A mediális hosszanti köteg pontomedulláris retikuláris képződésre és végső soron a felső mellkasi szimpatikus idegrostokra vetül. A gerincen kívüli szimpatikus szálak a felső nyaki ganglionból a tobozmirigybe emelkednek, amely ezért közvetetten optikai irányítás alatt áll.
A suprachiasmatikus kontrollt a raphe magokból felemelkedő szerotonin modulálja. A suprachiasmaticus mag felé irányuló retinohypothalamicus vetület szintén a medialis előagycsomón és a mesencephalicus retikuláris formáción, a felső mellkasi gerincvelő oldalsó sejtoszlopán és a felső nyaki szimpatikus ganglionon keresztül továbbul a tobozmirigy felé. A tobozmirigy a vér-agy gáton kívül fekszik (25.1. Ábra). Az ott felszabaduló noradrenalin stimulálja a béta-adrenerg receptorokat, amelyek szabályozzák a szerotoninnal kapcsolatos hormon, a melatonin szintézisét. A környezeti fény magába vonja a szekréció endogén körforgását. Ennek az indol hormonnak az anyagcseréje nagyon reagál a noradrenalinra és a stresszre. Noha a melatonin (vagy a tobozmirigy egyéb azonosított hormonjainak) funkciói ismeretlenek, ez a felfedezés fontos mutató a hipotalamusz hormonok szenzoros stimulációval, valamint noradrenerg és szerotoninerg szekrécióval történő szabályozására, mivel a tobozmirigy válaszának enzimes alapja azonosított.
Az imént ismert tobozmechanizmus példája az idegrendszer általános elvének. A fényhullámok a retinában lévő rodopszin-szerű pigmentre hatva ganglionsejt-stimulációt váltanak ki, amelyet azután normál neurotranszmitter-mechanizmusok közvetítenek egy effektorszervben lévő β1-adrenerg receptorokra. Ott (a cAMP közvetítésével) a szabályozó enzim aktivitása fokozódik, ami egy olyan hormon szintéziséhez vezet, amely kiválasztódik a véráramba. A tobozmirigy a felsőagy és a hátsó choroidalis artériákból származik.
Az alváskutatás kézikönyve
Teresa Liu-Ambrose, Ryan S. Falck, a Viselkedési Idegtudományi Kézikönyvben, 2019
III Cirkadián ritmusok és alvás normális öregedés esetén
Az emberi biológiai óra fő vonzereje a könnyű (Roenneberg & Foster, 1997; Sharma & Chandrashekaran, 2005), kihatva a melanopsint tartalmazó retina ganglion sejtekre (Blanks, Hinton, Sadun és Miller, 1989; La Morgia et al. ., 2016; Schmidt, Chen és Hattar, 2011; Sekaran, Foster, Lucas és Hankins, 2003). A retina fényének expozíciója közvetlenül stimulálja az SCN aktivitását, amely fázis késlelteti a biológiai órát, így az alvásvágy csökken és az ébrenlét fokozódik (vagy fennmarad); a retinális fény csökkent expozíciója az SCN kevesebb aktivitását eredményezi, és növeli az alvásvágyat a biológiai óra előrehaladásával (Shirani & Louis, 2009). Így normális körülmények között a biológiai órát az SCN szabályozása révén bevonják a napfény-sötét ciklusba - ami segít az embereknek a rendszeres alvás-ébrenléti ciklus fenntartásában (Mistlberger, 2005).
Az öregedés azonban jelentősen megváltoztatja a cirkadián ritmusok működését. Az öregedés összefüggésbe hozható azzal a biológiai órával, amely a nap elején elindítja az alvást elősegítő mechanizmusokat (Czeisler et al., 1992; Duffy, Dijk, Klerman és Czeisler, 1998), valamint a cirkadián jelek amplitúdójának csökkenésével, amelyek növelik az alvásigényt (Dijk, Duffy, Riel, Shanahan és Czeisler, 1999; van Someren, Mirmiran és Swaab, 1993). A cirkadián szabályozásnak ez a gyengülése az öregedéssel valószínűleg kiemelkedő szerepet játszik az idősebb felnőtteknél észlelt alvás-ébrenlét ritmusainak széttöredezésében (1) az ébrenlét fenntartási zónájában, amely 2-3 órával a szokásos lefekvés előtt következik be, és (2) az alvás fenntartásában zóna, amely 2-3 órával a szokásos ébredési idő előtt következik be (Landry & Liu-Ambrose, 2014). Ezenkívül az idősebb felnőtteknél csökken a fényérzékenység a retina ganglion sejtjeinek és axonjainak életkorral összefüggő vesztesége miatt (Harwerth, Wheat és Rangaswamy, 2008), ami az SCN gyengébb működéséhez és a biológiai óra eltérésétől a napfény-sötét ciklus (Neikrug & Ancoli-Israel, 2010). Az idősebb felnőttkorban bekövetkező viselkedésbeli változások - például kevesebb időt töltenek a szabadban - tovább csökkenthetik a fényes fény expozícióját, ami hozzájárulhat a cirkadián ritmusok csökkent amplitúdójához (Landry & Liu-Ambrose, 2014).
A cirkadián szabályozásnak ez az életkorral összefüggő gyengülése az alvás minőségének romlásával is összefüggésben lehet idősebb felnőttkorban. Az alvás a normális öregedés függvényében változik, mind a minőség, mind a mennyiség csökkenése szempontjából (Crowley, 2011; Espiritu, 2008). A 65 év feletti felnőttek több mint fele legalább egy krónikus alvási panaszról számol be - a leggyakoribb panaszok az éjszakai aludni való képtelenség és a túlzott nappali álmosság, ami gyakran nappali szunyókálást okoz (Foley és mtsai, 1995). Ezek a panaszok, különösen a túlzott nappali álmosság (a felhalmozódott alvási adósság kulcsfontosságú mutatója (Carskadon, 1986; Johns, 1991)) jelentései arra utalnak, hogy az életkorral összefüggő alvási változások valószínűleg a csökkent alvásigényen túlmutató eredmények következményei. A bizonyítékok tehát azt sugallják, hogy (1) a normális öregedés megzavarhatja a cirkadián ritmusok működését, és (2) ezek a korral járó változások a cirkadián ritmusok működésében megmagyarázhatják az alvás minőségének és mennyiségének csökkenését az emberek öregedésével.
Az alvás-ébrenlét ciklusának elektrofiziológiai összefüggései
2.2.2 Az állatok alvási architektúrája
Alzheimer kór
Időbeli változás: (iii) A lepedékmagok növekedése és felhalmozódása
Diencephalon és belső kapszula
Afferens kapcsolatok
. Zsigeri és szomatikus afferensek . Az általános zsigeri afferensek a vagális szenzoros sejtmagból, ízlelő afferensek a nucleus solitariusból, a szomatikus afferensek pedig a mellbimbókból és a nemi szervekből érkeznek. A fényintenzitással foglalkozó retina afferensek „biológiai órát” programoznak. Van egy bemenet a szagló kéregből a mediális előagyi kötegbe.
Limbikus rendszer, thalamus és kéreg. Az oldalsó kamra alsó szarvának padlóján lévő hippokampuszt a fornix köti össze a mamilláris testtel, a biztosítékokkal pedig a többi hipotalamusz maggal. Az alsó kürt tetején lévő amygdaloid mag efferensei alkotják a stria terminalis-t, amelyek eljutnak az elülső hipotalamusz és a septum régióba. Mindkét traktus, a fornix és a stria görbül a thalamus körül (8.1, 8.10. Ábra, lásd 10.2. Ábra). A mediális előagycsomag afferenseket hoz a septum régióból. A mamillothalamus traktus összeköti a hipotalamust az elülső thalamus maggal, amely kölcsönös kapcsolatban áll a cinguláris gyrusszal. Ezek mind a limbikus rendszer részét képezik, és a diencephalon és a telencephalon között rögzítési zónát (limbus) alkotnak.
A prefrontális kéreg érzelmi, affektív információkat továbbít a dorzális mediális thalamus magon keresztül a hipotalamuszba a thalamus mediális felületén található rostok periventrikuláris rendszerén keresztül.
Tobozmirigy: kölcsönös kapcsolat (lásd 178. o.).
Közvetlen fizikai és kémiai receptorok. A keringő vért folyamatosan figyelik a termoreceptorként, ozmoreceptorként vagy kemoreceptorként működő hipotalamusz sejtek.
Gyakorolja az agy egészségét
Jessie S.M. Chan,. Cecilia L.W. Chan, a Neurobiology International Review-ban, 2019
1.3 Pszichológiai distressz, alvászavar és gyorsított öregedés CFS-ben
A jelenlegi és az egész életen át tartó pszichiátriai rendellenességek gyakoriak a CFS-ben szenvedő egyének körében (Nater et al., 2011). A CFS-ben szenvedő egyének többségét pszichiátriai betegség miatt kezelik alatta (Nater et al., 2011). A CFS-ben szenvedő személyek rosszabb mentális egészségi állapotról számoltak be, mint a nem CFS-es társak (Wong & Fielding, 2010). Tekintettel a krónikus fáradtság (CF) és a CFS mindennapi működésre és munkateljesítményekre gyakorolt kedvezőtlen fizikai és mentális következményeire, ezeket a körülményeket a gazdaságra és az egészségügyre nem szabad lebecsülni, hanem általában elhanyagolni (McCrone, Darbishire, Ridsdale és Seed, 2003).
Az alvásfiziológia fontos tényezőnek bizonyult a CFS patofiziológiájában. A belső biológiai óra zavarai frissítő alvásként vagy alvászavarként, gyenge koncentrációként és fáradtságként jelentkeznek. Ezek a CFS-hez is társuló tünetek (Fukuda et al., 1994). Noha nem volt bizonyíték a cirkadián ritmus zavarára a CFS-ben, a pittsburghi alvásminőségi index (PSQI) által mért szubjektív alvási panasz és a frissítetlen alvás szubjektív jelentései gyakoribbak voltak CFS-ben szenvedő betegeknél, mint az egészséges kontroll személyeknél (Reeves, Heim, Maloney és mtsai., 2006).
A CFS-ben szenvedő betegeknél szignifikánsan nagyobb volt az allosztatikus terhelés valószínűsége, ami a hosszan tartó stresszre adott válasz károsodását eredményezné. A jelenlegi és az egész életen át tartó pszichiátriai rendellenességek gyakoriak a CF/CFS-ben szenvedő betegek körében (Nater, Lin, Maloney és mtsai, 2009; Wong & Fielding, 2010). A CFS és a súlyos depresszió megosztja a tüneteket, és mindkettő a stressz rendszer diszregulációjának tekinthető, amelyet hiányos stressz-válasz és túlzott stressz-válasz jellemez. A pszichiátriai rendellenességek, például a depresszió és a szorongás, az alvászavar és a fájdalom, szintén az életkorral összefüggő betegségekkel társulnak, és gyorsított öregedést okozhatnak (Wolkowitz, Epel, Reus és Mellon, 2010).
Az alvás-ébrenlét ciklus: áttekintés
1.4.2 Cirkadián
A homeosztatikus folyamattól független egy cirkadián folyamat, amely az alvást, ébrenlétet és más biológiai folyamatokat (1.4.3. Szakasz) a napi 24 órás világos-sötét ciklus szerint szervezi. 12 Ez egy összetett rendszer, amely az egész test működését ellenőrzi, beleértve az alvást és az ébrenlétet is. A cirkadián rendszer megértése fejlettebb, mint a homeosztatikus rendszer. A 2017. évi fiziológiai vagy orvosi Nobel-díjat Jeffrey C. Hall, Michael Rosbash és Michael W. Young kapta „a cirkadián ritmust szabályozó molekuláris mechanizmusok felfedezéseiért”. Sejtszinten olyan géneket és fehérjéket írtak le, amelyek szabályozzák a cirkadián ritmust. A sejtszinten túl a retino-hipotalamusz traktusból származó világos-sötét bemenet a szuprachiasmatikus magba (SCN) jut, amely a fő biológiai órának számít. Ezután az SCN-ből származó efferensek cirkadián időzítő jeleket közvetítenek, amelyek szinkronizálják a különféle fiziológiai rendszereket és szerveket.
A cirkadián fázist emberben általában a testhőmérséklet vagy a homályos fényben bekövetkező melatonin szekréció, valamint patkányok és egerek kerékfutással történő rögzítésével dokumentálják. 14 A napi emberi testhőmérséklet legalacsonyabb szintje 3 és 5 óra között fordul elő, a másodlagos mélyedés pedig délben, a csúcs pedig 17 és 20 óra között fordul elő. Az alvási epizódok időtartama és az alvás megjelenésének késleltetése párhuzamos a testhőmérséklet ritmusával. Hőmérsékleti csúcsoknál a késés késik és az időtartam rövidül, míg a legalacsonyabbaknál a késés gyors és az időtartam nő.
Az SCN a hormonális és anyagcsere ritmusokat is vezérli. Többet említve: a pajzsmirigy-stimuláló hormon, a kortizol, a prolaktin, a növekedési hormon és a melatonin mind napi cirkádiát mutatnak. Akut módon a prolaktin és a növekedési hormon összefügg az alvással, vagyis felszabadulásuk késik, amikor az alvás késik, a cirkadián fázistól függetlenül. Ezzel szemben a kortizol közvetlenül kapcsolódik a világos-sötét ciklushoz, és annak cirkadián ritmusa az alvás időzítésétől függetlenül megmarad. A melatonin hormon a világos-sötét ciklust kommunikálja az SCN-en keresztül az egész test óráival. Termelését és felszabadulását az SCN vezérli, sötétség alatt fejezi ki, és fény alatt elnyomja. A sötét fázis alatti rövid fényimpulzus elnyomja a melatonin szintjét, amely a fény időtartama alatt folytatódik. Este alkonyatkor a melatonin felszabadulása gyengíti az SCN riasztó pulzusát, megkönnyítve ezzel az éjszakai alvás kezdetét. A krónobiotikus jellemzőin túlmutató hipnotikus képessége, vagyis a sötétség jelzése azonban nem egyértelmű.
Cirkadián ritmusok és függőség
Kelly Barko,. Ryan W. Logan, a függőség neurális mechanizmusaiban, 2019
Jövőbeli irányok
Egyre szkeptikusabb, hogy a cirkadián ritmus az elsődleges mechanizmus, amely a szerhasználatot és az addikciót vezérli, annak ellenére, hogy a felmerülő bizonyítékok ennek ellenkezőjét bizonyítják. Ez részben annak tudható be, hogy a kutatás hiánya közvetlenül és okozati összefüggésben van azzal, hogy a javasolt molekuláris, fiziológiai vagy biológiai órák tényleges ritmusai valóban fontosak-e a viselkedési fenotípusok ritmusához, és hogy ezek a cirkadián-függő mechanizmusok főszerepe van, ha valaki függővé válik. A pálya feladata azon pragmatikus kísérleti modellek megtervezésének szükségessége, amelyek világosan meghatározzák a cirkadián zavarok hatását a szerhasználat iránti kiszolgáltatottságra, elkülönítve a ritmusok sóvárgásra, függőségre és megvonásra gyakorolt szerepétől. Például a cirkadián génmutációk a cirkadián-függő mechanizmusok vagy genetikai pleiotropia révén hozzájárulhatnak a szerhasználat kockázatához [293]. Ezenkívül a fény hatással lehet a hangulat és a jutalom áramkörére és viselkedésére olyan mechanizmusokon keresztül, amelyek látszólag függetlenek a „klasszikus” cirkadián útvonalaktól [6,224,294] .
- Az elhízás terhe - áttekintés a ScienceDirect témákról
- Antiallergiás - áttekintő ScienceDirect témák
- Mell Fibroadenoma - áttekintés a ScienceDirect témákról
- Aphthous Stomatitis - áttekintés a ScienceDirect témákról
- Antifolate - áttekintés a ScienceDirect témákról