Picornavirales
Kapcsolódó kifejezések:
- Peptid
- Nemzetség
- Drosophila
- Enzimek
- Mutáció
- Fehérjék
- DNS
- Plazma membrán
Letöltés PDF formátumban
Erről az oldalról
Picornavirales
Bevezetés
A Picornavirales rend egy monopartitit vagy bipartit pozitív szálú RNS genommal rendelkező vírusokat tartalmaz, amelyek a következő tulajdonságokkal rendelkeznek: auto-proteolitikusan feldolgozott poliprotein (ek), közös háromdoménes replikációs blokk (Hel-Pro-Pol domén, amely egy szupercsalád III helikázból áll) kimotripszinszerű szerkezetű proteináz és I. szupercsalád RNS-függő RNS-polimeráz) és burkolatlan, körülbelül 30 nm átmérőjű pszeudo-T = 3 szimmetriájú ikozaéderes virionok. Az RNS-eket általában az jellemzi, hogy egy kis VPg fehérje (tipikusan 3-4 kDa) kapcsolódik az 5'-végükhöz és egy poli (A) farok a 3'-végükhöz. A Picornaviridae (Enterovirus nemzetség) és a Secoviridae (Comovirus nemzetség) család tagjai voltak a rend elsõ jellemzõ tagjai, és gerinceseket, illetve növényeket fertõztek meg. A végzés magában foglalja a gerinctelenek (Dicistroviridae és Iflaviridae családok) vagy az algák (Marnaviridae család) fertőzését is. Nagyszabású környezeti genomikai vizsgálatok arra utalnak, hogy az óceánban nagyszámú, jellemzés nélküli pikornaszerű vírus található.
Növényvédelem
Yongchao Zhao,. Luc Swevers, a rovarélettani fejlődés terén, 2018
4.2.2 Dicistroviridae
A diszistrovírusok picorna-szerű vírusok (Picornavirales), amelyeket nem köpenyes, körülbelül 30 nm átmérőjű, pszeudo T = 3 szimmetriájú ikozaéderes virionok jellemeznek. Nevük két ORF vagy cistron jelenlétéből származik az egyszálú pozitív érzékű RNS genomban (Bonning és Miller, 2010; Le Gall és mtsai, 2008). A dicistrovirális genom mérete 8500–10 200 nt, 5′-vírusfehérje (VPg) sapkát és 3′-poli (A) farkat tartalmaz. A fehérjeszintézist két belső riboszomális belépési hely (IRES) indítja el, amelyek az ORF1 (5'-nem transzlált régió (UTR) IRES) és az ORF2 (intergenikus régió (IGR) IRES) irányában helyezkednek el (Khong és mtsai, 2016). Az ORF-ek olyan poliproteineket kódolnak, amelyek tartalmazzák a nem strukturális (VSR, helikáz, proteáz, kis genomhoz kapcsolt fehérjét (VPg), RdRp-t, amelyet az ORF1 kódol) és a strukturális (kapszidképző) fehérjéket (amelyeket az ORF2 kódol). A poliproteineket kotranslációs és poszttranszlációs úton dolgozzák fel a vírus proteázok funkcionális egységek előállítására. A víruskapszidokat a VP0 (= VP4 + VP3), a VP1 és a VP2 szerkezeti fehérjék állítják össze; az RNS-genom beágyazását követően a kapszidák érési lépésen mennek keresztül, amelynek során a kis VP4 fehérje leválik a VP3-ról a VP0 prekurzorban (Mullapudi et al., 2016; Tate et al., 1999).
A dicistroviruses tücsök paralízis vírust (CrPV) és a Drosophila C vírust (DCV) a picorna-szerű vírusok modelljeként alkalmazták az alapkutatásban a vírus kapszid szerkezetének figyelembevételével (Tate et al., 1999), az IRES általi transzláció kezdeményezésével és mtsai., 2017), a stresszgranulátum (Khong és mtsai, 2017) és az RNAi (Nayak és mtsai, 2010) képződésének elnyomásának és a veleszületett vírusellenes immunválasz kiváltásának mechanizmusait (Kemp és mtsai. 2013). Más dicistrovírusokat gazdasági és orvosi jelentőségük miatt tanulmányoznak: az izraeli akut bénulás vírus és az akut méh bénulási vírus a méhek csökkenésével és a telepek összeomlásának rendellenességével társul (Chen et al., 2014; de Miranda et al., 2010); A Taura-szindróma vírus (TSV) a garnélarák-gazdálkodást sújtó pusztító betegség kórokozója (Mari és mtsai., 2002), míg más dicistrovírusokat biopeszticidnek tekintenek mezőgazdasági vagy orvosi jelentőségű rovarok ellen, például a Triatoma vírus (TrV) a Chiatas-kór (Bonning és Miller, 2010) és a Homalodisca 1-es koagulációs vírus (HoCV-1) vektorát képező triatomin-hibák ellen az üvegszárnyú éleslövővel, egy hemipterán kártevő ellen (Hunnicutt et al., 2008). A CrPV-t is rovarkártevő-reagensnek tekintik (Manousis és Moore, 1987).
A dicistrovírusok fertőző klónjainak generálását több hátrányos tulajdonság miatt nehéz feladatnak tekintik (Carrillo-Tripp és mtsai, 2015). A terminális szekvenciák klónozása gyakran nehéz, mivel a PCR-amplifikációs termékekben az artefaktumokhoz vezető erős másodlagos struktúrák vannak. Az RNS vírusok kvázifajként is léteznek (Lauring és Andino, 2010), és a populáció különböző vonalakból áll, amelyek rokon, de nem azonos szekvenciák genomjait csomagolják. Míg a rokon genomi RNS-ek populációja képes hatékonyan létrehozni a funkcionális vírusokat, ez nem garantáltan egyetlen izolált RNS-genomból következik be. A populációban az egyik RNS törzs mutánsait/hibáit transz-ban hatékonyan kompenzálják a populáció más törzsében található „vad típusú” szekvenciák. Ezért ajánlott több szekvenciát elkülöníteni és tesztelni azok működését; ebben az esetben olyan RNS-genomok is beszerezhetők, amelyek különböző tulajdonságokkal rendelkező fehérjéket kódolnak, például a replikáció és az RNSi-szuppresszió tekintetében (Lim és mtsai., 2010a, b). Végül, miután elkülönítették, a teljes vírusgenom fenntartása a baktériumokban nehéz lehet az instabilitás és a toxikus hatások miatt (Kerr et al., 2015).
A fekete királynő sejt vírus (BQCV) és a Rhopalosiphum padi vírus (RhPV) fertőző klónjainak izolálására tett kísérletek végül sikertelenek voltak (Benjeddou et al., 2002; Boyapalle et al., 2014; Pal et al., 2014). Az RNS vírusok általában hátrányos jellemzői mellett a méhek (BQCV) és a levéltetvek (RhPV) dicistrovírusainak reverz genetikai rendszereinek előállítása nehezebb, mivel a himenoptera és hemipterán rovarokból származó sejtvonalak általában nem állnak rendelkezésre a lepidopterákhoz, dipteránokhoz és, újabban a coleopterans (Goodman et al., 2012; Lynn, 2001).
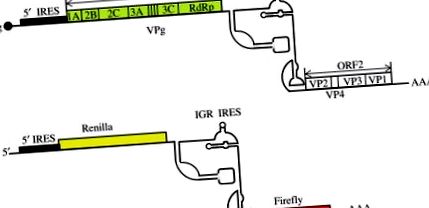
3. ábra A CrPV genom és replikon sematikus ábrázolása. (A) CrPV genomszervezés. Jelzik a vírusfehérje (VPg) sapkát, az 5′- és az IGR IRES-t, a nem strukturális fehérjéket kódoló ORF1-et, a strukturális (kapszid) fehérjéket kódoló ORF2-t és a poli (A) -farkat. (B) A CrPV kettős riporter replikonban az ORF1 és ORF2 helyébe Renilla, illetve Firefly ORF lép. A replikációt és a transzlációt az ORF1 koexpressziója stimulálja transz-ban.
Panel (A): Khong, A., Bonderoff, JM, Spriggs, RV, Tammpere, E., Kerr, CH, Jackson, TJ, Willis, AE, Jan, E., 2016 adaptálva. Különálló belső riboszómák időbeli szabályozása a dicistroviridae tücsök bénulási vírus belépési helyei. Vírusok 2016, 8–25 (Open Access); panel (B): Khong, A., Kerr, CH, Yeung, CHL, Keatings, K., Nayak, A., Allan, DW, Jan, E., 2017. engedélyével adaptálva. A stresszgranulátum képződésének megzavarása a multifunkcionális tücsökbénulás vírus 1A fehérje által. J. Virol. 91., e01779–16.
Az ORF2 törlése CrPV RNS replikonok létrejöttét eredményezi, amelyek felhasználhatók a riporter (luciferáz) vagy a rekombináns fehérje expressziójának hajtására (3. ábra B; Khong és mtsai, 2016). Végül rendelkezésre állnak protokollok (rekombináns) CrPV-virionok előállításához magas titrálással olyan sejtvonalak alkalmazásával, mint a Drosophila-származékú DL2 és a lepidopteran Hi5 (Scotti és mtsai, 1996). A CrPV széles gazdaszervezetsel rendelkezik (hat különböző rendű rovart fertőz; Bonning és Miller, 2010), ezért potenciálisan VIGS vektorként alkalmazható több rovarfajban.
A Dicistroviridae IGR IRES nagy érdeklődést váltott ki a transzláció iniciációjának alapkutatása iránt, mivel a riboszómát bármilyen gazda iniciációs tényező hiányában toborozhatja, és a transzlációt iniciátor tRNS hiányában kezdeményezheti (Johnson és mtsai, 2017; Lee és mtsai., 2017). A legintenzívebben vizsgált CrPV IGR IRES minden eukarióta sejtben, sőt, prokariótákban is aktív, bár a mechanizmus más (Colussi et al., 2014). A dicistrovírusok IGR IRES vizsgálata óriási mértékben hozzájárult az eukarióták transzlációs iniciációjának megértéséhez. Ami a gyakorlati alkalmazásokat illeti, az IGR IRES beépülhet több fehérje egyetlen promóterből vagy transzkriptumból történő expresszióját célzó stratégiákba (Brodel et al., 2014). Végül az IRES a vírusellenes stratégiák és az antivirális gyógyszerek kifejlesztésének célpontjának tekinthető. Bár ilyen munkát már megkezdtek az embert megfertőző pikornavírusok esetében (Dibrov et al., 2014), alkalmazható azokra a dicistrovírusokra is, amelyek gazdasági jelentőségű rovarokat, például méheket és garnélákat fertőznek meg.
Rendeljen Picornavirales-t
Dimitrij Konstantinovics Lvov,. Petr Grigorievich Deryabin, Zoonotikus vírusok Észak-Eurázsiában, 2015
A Picornavirales rendhez tartozó zoonotikus vírusok közül csak a Picornaviridae családba tartozó Cardiovirus nemzetségbe tartozó Syr-Darya völgyi láz vírust (SDVFV) izolálták Észak-Eurázsia kullancsaiból. Az SDVFV-t eredetileg egy lázas beteg véréből izolálták Kazahsztán Kyzylorda tartományában 1973 júliusában. Később a Hyalomma asiaticum (Hyalomminae alcsalád) kullancsból és a Dermacentor daghestanicus (Rhipicephalinae alcsalád) kullancsokból egy SDVFV-törzset izoláltak. ), amelyeket a Syr-Darja és az Ili folyók árterén gyűjtöttek össze. Az SDVFV-t izolálták az Ornithodoros capensis (Argazidae család) kullancsokból is, amelyeket Laridae madarak fészkébe gyűjtöttek a Kara-Bogaz-Gol-öböl szigetein (a Kaszpi-tenger keleti partjainál, Türkmenisztánban). Filogenetikailag az SDVFV szorosan összefügg Theiler egér encephalomyelitis vírusával (TMEV) és Vilyuisk humán encephalomyelitis vírussal (VHEV).
Neurovirology
Philip E. Pellett,. Thomas C. Holland, a Klinikai Neurológia kézikönyvében, 2014
Picornavírusok
A Picornaviridae család (Picornavirales rend) fő nemzetségei, amelyek tartalmazzák az emberi vírusokat, az Enterovirus, Hepatovirus és Parechovirus. Az emberi enterovírusok közé tartoznak az 1–3. Típusú poliovírusok (formálisan a humán enterovírus C fajok), a coxsackievirusok, az echovírusok és a rhinovírusok. A neurológiai betegségek közé tartozik a gyermekbénulás, az aszeptikus agyhártyagyulladás és az encephalitis petyhüdt bénulása (Rhoades et al., 2011).
A pikornavírus virionjai 28–30 nm átmérőjű, burkolatlan ikozaéderes kapszulák (2.1. Ábra). A genom egy fertőző lineáris, 7,2–8,4 kb méretű ssRNS-ből áll. A fertőzést specifikus plazmamembrán receptorokhoz való kötődés indítja el, majd a vírusos RNS felszabadul a citoplazmába, ahol a vírus replikációja zajlik (2.2. Ábra, 1A. Út) (Lin és mtsai., 2009; Daijogo és Semler, 2011; Ogram és Flanegan, 2011; Thibaut és mtsai, 2012). A pikornavírus transzlációja kupakfüggetlen, és belső riboszomális belépési szekvenciát használ. A transzlált nagy prekurzor poliprotein önmagában hasad mind strukturális, mind nem strukturális polipeptidekbe. A citoplazmában történő összeszerelés után az érett vírusrészecskék felszabadulnak a sejtek lízisével (2.5. Ábra, C1. Út).
Jellemzően széklet-orális úton terjed, a legtöbb enterovírus fertőzés tünetmentes vagy szubklinikus. A betegség spektruma azonban a differenciálatlan lázas betegségtől, gyakran felső légúti tünetekkel együtt, a potenciálisan végzetes neurológiai kimenetelig terjedhet. Az aszeptikus agyhártyagyulladás számos coxsackievirus A és B csoportba tartozó szerotípussal, echovírusokkal és poliovírusokkal társul. Az encephalitis és a sporadikus bénulás leggyakrabban az A5–7 coxsackievirusokhoz (az A5 és A6 esetében nem encephalitis), az A9 és a B1–5, a 6 és 9 echovírusokhoz és az enterovírushoz 71. A poliovírusok klasszikusan petyhüdt motoros bénulással társulnak. Az echovírusok és egyes coxsackievirusok által okozott krónikus meningoencephalitisről beszámoltak olyan betegeknél, akiknek B-limfociták működési hibái voltak. Az újonnan azonosított Parechovirus nemzetség vírusai aszeptikus agyhártyagyulladással, meningoencephalitissal és újszülöttkori encephalitisszel társultak fehérállományi sérüléssel (Romero és Selvarangan, 2011).
Habár a picornavírusokhoz nem állnak rendelkezésre vírusellenes szerek, az élő és legyengített vakcinák a gyermekbénulás irányítását szinte felszámolásig vezették (Pliaka et al., 2012).
Secovírusok (Secoviridae)
Bevezetés
A szekovírusok a taxonómiai rend Picornavirales növényfertőző tagjai, egy olyan víruscsoport, amely szélesebb körben ismert tagokat foglal magában, például poliovírus, rhinovírus és ragadós száj- és körömfájás vírus. A Grapevine fanleaf vírus (GFLV) tüneteit elsők között írták le önállóan számos európai országban a XIX. Század végén. Az 1960-as évek elején a növényi víruscsoport, amelyhez a GFLV tartozik, a fonálférgek által átvihető nepovírusok, az elsők között ismerték fel, majd a következő évtizedekben a kapcsolódó komovírus és fabavírus csoportok következtek. A Picornavirales rend minden más tagjától eltérően, amelyek genetikai információikat az RNS egyik pozitív érzéki szálán (monopartit) tartalmazzák, a komovírusok, a fabavírusok és a nepovírusok szegmentálódnak, vagyis genomjuk kettéválik. Ez a szervezet a szekovírusok túlnyomó többségére jellemző, amelyeket eddig jellemeztek. Azonban a sequivirus és a waikavirus csoport tagjai - ez utóbbit a Rice tungro spherical virus (RTSV) típusú tag képviseli, amely az 1960-as és 70-es években Délkelet-Ázsiában pusztító névadó betegség ok-okozati összetevője - kivételt képeznek egy nem tagolt egyoldalú genom.
A szekovírusoknak, mint a Picornavirales összes tagjának számos közös vonása van. Genomszegmenseik olyan poliproteineket (funkcionális domének összefüggő klaszterei) termelnek, amelyeket egy általában konzervált helikáz-proteáz-polimeráz replikációs blokkban kódolt vírus proteáz proteolitikusan hasít kisebb funkcionális fehérjékké. Az előrejelzések szerint mindegyikük egy kis fehérjét (VPg) kódol, amely a genomjuk 5'-végéhez kötődik. A vírusrészecskék nem burkolatosak és körülbelül 30 nm átmérőjűek. A nanobiotechnológiai eszközök fejlesztésének egyik éllovasa, a Cowpea mozaikvírus szerkezete különösen jól jellemzett.
A 2000-es évek óta kivételt állapítottak meg az általános szabály alól, miszerint a genomi RNS-szegmensek a Picornavirales rendben egyetlen poliproteint kódolnak. A szekovírusok esetében bizonyítékot nyertek a torradovírusok megjelenése és jellemzése, amelyek nyilvánvalóan bicistronikusak az egyik genomszegmensükre nézve, és egy még ismeretlen funkciójú, előre jelzett fehérjét kódolnak. Egy másik kivétel a feltételezett közös vonások alól az a közelmúltbeli felfedezés volt, hogy a Strawberry mottle vírus (SMoV) glutaminos proteázt kódol, az összes többi szekovírusban konzervált 3C-szerű proteáz mellett. Az előbbi proteáz az első ilyen típusú pozitív egyszálú RNS vírus.
A vírusos kórokozók kockázata a tenger gyümölcseiben
7.5.1 Szisztematika és morfológia
Az Aichivirus a Picornaviridae családba tartozó Kobuvirus nemzetségbe tartozik, a Picornavirales rendben, a Ribohelica osztályba sorolva (Sasaki et al., 2001). Ez egy kicsi, fel nem fedett, egyszálú, pozitív érzékű ribonukleinsav vírus, 8,2 kb nagyságú genommal. Az egyetlen, nagy ORF egy 2432 aminosavból álló poliproteint kódol, amelyet hasítunk a tipikus pikornavírus szerkezeti fehérjékbe (VP0, VP3, VP1) és a nem strukturális fehérjékbe (2A, 2B, 2C, 3A, 3B, 3C, 3D). 519 bp szekvenciák filogenetikai elemzése alapján a 3C-3D (3 CD) csomópontban. A tisztított Aichivirus virionok morfológiai vizsgálata azt mutatta, hogy a felületi struktúra egy kis kerek struktúrájú vírust tartalmaz (Yamashita et al., 1991).
Tengeri vírusok
Grieg F. Steward,. Elisha M. Wood-Charlson, a Biodiverzitás enciklopédiája (második kiadás), 2013
Javasolt nemzetség Bacillarnavirus
Zöldségek vírusai és vírusos betegségei a Földközi-tenger medencéjében
Hervé Lecoq, Cécile Desbiez, Advances in Virus Research, 2012
1 Vírustulajdonságok
Az SqMV a Comovirus nemzetséghez, a Secoviridae családhoz tartozik, a közelmúltban meghatározott Picornavirales renden belül. Kétoldalas egyszálú pozitív érzékű RNS genomja van, 5'-hez kötött VPg-vel és 3'-os poliadenilezett farokkal. A virionok 30 nm átmérőjű kis izometrikus részecskék. Az RNS 1-t (5,9 kb) egyetlen poliproteinben fordítják le, amelyet öt doménné dolgoznak fel: egy 32 kDa fehérjévé (P1A), amely a többi poliprotein feldolgozását szabályozza, egy 58 kDa-os RNS-helikáz, egy VPg, egy 24 -kDa proteáz és 87 kDa RdRp. Az RNS 2-t (3,3 kb) két nagy részben átfedő poliproteinre transzlálják, különböző iniciációs kodonokat használva ugyanabban a keretben, és az RNS 1 proteáz, P1A-val fokozva, három doménre hasítja: egy 50 kDa/40 kDa-os mozgásfehérjére és két CP-re, CPL (42 kDa) és CPS (22 kDa).
Nepovírusok (Secoviridae) ☆
Absztrakt
A Nepovirus nemzetség tagjai (Comovirinae alfaj, Secoviridae család, Picornavirales rend) növényi ikozaéderes vírusok, amelyek kétoldalas pozitív szálú RNS genommal rendelkeznek. Minden RNS egyetlen poliproteint kódol, amelyet a vírusos proteáz hasít. Az RNS replikációja a növény endoplazmatikus retikulumából származó membrán vezikulákkal társul. A nepovírusok intakt vírusrészecskékként mozognak sejtről sejtre, a csőszerkezetek képződésén keresztül, amelyek bejárják a sejtfalat. Sok, de nem az összes nepovírust a fonálférgek közvetítik, és a nepovírusok többsége magról is terjed. A nepovírusok gazdasági jelentőségű betegségeket váltanak ki számos kertészeti kultúrában.
Élelmiszer által okozott fertőzésekkel összefüggő vírusok
Helen O’Shea,. Rose Fitzgerald, az élettudományok referencia moduljában, 2019
Osztályozás és biofizikai tulajdonságok
A Hepatitis A vírus (HAV), más néven Hepatovirus A, a Picornavirales családba tartozik, és a Hepatovirus nemzetség típusa. Ez egy ikozaéderes, burkolatlan vírus, amely egyrészes, pozitív, egyszálú RNS genommal rendelkezik. Az emberek és a gerincesek természetes gazdaként szolgálnak. A HAV-nak egyetlen szerotípusa létezik, de számos genotípus létezik: IA, IB, IIA, IIB, IIIA, IIIB elsősorban emberben és IV – VI, elsősorban nem főemlősökben (Cristina és Costa-Mattioli, 2007). A vírus megfertőzi a májsejteket és a Kupffer-sejteket (máj makrofágok).
- Hasnyálmirigy hormon - áttekintés a ScienceDirect témákról
- Ápolási folyamat - áttekintés a ScienceDirect témákról
- Fehérje - áttekintés a ScienceDirect témákról
- Fogszabályozás - áttekintés a ScienceDirect témákról
- Fehérje étrend - áttekintés a ScienceDirect témákról