Táplálkozási tényezők és öregedés demielinizáló betegségek esetén
Ana M. Adamo
Biológiai Kémia Tanszék, IQUIFIB (UBA-CONICET), Gyógyszerészeti és Biokémiai Iskola, Buenos Aires-i Egyetem, Junín 956, C1113AAD Buenos Aires, Argentína
Absztrakt
Bevezetés
A mielinbiológia 1717-ig nyúlik vissza, amikor Leeuwenhoek megállapította a zsíros részekkel körülvett idegek létezését (Rosenbluth 1999). Két és fél évszázaddal később az ilyen zsíros részek kimutatták, hogy a központi idegrendszerben (CNS) érett oligodendroglialis sejtek (OL) és a perifériás idegrendszer Schwann sejtjei által létrehozott, egy nagyon speciális membránhoz, azaz mielinhez tartoznak. A mielin egy nagyon különleges membrán, egyedülálló molekuláris összetételű és felépítésű. Az egyik fő feladata az axonok és a nátriumcsatornák izolálása a Ranvier-csomópontokban, ezáltal lehetővé téve az akciós potenciál sós átadását a csomópontok között (Waxman 2006). A mielin fejlődése és a sós idegvezetés képezi az alapját a gyors információfeldolgozásnak viszonylag kis térben.
A demielinizáció egy kóros folyamat, amely az axonok körüli mielinhüvelyek elvesztéséből áll. A központi idegrendszerben a demielinizáció általában az OL károsodásának következménye, és primer demielinizációnak nevezik, szemben azzal, amely az elsődleges axonvesztés következményeként következik be, amelyet másodlagos demyelinizációnak vagy walleri degenerációnak tekintenek (Franklin és Ffrench-Constant 2008).
Demyelinizáló betegségek
Klinikai szempontból a mielint érintő fehérállomány-rendellenességek világszerte körülbelül egymillió embert érintenek, és számos kórképet tartalmaznak. Az elsődleges demyelinizáció két fő oka a következő: (1) az OL-kat érintő genetikai rendellenességek (leukodystrophiák) és (2) a mielint és az OL-kat érintő gyulladásos károsodások.
A glia-t érintő genetikai rendellenességek örökletes lizoszomális tárolási betegségeket foglalnak magukban, ideértve a metachromatikus leukodystrophiát és a Krabbe-kórt; peroxiszomális rendellenességek, beleértve az X-hez kapcsolt adrenoleukodistrophiát; valamint a kiválasztott mielinfehérjék hiánya vagy hibás kihajtása, többek között a Pelizaeus – Merzbacher-kór. A sclerosis multiplex (MS) a legkiemelkedőbb a gyulladásos demyelinizáló betegségek között, és a leukodystrophiákkal ellentétben a fokális neurológiai elváltozások jelenléte jellemzi. Ez azonban egy összetett betegség, amelynek klinikai jellemzői a betegek szerint eltérőek.
A sclerosis multiplex klinikai progressziója változó, általában az élet harmadik és negyedik évtizede közötti reverzibilis neurológiai fogyatékosság epizódjaival kezdődik, és a hatodik és hetedik évtized között folyamatos és irreverzibilis neurológiai fogyatékossá válik (Trapp és Nave 2008). Az SM tünetei a központi idegrendszer myelinizált traktusának megszakadása következményei. A mielin protein null mutációkat hordozó egerek több sora bizonyította, hogy az axonális degeneráció a krónikus demyelinizáció következménye (Trapp és Nave 2008). Ebben az összefüggésben a remyelinizációt úgy definiálják, mint azt a folyamatot, amelyen keresztül a mielinhüvelyek helyreállnak a demyelinizált axonokhoz, ami a funkcionális helyreállításhoz kapcsolódik (Franklin 2002). A remyelinizáció a demielinizációra adott válasz, és szükséges az axon túléléséhez. Így regeneratív folyamatnak kell tekinteni, hasonlóan a többi szövetben lejátszódó más regeneratív folyamathoz. A demyelinizáció toxikus alapú modelljeiben, szemben a kísérleti autoimmun encephalomyelitisszel (EAE) vagy vírus által kiváltott demielinizáció, a teljes remyelinizáció spontán történik, ami lehetővé teszi a demielinizációs/remyelinizációs folyamatokban részt vevő mechanizmusok alapos tanulmányozását.
A demielinizáció kétségtelenül az SM patológiájának része; az utóbbi években azonban az idegsejtek vesztesége és az axonvesztés bebizonyosodott, hogy a krónikus demyelinizáció következményei és a neurodegeneráció fő mozgatórugója (Trapp és Nave 2008) a demyelinizáló rendellenességekben.
A demielinizációs/remielinizációs folyamatok alapmechanizmusai
A fent említett toxin-indukált modellek bizonyították az NG2-pozitív sejtek toborzását az SVZ-ből a demyelinizált területre. Ezek a sejtek megkülönböztetik és érett OL-kká válnak, amelyek szekvenciálisan expresszálják a mielinfehérjéket, például a proteolipid fehérjét (PLP), a mielin bázikus fehérjét (MBP) és a 2 ', 3′-ciklikus nukleotid 3′-foszfodiészterázt. Ezek a megállapítások azt bizonyítják, hogy a remielinizációs mechanizmusok szorosan szabályozottak és molekulák széles skáláját foglalják magukban, ideértve a citokineket (Mason et al. 2001) és a kemokineket (Patel és mtsai 2010), a transzkripciós faktorokat (Qi és mtsai 2001), a növekedési faktorokat (Aguirre et al. 2007; Murtie et al. 2005), a mikro-RNS (Junker et al. 2009) és a különböző jelátviteli utak (John és mtsai 2002).
A citokinek közvetítik a gyulladásos választ, amely elősegíti a kórokozók eltávolítását, és így megakadályozza a túlzott szövetkárosodást. A túlzott citokintermelés azonban fokozott gyulladáshoz és ebből következő sejthalálhoz vezethet. Különösen a központi idegrendszerben bizonyos citokinek kulcsszerepet játszanak a regenerációs folyamatokban. A tumor nekrózis faktor-α (TNFα) az R1 és R2 TNFα receptorokon keresztül egyrészt aktiválja a sejtpusztulást, másrészt az NFκB által közvetített túlélést. Az SM-betegeknél általában magasabb a TNFα szintje, mind a cerebrospinalis folyadékban, mind a szérumban, mint a kontroll betegeknél. Ezek az értékek viszont korrelálnak a betegség súlyosságával (Beck és mtsai 1988; Maimone és mtsai 1991). Az interleukin (IL) -1β egy másik gyulladáscsökkentő citokin, amely a demielinizáló betegségek, például az MS fiziopatológiájához kapcsolódik, és a TNFα-hoz hasonlóan a központi idegrendszeri patológia súlyosbodásával jár (de Jong és mtsai 2002).
A kemokinek kemotaxist indukálnak, amely szükséges ahhoz, hogy a sejteket vonzzák az immunválaszban való részvételhez a fertőzött vagy sérült helyen. Bizonyos kemokinek, mint például a CXCL12 és CXCL1, a központi idegrendszer fejlődése során indukálódnak, és koordinálják az idegi prekurzor sejtek (NPC) szaporodását, vándorlását és differenciálódását (Stumm és mtsai 2007; Tsai és mtsai 2002), ami azt sugallja, hogy ők is részt vehetnek a központi idegrendszer regenerációs folyamataiban. Ily módon Patel et al. (2010) kimutatták, hogy a CXCR4 (a CXCL12 receptor) aktiváció fontos a CPZ-demielinizált egér remyelinizációjához OPC-differenciálódás indukciójával.
A növekedési faktorok biológiailag aktív polipeptidek, amelyek szabályozzák a célsejtek növekedését és differenciálódását, és fontosak a remyelinizációs folyamat során. Így bebizonyosodott, hogy az epidermális növekedési faktor receptor szignalizáció részt vesz mind az OPC-k általi újrapopulációban, mind a lizolecitin által kiváltott corpus callosum demielinizáció remyelinizációjában (Aguirre et al. 2007).
A remielinizálódási folyamatban esetlegesen részt vevő jelátviteli utak közé tartoznak azok, amelyeket a leucinban gazdag ismétlődés és Ig domént tartalmazó NOGO receptorokkal kölcsönhatásba lépő fehérje 1 (LINGO-1), Wnt, Sonic hedgehog (Shh) és Notch1 közvetít. A LINGO-1-t az OL differenciálódás negatív szabályozójaként azonosították (Mi et al. 2005). Beszámoltak arról, hogy az OPC kultúrák anti-LINGO-1shRNS-sel kezelik a sejtek morfológiai differenciálódásának növekedését. Másrészt a LINGO-1-hiányos egerek vagy az anti-LINGO-1 antitesttel kezelt egerek nagyobb remyelinizációt és funkcionális helyreállítást mutattak, amikor az EAE-nek benyújtották őket (Mi et al. 2007). Ugyanezeket a megfigyeléseket tették, amikor az állatokat toxinok által kiváltott demielinizációnak vetették alá (Mi és mtsai 2009). Ami a Wnt jelátviteli utat illeti, Fancy et al. (2009) azonosították az útvonalhoz kapcsolódó géneket, amelyek a remyelinizáció során indukálódnak a kísérleti demielinizációnak alávetett egerekben. A remyelinizáció során a Wnt Tcf4-mediált aktivációja negatívan szabályozza az OPC differenciálódását (Fancy et al. 2009; Ye et al. 2009).
A központi idegrendszer fejlődése során a Shh szekréciós fehérje szükséges a gerincvelő és az előagy hasi régiójából eredő OPC-k első hullámának elköteleződéséhez (Fuccillo et al. 2006). A felnőtt agyban a Shh-szállítás az OPC-k populációjának növekedését indukálja az agykéregben és a corpus callosumban (Loulier et al. 2006). A lizolecitin által kiváltott corpus callosum demielinizációval végzett legújabb tanulmányok azt mutatták, hogy a Shh jelátvitel aktiválódik a remyelinizáció során, és hogy az adenovírus által közvetített Shh leadás serkenti az OPC proliferációját és érését (Ferent et al. 2013).
Összefoglalva: a demielinizáló sérülések után bekövetkező remyelinizáció nagyon összetett folyamat, amely különböző sejtpopulációkat foglal magában, több molekula (pl. Növekedési faktorok, citokinek) által szabályozva, és több jelátviteli kaszkádot foglal magában (pl. Notch-jelátvitel, Shh-jelátvitel). Ezen események ismerete az elmúlt évtizedekben jelentősen fejlődött. Számos szempont azonban ismeretlen marad, és a remyelinizáló terápiás megközelítések korlátozottak és kihívást jelentő kutatási területet jelentenek.
Remyelinizáció és öregedés
Összességében a fenti megállapítások azt a gondolatot kelthetik, hogy az életkorral összefüggő remyelinizációs kudarc nemcsak az öregedő OL-kkal és azok belső kapacitásaival kapcsolatos tényezőket, hanem számos olyan külső tényezőt is érinthet, még a központi idegrendszeren kívül is, amelyek befolyásolják az OPC differenciálódási képességét és végső soron befolyásolja a mielin helyreállítását (Redmond és Chan 2012).
Demielinizáció/remielinizáció és tápanyagok
Annak ellenére, hogy az étrendi zsírbevitel és az SM kockázata között nem egyértelmű a kapcsolat, az omega-6 és omega-3 PUFA-k gyulladáscsökkentő hatása közismert. Az omega-6 és az omega-3 PUFA egyaránt kompetitív inhibitora az arachidonsavnak, amelynek metabolitjai részt vesznek a gyulladásos folyamatban (Callegari és Zurier 1991; Gil 2002), és bebizonyosodott, hogy csökkentik a T-sejtek proliferációját (Rossetti és mtsai 1997). Másrészt a PUFA-kból származó molekulák pozitív hatással lehetnek az SM kezelésére: A lipoxinok csökkenthetik a gyulladást a neutrofil aktivitás csökkentésével (Yacoubian és Serhan 2007), míg az omega-3 PUFA-ból származó resolvinek és protekinek úgy tűnik, hogy szabályozzák a gyulladást. az idegrendszerben (Serhan és mtsai 2002). A PUFA-k számára fontos szerepet tulajdonítanak a peroxiszóma proliferátor-aktivált receptorok (PPAR) ligandumai. A PPAR-k ligandummal aktivált nukleáris transzkripciós faktorok, amelyek PPARγ izoformája jelen van az emberi T limfocitákban, és az omega-3 PUFA-k, amelyek PPARγ agonistaként működnek, enyhítik a gyulladást az EAE patkányokban (Niino és mtsai 2001). Továbbá, az omega-3 PUFA-k in vivo elősegítik a mielinnel kapcsolatos fehérjék, például a PLP és az MBP expresszióját (Salvati et al. 2008).
Figyelembe véve a vér – agy gát integritásának fontosságát az MS fiziopatológiájában, Liuzzi és mtsai. (2007) kimutatta, hogy a mikroglia in vitro kezelése omega-3 PUFA-val csökkenti a mátrix metalloproteinase-9 LPS által indukált termelését, amely részt vesz a vér-agy gát megszakadásának mechanizmusában, a gyulladásos sejtek behatolásában a központi idegrendszerbe, és ennek következtében demielinizáció.
Végül és ami a legfontosabb, az elmúlt években klinikai vizsgálatokat végeztek SM-es betegeknél, amelyek eredményei alátámasztották az étrendi PUFA-k pozitív szerepét a betegség progressziójában.
Másrészt a B12-vitamin cianokobalamin szintén pozitívan befolyásolhatja a remyelinizációt. Az interferon-β-val egyidejűleg beadott B12 elősegíti az OL érését mind in vivo, mind nem autoimmun primer demyelinizáló ND4 (DM20) transzgénekben, mind in vitro, a humán MO3-13 sejtvonalban és patkány gerincvelő oligodendrocytákban. Ezek a műveletek magukban foglalják a Notch1 jelátvitel csökkenését, valamint a Sonic hedgehog és receptorának, a Patched expressziójának növekedését, amely OL érést indukál és segít javítani a remyelinizációt (Mastronardi et al. 2004).
A diétás polifenolok az immunválasz modulálásával is csökkenthetik a demielinizációt. Ebben a tekintetben az epigallocatechin-3-gallát, egy zöld teaban bővelkedő flavan-3-ol, az immunsejt-beszivárgás gátlása, valamint a pro- és anti-autoimmun CD4 (+) T szabályozása révén csökkenti az EAE autoimmun válaszát. sejtek (Wang et al. 2012).
Összefoglalva, a legújabb kísérleti bizonyítékok arra utalnak, hogy a táplálkozás befolyásolhatja a demyelinizáló/remyelinizáló folyamatok fejlődését azáltal, hogy enyhíti a demyelinizációt és elősegíti a remyelinizációt. Tekintettel az öregedéssel összefüggő táplálkozási egyensúlyhiányokra, a tápanyagok mielinizációra gyakorolt hatásának ismeretében további előrelépés lehet nagy jelentőségű a demielinizáló állapotok kezelésében.
Következtetések
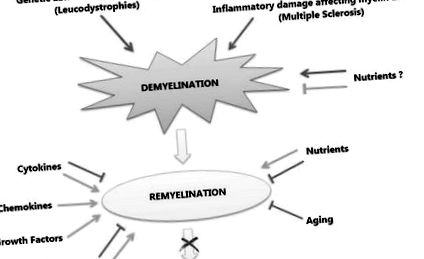
A demyelinizációs rendellenességeknél általában és különösen az SM-ben az azonnali remyelinizáció sikertelensége axonális sérüléssel és degenerációval társul, amelyet a betegség neurológiai fogyatékosságának fő okaként fogadnak el. A remyelinizációs folyamat a mielinációt a fejlődés során, de kóros környezetben összegzi. Különböző molekulák és jelátviteli utak vesznek részt a remielinizációs folyamatban, amelyek az axonok körüli új mielinhüvelyek létrehozásában részt vevő OPC-k proliferációját és érését indukálják vagy gátolják. Ugyanígy a nem betegséggel összefüggő tényezők, mint például az életkor és a genetikai háttér, valamint a környezeti tényezők, például az étrendi összetevők, hajlamosító tényezőként működhetnek, vagy védő vagy akár terápiás hatást fejthetnek ki bizonyos betegségfázisokban, negatív vagy pozitív eredmények (1. ábra).
Az elsődleges demyelinizációt vagy az OL-kat érintő genetikai rendellenességek, vagy a mielint és az OL-kat érintő gyulladásos károsodások okozhatják, ahogyan ez a SM-ben is előfordul. Míg egyes tápanyagok védő szerepet játszhatnak a demielinizációval szemben (zöld vonal), mások negatív szerepet játszhatnak (piros nyíl). A remyelinizáció a demielinizációra adott fiziológiai válasz. A remyelinizáció során egyes molekulák pozitívan (zöld nyilak) hatnak a folyamatra, például kemokinek és növekedési faktorok, míg mások kettős szerepet játszhatnak (zöld nyilak pozitív, piros vonalak negatívak), például bizonyos jelző kaszkádok és citokinek. A környezeti tényezők közül a tápanyagok szintén kettős szerepet játszhatnak, végül az öregedésnek egyértelműen negatív hatása van a folyamatra. Ezen tényezők kölcsönhatása meghatározza a remyelinizációs folyamat sorsát, amelynek kudarca neurodegenerációhoz vezet
- Az emésztőrendszeri betegségek és rendellenességek táplálkozási kezelése
- A hasi zsírlerakódást befolyásoló táplálkozási tényezők a baromfiban Áttekintés
- Tanulmány Bizonyos gyulladásos demyelinizáló betegségek más kategóriába tartoznak, mint a többszörösek
- Új perspektívák a Candida albicans növekedési sebességét befolyásoló táplálkozási tényezőkről cukorbetegeknél
- Az osteoarthritis táplálkozási kockázati tényezői A reumatikus betegségek évkönyvei