Elhízás, súlykezelés és kontroll
A cikk áttekintése 2. kötet 5. kiadás
Rajat Gupta, 1
Ellenőrizze a Captchát
Sajnáljuk a kellemetlenséget: intézkedéseket teszünk annak érdekében, hogy megakadályozzuk a csaló űrlapok beküldését az extrakciók és az oldalfeltérképezők által. Kérjük, írja be a megfelelő Captcha szót az e-mail azonosító megtekintéséhez.
1 Molekuláris Idegtudományi és Funkcionális Genomikai Laboratórium, Delhi Műszaki Egyetem, India
2 Neurológiai Tanszék, Tufts University School of Medicine, USA
Levelezés: Pravir Kumar, a Delhi Műszaki Egyetem (korábban Delhi Mérnöki Főiskola) Biotechnológiai Tanszékének docense # FW4TF3 terem; Gépészmérnöki épület Shahbad Daulatpur, Bawana Road, Delhi 110042, India, Kiegészítő Kar, Tufts Egyetem Orvostudományi Kar, Boston, USA, telefon: 919818898622
Beérkezett: 2015. február 26. | Megjelent: 2015. június 16
Idézet: Gupta R, Sawhney P, K Ambasta R és mtsai. Elhízás és neurodegeneráció. Adv Obes Súlykezelő ellenőrzés. 2015; 2 (5): 96-101. DOI: 10.15406/aowmc.2015.02.00029
Kulcsszavak: elhízás, idegsejtek elvesztése, hiperinsulinémia, jelátvitel, gyulladás
NDD, neurodegeneratív betegség; AD, alzheimer-kór; PD, parkinson-kór; Aβ, amiloid béta; NFT-k, neurofibrilláris gubancok; IKK-β, a kappa-b kináz nukleáris faktor gátlója; T2D, 2-es típusú cukorbetegség; CVD-k, szív- és érrendszeri betegségek; TNFa, tumor nekrózis faktor a; APP, amiloid prekurzor fehérje; MAP, mikrotubulusokkal társított fehérje; HD, Huntington-kór; IDE, inzulinbontó enzim
Az elhízás olyan egészségügyi rendellenesség, amely globálisan riasztó mértékben növekszik, főként a fejlett és a fejlődő országokban, különösen a gyermekek körében. 1 Ez a növekedés főként a mozgásszegény életmód, a magas zsírtartalmú, cukortartalmú táplálékfelvétel és a kevesebb fizikai aktivitás következménye. Az elhízás, ami a túlzott kalóriabevitelnek és a zsír zsírszövetekben történő trigliceridek formájában történő tárolásának tulajdonítható, a metabolikus szindróma fő mozgatórugója, és emellett kockázati tényezőként szolgál olyan krónikus betegségek kialakulásában is, mint a T2D és a kapcsolódó szív- és érrendszeri betegségek (CVD). . 2 Az elhízás a felgyorsult öregedési folyamathoz is társult. 3 Különféle fiziológiai elváltozásokat figyelnek meg egy elhízott egyénben, ti. inzulin tolerancia, amely a glükóz homeosztázisának károsodásához, központi elhízáshoz, diszlipidémiához vezet, ahol az utóbbit „metabolikus szindrómának” nevezik. E két szisztémás változással egyidejűleg az elhízásnak és a metabolikus szindrómának, vagyis a sejtkomponensek oxidatív károsodásának és a gyulladásgátló tényezők, például a TNFα (tumor nekrózis faktor α), a citokinek és az interleukinek fokozott szekréciójának is tulajdonítják. 4–6
Egyre több kutató javasolja az elhízás és az NDD patológiája közötti kapcsolatot. Az NDD-ket az emlékezet és a megismerés progresszív elvesztése jellemzi, ami végső soron halálhoz vezethet. Ez a romlás főként a fehérje rendellenes lerakódása, az oxidatív stressz és a lipidutak módosulása következtében fellépő gyulladás következménye. A 7,8 AD és a PD a két leggyakoribb neurodegeneratív betegség.
Az Alzheimer-kór az életkorral összefüggő leggyakoribb neurodegeneratív betegség
A 65 év feletti népesség 10% -a. 9 A 10 extracelluláris Aβ-plakkok és az NFT-k a betegség két jellegzetes elváltozása, amelyek más fiziológiai és szerkezeti változásokkal konjugálva súlyos idegsejtek diszfunkcióját és neuronveszteséget okoznak. Az amiloid prekurzor fehérje (APP) β-szekretázzal történő szekvenciális proteolitikus hasításából származó Aβ, amelyet y-szekretáz követ, általában 40-42 aminosav méretű. 12,13 Az AD agyban a tau aggregátumok NFT-k formájában vannak jelen. A Tau egy mikrotubulus-asszociált fehérje (MAP), amely kötődik a mikrotubulusokhoz és stabilizálja azokat. Amikor a tau ubiquitinizálódik és hiperfoszforilálódik, a mikrotubulusok iránti affinitása számos ilyen hiperfoszforilezett tau aggregátumot csökkentve együtt alkot (NFT). 14,15
A Parkinson-kór a második leggyakoribb neurodegeneratív betegség, amelyhez kapcsolódó kognitív és mozgássérülések vannak. Lewy test patológiája jellemzi. 5-25 µm átmérőjű citoplazmatikus zárványok, amelyek oldhatatlan szinaptikus fehérje α-szinuklein aggregátumokat tartalmaznak, míg a Lewy neuritek dystrophiás idegsejtek. Ez a két patológia a PD-vel összefüggő neuronvesztést okoz a substantia nigra régiójában. 16 Különböző tanulmányok azt sugallják, hogy potenciális kapcsolat van az elhízás előfordulása és az NDD-k patológiája között, például AD, PD, Huntington-kór (HD) stb. Bár az elhízás és az NDD közötti genetikai kapcsolatokat nemigen értik, ma már sok minden ismert a két betegség funkcionális változásairól és kölcsönös hatásáról.
Az elhízás fiziológiai változásai hozzájárulnak a neurodegenerációhoz
Inzulinrezisztencia: Az inzulin egy peptid hormon, amely kritikus szerepet játszik a perifériás glükóz homeosztázisban, szabályozva a máj glükóztermelésének, valamint az izom- és zsírszövetek általi felvétele közötti egyensúlyt. Az inzulin fontos neurotróf tulajdonságokkal rendelkezik az agyban. A hormont a vér-agy gáton keresztül szállítja a központi idegrendszerbe az inzulin receptorok által közvetített transzportmechanizmus. Ezek a receptorok főleg a hippocampusban, az entorhinalis kéregben és a frontálisban helyezkednek el, amelyek a tanulásban, az emlékezetben és a megismerésben működnek. 17.
Megfigyelték, hogy a zsigeri zsírbetegség az inzulinrezisztencia egyik fő oka. A zsigeri zsírszövetek magas anyagcseréjük miatt endokrin szervként hatnak, és szekretálják az adipokint (pl. Leptint) és a citokint (pl. TNF-α, IL-6, heparint kötő epidermális növekedési faktor). A proinflammatorikus utak aktiválása és a citokinek szekréciója inzulinrezisztenciához vezet. Agyi inzulinhiány és rezisztencia a trofikus faktor visszavonása, az energia-anyagcsere hiánya és az inzulinra reagál gén expressziójának gátlása miatt neuronhalált vált ki, serkenti ezáltal a neurodegenerációt. 18.
Parkinson-kór esetén az inzulin negatívan szabályozza az agy dopaminerg aktivitását. Az inzulin gátolja a substantia nigra-ban található dopamintartalmú idegsejtek égetését, és megállítja vagy megfordítja a dopaminerg sejtek kibocsátási arányának növekedését, amelyet a dopamin-receptor antagonista haloperidol általában kivált. 19 Emellett a reaktív oxigénfajok krónikus hiperglikémiát eredményezhetnek a hiperglikémiás állatok dopaminerg sejtvesztésének hátterében. A krónikus hiperglikémia azonban csak egy kisebb rizikófaktor a Parkinson-kór esetében az embereknél. 20
Glükóz intolerancia és 2-es típusú diabetes mellitus.
Az inzulinrezisztencia az elhízás és a glükóz-intolerancia gyakori patofiziológiai jellemzője, mivel befolyásolja a membrán kation transzportját. A glükóz intolerancia a hiperglikémia pre-diabéteszes helyzete, amely az inzulinrezisztenciával és a kardiovaszkuláris és neurológiai patológia fokozott kockázatával jár. A glükóz tolerancia romlása megelőzi a T2D mellitust, amely viszont számos neurodegeneratív rendellenesség okozója. A diabetes mellitus makrovaszkuláris és mikrovaszkuláris szövődményeinek kezelési stratégiái mélyen javultak. Ezért az emberek hosszabb ideig élnek cukorbetegségben, ami számos új szövődmény kialakulásához vezetett. A demencia az egyik példa ezekre a kialakulóban lévő új szövődményekre. Az általános népességhez képest a demencia fokozott kockázata 50% –150% a T2DM-ben szenvedőknél. A T2DM szorosan összefügg a demencia azonosított kockázati tényezőivel, beleértve az érelmeszesedéses érrendszeri betegségeket, az APOE-ε4 allélt. Számos kutatás kimutatta, hogy az APOE-ε4 alléldel járó cukorbetegség a demencia fokozott kockázatával járt. 23
Az agysejtek nem képesek szintetizálni vagy tárolni a glükózt; ezért át kell szállítani a vér-agy gáton. Ezt olyan glükózszállítók végzik, mint a GLUT-1, a GLUT-3 és a GLUT-4. 24 A glükóz-diszmetabolizmus állapotában a fejlett glikációs végtermékek (AGE-k), amelyek Maillard-reakció termékei, elkezdhetik felhalmozni a sejteket. Az olyan AGE-k, amelyek glikált Aβ-k, amelyek hajlamosabbá teszik ezeket a peptideket az aggregálódásra, az AGE-k szintén szerepet játszanak a tau hiperfoszforilezésében. Az Ap ezen módosulása szenilis plakkok képződését, tau hiperfoszforilációt és ezt követő neurofibrilláris gubancok képződését eredményezi, amelyek az AD patológia jellemzői. 25
Hyperinsulinemia - az AD kockázati tényezője
Az inzulin az intracelluláris felhalmozódás csökkentésével szabályozza az amiloid prekurzor fehérje anyagcserét. Mérsékelt koncentrációban az inzulin az esszenciális neurotranszmitterek, például az acetilkolin és a noradrenalin szintéziséhez is társul. Az agyban megnövekedett inzulinszinttel rendelkező hiperinsulinémia az Aβ-clearance csökkenésével járhat a fő lebontó mechanizmusukért - az „inzulinbontó enzimért” - folytatott verseny miatt. Az IDE egy multifunkcionális enzim, amely lebontja az inzulint és az amilint, a T2D patológiájához kapcsolódó peptideket, az Aβ peptiddel együtt az AD agyban. A hiperinsulinémia emelheti az Aβ szintjét az inzulin versengésével az IDE-vel szembeni Aβ-val. Ezért az IDE potenciális kapcsolat a hiperinsulinémia és az AD között. Mivel az IDE sokkal szelektívebb az inzulinra, mint az Aβ-ra, az agyi hiperinzulinémia megfoszthatja Apot fő clearance-mechanizmusától, támogatva az agyban történő lerakódását, és ezáltal későbbi neurotoxikus hatásait. 27.
Diszlipidémia
A dislipidémia az elhízás egyik következménye, amelyet a trigliceridek és a szabad zsírsavak növekedése, valamint a HDL-C és a HDL csökkenése jellemez. 28 A szabad zsírsavaknak ez a növekedése az elhízás által kiváltott gyulladással együtt inzulinrezisztenciához vezet. 29 A zsírsavak közül sok citotoxikus és gyulladást okozhat az olyan gyulladásos citokinek szintézisének stimulálásával, mint a TNF-α, IL-1, IL-6 stb.
Adipokin szekréció
Az adipokinek oldható mediátorok, amelyeket főleg parakrin, autokrin vagy szisztémás módon ható adipociták termelnek. Eddig több mint 50 adipokint azonosítottak, amelyek közül a leptin, az autotaxin és az adiponektin kimutatták, hogy meghatározó szerepet játszanak a neurodegenerációban. 31
A leptin (amelyet 1994-ben azonosítottak) egy 16KDa fehérje, amelyet elhízott (ob) génből fordítanak le, amely az éhség gátlásával szabályozza az elhízást. 32 A leptin elsősorban a hipotalamusz régiójára hat, és szabályozza az étvágyat. A leptin receptorok extra hipotalamusz régiókban is expresszálódnak, mint amygdala, agytörzs és kisagy.
Az adipokin szekréció hatása az AD-re: Normál sejtben a leptin neuroprotektorként működik, gátolva a sejthalált, csökkentve a sejtek citotoxicitását és csökkentve az oxidatív stressz hatásait. A diéta által kiváltott, elhízott rágcsálókon végzett kísérletekből arra a következtetésre jutottak, hogy a vér-agy gát transzport rendszer aktivitása csökken, ami a leptin keringésében az agy célpontjaihoz vezet. Így a leptin szignalizációja jelentősen csökken a hipotalamusz íves magjában. A leptin expresszió negatívan korrelál az AD patológiával, mivel szabályozza az Aβ szintet az intraneuronális lipidek felhalmozódásának elnyomásával és a GSK-3β gátlásával, ezáltal csökkentve a tau foszforilációját és a neurofibrilláris gubancok kialakulását. 33
Az adipokin szekréció hatása a PD-re: A PD-t a dopamin-termelő idegsejtek elvesztése jellemzi a substantia nigra-ban. A leptin védő hatással van a 6-OHDA (6-hidroxidopamin) toxicitás ellen a dopaminerg neuronokban, és megőrzi a dopamin rendszer működését. Mivel az elhízás miatt a leptin szintje csökken, a PD kockázatának növekedése. 34
Ideggyulladás
A neuroinflammáció leírható az agy veleszületett immunreakciójának aktiválásaként a központi idegrendszer fertőzések, sérülések és betegségek elleni védelme érdekében. A neuroinflammáció egy összetett reakciósor, amely sejt- és molekuláris változásokat, perifériás immunválasz aktiválását, intracelluláris jelátviteli útvonal elindítását, gyulladásos mediátorok felszabadulását eredményezi, ami neuronális diszfunkcióhoz és veszteséghez vezet. A neuroinflammáció neurodegenerációhoz vezet az IKKβ/NF-κB útvonal aktiválásával, a vér-agy gátjának diszfunkciójával és a makrofágok (asztrociták és mikroglia) felhalmozódásával. Az elhízás a fehér zsírszövet felhalmozódásához vezet, amely kulcsfontosságú hely a szisztémás gyulladás megkönnyítésében. 39 A hipertrófiás adipociták és a zsírszövet immunsejtjei megnövelik a keringő proinflammatorikus citokinek szintjét, mint például a TNF-α, IL-6, IL-1β stb. a megismerésben és az emlékezetben. Elhízott embereknél a zsírszövetekben makrofágok felhalmozódását és aktiválódását figyelték meg. 44 A neuroinflammáció tehát a neurodegenerációhoz vezető elhízás következményének tekinthető.
A hipotalamusz a gyulladás által érintett központi idegrendszer legnagyobb részét képezi. A hipotalamusz gyulladása a hipotalamusz sejtes és molekuláris változásaira utal, fizikai sérülések, traumák, fertőzések, anyagcserezavarok és öregedés következtében. A hipotalamusz szabályozza az energiaegyensúlyt, szabályozza az élettani folyamatokat, mint az etetés, az energiafelhasználás, a testtömeg és a glükóz metabolizmus. A hipotalamusz (MBH) mediobasalis régiója felismeri a különféle keringő jeleket, és aktiválja a downstream jelátviteli útvonalakat az anyagcsere-fiziológia ellenőrzésére. Beszámoltak arról, hogy az IKKβ/NF-κb hipotalamusz-gyulladást vált ki, amely olyan diabéteszes változásokat okozhat, mint a glükóz intolerancia, az inzulinrezisztencia és az inzulinszekréció károsodása. Az IKKβ/NF-κb útvonal aktiválása befolyásolja a bevágási jelátviteli utat, hogy gátolja a neuronális őssejtek differenciálódását és rontja ezeknek a sejteknek a túlélését, neurodegenerációt okozva, amely olyan betegségeket eredményezhet, mint az AD. 48
Az elhízás miatti jelátviteli utak megváltozása
Számos útváltozás nyilvánvaló az elhízásban, amely befolyásolhatja az agy normális működését. Ezek a megváltozott utak káros hatásokhoz vezetnek az agysejteken, mint például az oxidatív stressz, az ER stressz és a mitokondriális diszfunkció, ezáltal a sejtmechanizmus diszfunkcióját és fokozatosan idegsejtvesztést okozva.
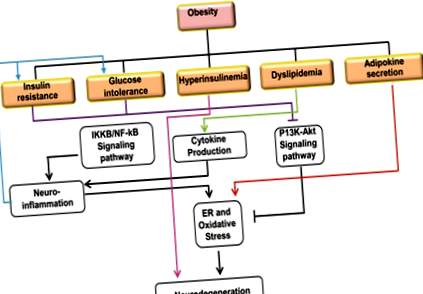
Az inzulin és az inzulin növekedési faktor 1 (IGF-1) fontosak az agyi glükóz homeosztázisban és a sejtek túlélésében, amelyek akár parakrin, akár autokrin módon hatnak a P13K-Akt jelátviteli útvonalon keresztül. 50 Ez az út érzékeny a különféle metabolikus jelekre és stressz állapotokra, és főként a daganatképződés és az apoptózis gátlásában vesz részt. Normál inzulin körülmények között az inzulinreceptorok (IR)/IGF-1R aktiválódnak az oxidatív stressz hatására, míg a glikogénszintaszekináz-3 β (GSK-3β) gátolt. Ez a 4-hidroxinonenal (4-HNE) megnövekedett termelésével jár együtt a neuronális lipidek és fehérjék oxidatív védelme érdekében. 52 Az inzulin/IR és IGF-1/IGF-1R károsodása azonban az elhízott vagy a T2D agy megváltozott inzulin- és/vagy IGF-1-szintjének eredménye. Ez a megváltozott jelátvitel az APP diszmetabolizmusához és tau hiperfoszforilációs stimulációjához kapcsolódik, amely az AD két jellemző oka. 53,54 (1. ábra)
A gyulladásos választ az IKKb/NF-κB út aktiválása közvetíti. 55 Az IKKb/NF-kB által kiváltott hipotalmikus gyulladás kimutatták, hogy glükóz intoleranciát és inzulinrezisztenciát okoz. 56 Ezen az úton az IKKβ lebontja az IkB fehérjét és felszabadítja az NF-κB-t, amely a magban lokalizálódik és aktiválja a gyulladásos fehérjék transzkripcióját. Elhízás esetén a Toll-szerű receptorok (TLR) és a citokin-receptorok kimutatták, hogy az IKKb/NF-κB útvonal aktiválásával közvetítik a neuroinflammációt. 57,58 tanulmány kimutatta, hogy a hipotalmikus gyulladás az IKKb/NF-κB útvonal aktiválásával érhető el ER stressz és autofágia hibák révén. 59–74 (1. táblázat)
Az elhízásban és a neurodegenerációban részt vevő gének
- Online könyvklub, az elhízás lehetséges felszámolása Amerikában, jegyek, szombat, 2020. október 24., 12 óra
- Az orvosok kevésbé kötik össze az elhízott betegeket - Gudzune - 2013 - Elhízás - Wiley Online Könyvtár
- Az elhízás orvosának tippjei a fogyásért, mivel Boris Johnson sürgeti a briteket az egészség javítására - Mirror Online
- Elhízás és mentális egészség
- Elhízás és túlevés Hogyan lehet megtörni egy rossz szokást - ABC News